肾透明细胞癌差异表达基因及其关键通路的生物信息学分析
2018-06-25南方医科大学南方医院广东广州510515
(南方医科大学南方医院 广东 广州 510515)
孙雅玲 陈龙华(通讯作者)
1.背景介绍
肾细胞癌简称肾癌,起源于肾小管上皮细胞,是泌尿系统常见的恶性肿瘤之一,其中肾透明细胞癌为最主要的类型,约占肾细胞癌的75%[1]。肾透明细胞癌起病隐匿,约30%患者诊断时已为晚期,失去手术机会,而肾透明细胞癌对于放疗及化疗均不敏感。目前临床应用中尚无可靠的诊断标记物,因此检测肾细胞癌差异表达基因,寻找分子诊断标记物及潜在临床治疗靶点具有重要意义。
肾透明细胞癌的发生发展是一个多基因多步骤的过程,而高通量测序技术的发展及基因芯片的出现为研究肾透明细胞癌基因表达谱情况提供了基础。本研究利用GEO数据库中的肾透明细胞癌基因芯片进行生物信息学分析,以期获取肾透明细胞癌相关的关键基因,为后续寻找分子标记物及治疗靶点提供理论基础。
2.材料和方法
2.1 芯片数据获取
从GEO中下载肾透明细胞癌基因表达谱芯片GSE46699,该芯片基于GPL571 平台([HG-U133_Plus_2]Affymetrix Human Genome U133 Plus 2.0 Array),共有130例肾透明细胞癌及正常肾组织样本,本研究选取其中32例非吸烟非肥胖肾透明细胞癌患者样本和28例非吸烟非肥胖正常对照样本进行分析。
2.2 数据预处理与差异表达基因分析
数据处理和分析使用R软件进行。对原始表达数据使用RMA算法进行标准化,使用“Limma”包筛选在肾透明细胞癌及正常肾组织中差异表达的基因,差异基因筛选标准:校正后P值(adjustP-value) < 0.05,|logFC|> 1。
2.3 GO和KEGG分析
通过DAVID数据库对差异表达基因在GO中注释其参与的生物学过程,并进行KEGG通路富集分析。以P<0.05作为显著性阈值。
2.4 蛋白互作网络构建及枢纽基因筛选
使用STRING数据库对差异表达基因对应蛋白质进行相互作用关系分析,以此构建蛋白互作网络图并用Cytoscape软件进行可视化,通过计算单个蛋白质节点与其他节点间的关系强度来筛选排名前20的枢纽基因。
3.结果
3.1 差异表达基因筛选结果
在GSE46699芯片中根据筛选标准共得到848个差异基因,其中上调基因有384个,下调基因有464个,差异表达基因热图见图1。

图1 差异表达基因热图
3.2 GO功能富集分析
采用DAVID数据库对848个差异基因所参与的生物学过程进行分析,结果显示差异基因主要涉及免疫反应、防御反应、炎症反应、血管形成等过程(图2)。
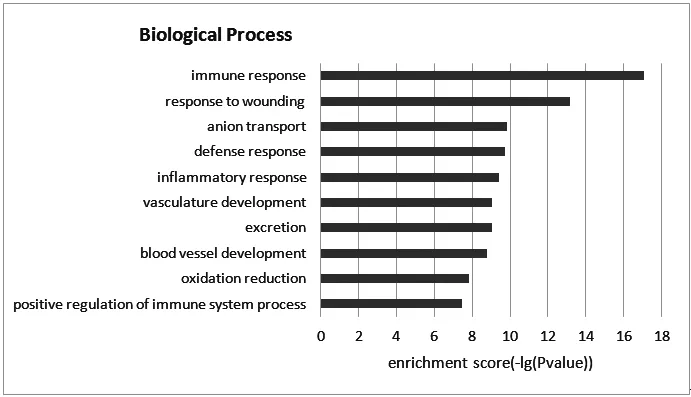
图2 差异表达基因功能富集分析
3.3 差异表达基因的KEGG通路分析
利用DAVID数据库对差异基因进行KEGG通路分析,结果显示差异基因主要集中在细胞黏附分子、氨基酸代谢降解、PPAR信号通路等通路中(图3)。

图3 差异表达基因KEGG通路分析
3.4 蛋白互作网络和枢纽基因
通过STRING数据库对差异表达基因对应蛋白产物的相互作用关系进行分析,并应用Cytoscape软件构建蛋白质相互作用网络(图4)。进一步计算每个节点与其他节点相关的数目并由高到低进行排序,获得排名前20的枢纽基因,包括COL1A1、COL1A2、COL6A2、COL6A3、COL4A2、COL4A4、COL4A5、COL4A3、COL3A1、COL5A2、COL5A1、COL8A1、COL15A1、COL23A1、COL21A1、DCN、FN1、CCL5、CXCR4、CXCL9。

图4 蛋白相互作用网络图
4.讨论
肾透明细胞癌是泌尿系统最常见的原发性肿瘤,约占实体瘤的3%,它具有发展快,易转移,易复发等特点,且对放化疗及内分泌治疗均不敏感。肾透明细胞癌的发生发展是一个多基因参与,涉及多个步骤的过程,目前其具体的分子生物学机制尚不清楚。为进一步了解肾透明细胞癌发生发展的分子机制,筛选可作为临床诊断的关键基因和潜在治疗靶点,本研究以肾透明细胞癌为研究对象,通过生物信息学方法对GEO数据库相关芯片GSE46699进行分析,筛选差异表达基因并对差异基因进行功能注释、通路分析和对应蛋白质相互作用关系分析。
通过将肾透明细胞癌组织测序信息和正常组织测序信息进行比较,共筛选出848个差异表达基因,其中包括384个上调基因,464个下调基因。使用STRING数据库对差异基因编码的蛋白质之间的相互作用进行分析,构建出了以COL1A1、COL1A2、COL6A2、COL6A3、COL4A2、COL4A4、COL4A5、COL4A3、COL3A1、COL5A2、COL5A1、COL8A1、COL15A1、COL23A1、COL21A1、DCN、FN1、CCL5、CXCR4、CXCL9等为中心节点形成的蛋白互相作用网络。对以上枢纽基因进行文献检索,发现其中一些基因与肿瘤的发生发展关系密切。COL1A1、COL1A2基因分别编码I型胶原纤维的α1链和α2链,而I型胶原纤维参与形成细胞外基质,对于细胞的粘附及分化有重要作用,此外,COL5A1、COL8A1、FN1等也均为细胞粘附相关基因。和正常细胞相比,肿瘤细胞间的粘附作用普遍降低,促进了肿瘤细胞的迁移。在肾透明细胞癌中,研究发现COL1A1、COL5A1、COL8A1、FN1表达升高且与患者的不良预后相关,在肾癌细胞株Caki-2中,外源性补充TGF-β1可上调COL1A1、COL5A1、COL8A1、FN1的表达[2]。因此,细胞粘附性的改变可能在肾透明细胞癌的发生发展过程中发挥了重要作用。
在这20个枢纽基因中,CCL5、CXCR4、CXCL9与炎症及免疫密切相关,其中CCL5是CC趋化因子亚家族成员,CXCL9是CXC趋化因子亚家族成员,CXCR4是CXC趋化因子受体之一。炎症及免疫反应在肿瘤的发生发展中扮演着重要角色,其中,CXC趋化因子配体及其受体被发现可以调节肿瘤相关血管生成,影响肿瘤细胞增殖、侵袭和转移等生物学行为,调节肿瘤细胞与免疫细胞间的相互作用。在肾癌中,多种趋化因子配体及其受体的表达水平均发生了改变,且与肿瘤分期及患者预后显著相关,有可能成为新型诊断及预后分子标志物[3],其中CXCR4的高表达被证实是肾透明细胞癌患者预后的独立危险因素,其结合TNM分期构建的列线图预测模型可以更准确地预测患者的总生存时间[4]。在伴有转移的肾癌病人外周血中分离出细胞角蛋白阳性的循环肿瘤细胞,其表面也可见CXCR4表达,且CXCR4在肾癌组织的表达程度与肿瘤转移能力直接相关,在小鼠体内抑制CXCL12/CXCR4轴可以废止肾透明细胞癌向其它组织的转移[5]。包括CXCL9在内的干扰素诱导产生的CXCR3配体可以参与免疫调节及血管生成[6,7],在肾癌小鼠模型中联用IL-2和CXCL9可以抑制肿瘤生长,减少肿瘤血管生成,增加CXCR3阳性单核细胞向肿瘤的浸润[8]。在临床上,基于CXCL9等因素构建的ICL评分可以预测无转移肾透明细胞癌患者术后复发风险[9]。
CCL5作为一种趋化因子,主要趋化单核细胞、中性粒细胞等细胞向炎症部位迁移,近年来,CCL5/CCR5轴在肿瘤中的生物学作用引起了广泛关注。研究发现CCL5/CCR5轴可以参与免疫调节,并与多种肿瘤的进展密切相关[10,11]。在肾透明细胞癌中,患者血清中CCL5的浓度被证实明显升高,同时CCL5在肾透明细胞癌组织样本中的蛋白表达水平也显著上调,并与患者的临床病理分期正相关,与总生存时间负相关[12],这提示CCL5有可能成为肾透明细胞癌患者预后判断的分子学指标。此外,CCL5介导了骨髓间充质干细胞对于肾透明细胞癌生物学行为的调控,特异性阻断CCL5可以显著抑制肾癌细胞的侵袭、迁移并可以延长荷瘤小鼠的总生存时间,CCL5有望成为肾透明细胞癌临床治疗的潜在新靶点[13]。
综上所述,本研究应用生物信息学方法对肾透明细胞瘤基因芯片数据进行了挖掘,筛选出肾透明细胞癌与正常肾组织差异表达基因并从生物学功能、参与通路等多角度进行分析,进一步甄别出20个枢纽基因,从分子水平为探讨肾透明细胞癌发生发展机制提供了理论依据,同时也为肾透明细胞癌早期诊断及靶向治疗提供了潜在线索,但这些关键基因的具体作用及相关机制后期还需要进一步的实验验证。
[1] Lopez-Beltran, A.,et al.,2004 WHO classification of the renal tumors of the adults.Eur Urol,2006.49(5):p.798-805.
[2] Boguslawska, J., et al.,Expression of Genes Involved in Cellular Adhesion and Extracellular Matrix Remodeling Correlates with Poor Survival of Patients with Renal Cancer.J Urol, 2016. 195(6): p. 1892-902.
[3] Tsaur, I., et al.,Chemokines involved in tumor promotion and dissemination in patients with renal cell cancer. Cancer Biomark, 2011. 10(5): p. 195-204.
[4] An, H., et al., High CXC chemokine receptor 4 expression is an adverse prognostic factor in patients with clear-cell renal cell carcinoma. Br J Cancer, 2014. 110(9): p. 2261-8.
[5] Arisaka, O., et al., Radiological case of the month.Hydrocolpos in virilizing congenital adrenal hyperplasia. Am J Dis Child, 1992. 146(8): p. 949-50.
[6] Hanahan, D. and J. Folkman, Patterns and emerging mechanisms of the angiogenic switch during tumorigenesis.Cell, 1996. 86(3): p. 353-64.
[7] Van Raemdonck, K., et al., CXCR3 ligands in disease and therapy. Cytokine Growth Factor Rev, 2015. 26(3): p. 311-27.
[8] Pan, J., et al., CXCR3/CXCR3 ligand biological axis impairs RENCA tumor growth by a mechanism of immunoangiostasis. J Immunol, 2006. 176(3): p. 1456-64.
[9] Van Raemdonck, K., et al., CXCR3 ligands in disease and therapy. Cytokine Growth Factor Rev, 2015. 26(3): p. 311-27.
[10] Aldinucci, D. and A. Colombatti, The inflammatory chemokine CCL5 and cancer progression. Mediators Inflamm,2014. 2014: p. 292376.
[11] Mencarelli, A., et al., CCR5 Antagonism by Maraviroc Reduces the Potential for Gastric Cancer Cell Dissemination.Transl Oncol, 2013. 6(6): p. 784-93.
[12]梁亮,等,趋化因子CCL5表达与肾透明细胞癌病理特征及预后的相关性研究.现代肿瘤医学,2018(3):第405-408页.
[13]梁亮,等,驱化因子CCL5介导骨髓间充质干细胞增加肾透明细胞癌细胞侵袭迁移能力.现代肿瘤医学,2017(23):第3746-3750页.
