奈达铂对比顺铂同步调强放化疗治疗局部晚期头颈部鳞癌临床观察
2018-06-25敖睿朱学强刘浩蔡丽君杨柳
敖睿 朱学强 刘浩 蔡丽君 杨柳
(四川省人民医院肿瘤科 四川 成都 610072)
头颈部肿瘤是恶性肿瘤的常见好发部位,在所有恶性肿瘤当中,头颈部恶性肿瘤居世界恶性肿瘤发病率第6位[1]。头颈部鳞癌占头颈部恶性肿瘤的90%以上[2],主要发生于咽喉部的鳞状上皮。而因为鼻咽癌的流行病学有非常明显的地域特征(主要好发于中国南部及东南亚,俗称广东癌),且发病因素、病理类型及治疗方式也不同于其他头颈部鳞癌,所以目前国际上俗称的头颈部鳞癌主要指除鼻咽部以外的发生于头颈部鳞状上皮的恶性肿瘤[3]。头颈部鳞癌在发现时60%已经是局部晚期,治疗以包括手术放疗化疗靶向等综合治疗为主的治疗方式[4]。因为头颈部手术对患者生活质量影响非常大,很多患者并不愿意选择手术治疗,除手术治疗外,局部放疗同步化疗是目前标准的治疗方式[5],同步化疗的标准药物仍然是顺铂[6],但是顺铂胃肠道发应大,加上放疗本身带给患者的口腔反应,其治疗过程本身带给患者巨大的痛苦及精神负担。奈达铂是日本研发的另外一种铂类药物,临床数据证实胃肠道反应轻,所以我们采用奈达铂对比顺铂同步调强放疗治疗晚期头颈部鳞癌患者,现总结如下。
1.资料与方法
1.1 临床资料
一共46例患者纳入本研究,其中男39例,女7例,中位年龄57.3岁,所有患者均病理证实为鳞状细胞癌,其中口咽部鳞癌12例,喉癌9例,下咽部鳞癌14,口腔鳞癌11例。治疗前所有患者均进行ct或MRI等影像学检查并明确分期为Ⅲ~Ⅳ期(AJCC第6版分期),患者均拒绝手术治疗。患者分为两组,其中奈达铂同步放疗及顺铂同步放疗组各23例。两组患者基线资料如下(表1)。

表1 两组患者基线治疗
1.2 入组及排除标准
1.2.1 入组标准 (1)病理证实为头颈部鳞癌;(2)临床分期为Ⅲ-Ⅳ期;(3)有可测量病灶;(4)PS(Performance Status)评分≤2分;(5)血常规肝肾功心电图排除放化疗禁忌;(6)预计生存期大于3个月。
1.2.2 排除标准 (1)鼻咽癌患者;(2)孕妇或哺乳期患者;(3)年龄<18岁;(4)既往曾经接受过放化疗。
1.3 放疗方案
患者均采用头颈肩热塑膜固定,CT模拟定位机扫描,采用ECLIPSE系统勾画靶区及计划设计。放疗采用瓦里安的TRUEBEAM进行放射治疗,放疗均采用调强放疗,放疗期间每周进行1次CBCT位置验证,原发灶剂量68~71GY/32~35次,转移淋巴结剂量给与66~70GY/32~35次。
1.4 同步化疗方案
同步化疗均采用周同步方案化疗,顺铂组每次35mg/m2,奈达铂组每次35mg/m2。如白细胞小于3×109/L给与粒细胞集落刺激因子升白治疗,如同步前白细胞不足2.5×109/L,暂停同步化疗。如血小板小于70×109/L给与巨和粒升血小板治疗,如同步前血小板小于50×109/L,暂停同步化疗。患者血色素小于90g/L暂停同步化疗。患者体重下降超过10%暂停同步化疗。
1.5 观察指标
1.5.1 治疗按计划完成情况 统计患者放疗完成率,同步化疗的周期数,并进行比较。
1.5.2 治疗近期疗效评价 所有患者在放疗结束后3月进行影像学检查及内窥镜检查进行复查。疗效评价采用WHO实体瘤疗效评价标准评价:完全缓解(CR):病灶全部消失;部分缓解(PR):病灶缩小超过50%;稳定(SD):病变缩小小于50%或增大不超过25%;进展(PD):病灶增大超过25%或出现新的病灶。治疗有效率=完全+部分缓解/患者总数,无效=稳定+进展/患者总数。
1.5.3 副反应评价 放疗副反应按照RTOG放射反应评分,化疗副反应按照WHO化疗副反应标准进行评价。
1.6 统计学方法
采用SPSS9.0对数据进行统计分析,计数资料以例数表示,理论频数>5的组间比较采用卡方检验,理论频数≥1的组间比较采用校正卡方检验,P<0.05为差异有统计学意义。
2.结果
2.1 治疗完成情况
所有患者均完成放疗,放疗完成率两组患者均为100%。顺铂同步化疗组全部完成6~7次同步化疗的患者为11例,同步化疗≥4次的患者14例,没有达到同步化疗4次的患者8例,奈达铂组完成6~7次同步化疗的患者为15例,同步化疗≥4次的患者6例,没有达到同步化疗4次的患者2例。奈达铂组完成4次及以上同步化疗患者的比例明显高于顺铂同步放化疗组。对于两组患者同步化疗达到4次的比例进行统计学比较,P值小于0.05,有统计学意义,见表2。

表2 两组患者同步化疗完成情况比较
2.2 近期疗效评价
两组患者近期有效率基本一致,顺铂组完全缓解5例,部分缓解5例,有效率达到87.0%,奈达铂组完全缓解14例,部分缓解5例,有效率达到82.6%,两组患者有效率行卡方检验比较,P值大于0.05,无统计学意义(表3)。

表3 两组患者治疗有效率比较
2.3 副反应评价
两组患者毒副反应在白细胞下降、血色素下降及口腔粘膜反应方面,比例没有明显的差异。奈达铂组患者出现Ⅲ度及以上血小板下降的比例明显高于顺铂组,统计学分析有意义;而顺铂组恶性呕吐反应比例明显高于奈达铂组,P值小于0.05,有统计学意义(表4)。
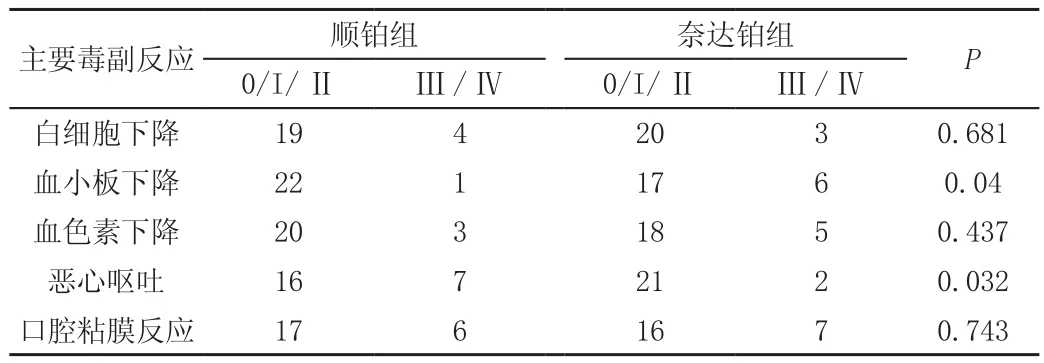
表4 两组患者主要毒副反应比较
3.讨论
头颈部鳞癌是临床上比较常见的一种恶性肿瘤,其发病原因与不良的生活习惯诸如吸烟饮酒及不良的卫生习惯有关系,另外也与人类乳头瘤状病毒感染及某些生活习惯(比如咀嚼槟榔)有关系[7]。头颈部解剖结构复杂,有众多复杂精细的神经肌肉骨骼及血管淋巴系统,主管人体呼吸发音吞咽等多种重要的生理功能。头颈部局部晚期鳞癌的治疗主张包括手术放疗化疗靶向治疗在内的多学科综合治疗,但是手术会给患者带来严重的容貌毁损,并对各种生理功能造成严重的影响,很多患者不愿意接受。而目前已经有研究证实,同步放化疗可以更好的给与患者提供器官保护功能,且相比较放疗配合诱导及辅助化疗,可以提高6.5%的5年生存率[8]。目前放疗技术在不断的发展进步,从以前的二维放疗发展至三维适型放疗,再到现在的调强放疗。放疗在头颈部肿瘤治疗方面有比较明显的优势:一是头颈部解剖复杂,重要器官多,手术困难;另外头颈部各解剖部位在放疗过程中器官运动少,可以更好的发挥精确放疗的特点。调强放疗可以更好的保护放疗范围以外的正常器官及提高靶区剂量[9],所以可以提高治疗效果及降低放疗副反应。但是标准的同步化疗药物顺铂因为其严重的胃肠道反应,如恶心、呕吐,在同步治疗过程中给患者带来巨大的痛苦,所以头颈部肿瘤专家一致在致力于寻找一种副反应更轻的药物替代顺铂同步放疗。奈达铂是日本研发的第二代铂类药物,是一种广谱抗肿瘤铂类药物,可以应用在肺癌、妇科恶性肿瘤及头颈部恶性肿瘤[10]。奈达铂相比顺铂胃肠道反应更轻,在头颈部同步放疗中患者对治疗接受度更高,目前已经有一些奈达铂同步放疗治疗头颈部鳞癌的报道。王枫等报道奈达铂同步放疗治疗老年头颈部鳞癌,总有效率达到了80%,1年生存率达到了72%[11]。谢忆山等比较了奈达铂对比顺铂同步放疗治疗头颈部鳞癌,认为奈达铂同步放疗胃肠道反应更轻,而近期疗效与顺铂基本一致[12]。我们的临床研究也对比了奈达铂及顺铂同步调强放疗治疗头颈部鳞癌的疗效,近期有效率相似,均达到了80%以上。奈达铂虽然出现Ⅲ度以上骨髓抑制的比例更大,但是奈达铂同步放疗胃肠道反应更轻,患者同步4次以上比例也相较于顺铂明显提高,所以奈达铂同步放化疗治疗头颈部鳞癌的远期疗效还值得更多的期待。
[1] LA Torre,F Bray,RL Siegel,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] J Ferlay,I Soerjomataram,M Ervik,et al.Cancer incidence and mortality worldwide:IARC CancerBase No.10[J].International Journal of Cancer Journal International Du Cancer, 2012,136 (5):E359-E386.
[3] PM Harari,J Harris,MS Kies,et al.Postoperative Chemoradiotherapy and Cetuximab for High-Risk Squamous Cell Carcinoma of the Head and Neck:Radiation Therapy Oncology Group RTOG-0234[J].Journal of Clinical Oncology.2014,32(23):2486-95.
[4] WR Kennedy,RJ Amdur,BJ Boyce,et al.Neck Management with Total Laryngectomy and Adjuvant Radiotherapy in Locally Advanced Larynx Cancer[J].Oncology Research & Treatment ,2017,40 (9):503.
[5] Pignon JP,le Maître A,Maillard E,et al.Meta-analysis of chemotherapy in head and neck cancer (MACH-NC):An update on 93 randomised trials and 17,346 patients[J].Radiother Oncol.2009;92(1):4-14.
[6] LM Nair,RR Kumar,KC Thomachan,et al.Phase IIb trial comparing two concurrent cisplatin schedules in locally advanced head and neck cancer[J].South Asian Journal of Cancer,2017,6(2):64-68
[7] Paolo Boscolo-Rizzo,Carlo Furlan,Valentina Lupato,et al.Novel insights into epigenetic drivers of oropharyngeal squamous cell carcinoma:role of HPV and lifestyle factors[J]. Clin Epigenetics,2017,9:124.
[8] JP Pignon,A le Maitre,E Maillard, et al. Meta-analysis of chemotherapy in head and neck cancer(MACH-NC):An update on 93 randomised trials and 17346 patients [J].Radiother Oncol,2009,92(1):4-14.
[9] dVJ Van,S Nuyts.Can Intensity-Modulated-Radiotherapy Reduce Toxicity in Head and Neck Squamous Cell Carcinoma[J]?Cancers,2017,9(10):135.
[10] K Uchiyama,M Yamada,S Komatsu.Determination of the Appropriate Timing of Aprepitant Administration for Nausea in Patients with Head and Neck Cancer Receiving Combination Chemotherapy with Docetaxel, Nedaplatin(Divided Doses for 5 Days),and 5-fluorouracil[J].Gan Gan to Kagaku Ryoho Cancer &Chemotherapy , 2015,42(10):1191.
[11]王枫,李荣清,艾毅钦.放疗联合奈达铂同步治疗老年人头颈鳞癌的疗效分析[J].实用临床医药杂志,2012,16(1):62-63.
[12]谢忆山,李长虎,戈伟,等。奈达铂与顺铂周方案化疗同步放疗对局部晚期头颈部鳞癌的疗效比较[J].医药导报,2012,31(12):1557-1560.
猜你喜欢
——再论奈达对翻译本质属性的认知
