益髓灸对D-半乳糖衰老小鼠脑组织SOD2、GADD45蛋白及mRNA水平的影响
2018-06-21方玉丽赵利华苏传丽陈树燕藤金龙吴健文
方玉丽,赵利华,苏传丽,陈树燕,藤金龙,吴健文
(1.广西中医药大学,南宁 530001;2.广西中医药大学第一附属医院,南宁 530023;3.佛山健翔医院,佛山528000)
脑衰老可能是阿尔茨海默病(Alzheimer’s Disease, AD)等神经退行性改变的最初级阶段。AD也称老年性痴呆,它的危害已经作为全球性的公共卫生问题被提出[1]。中晚期 AD的治疗效果不佳,因此有学者提出,早期诊断与干预,延缓脑衰老是治疗 AD的一种新型战略[2]。氧化应激是衰老的重要因素之一,其病理改变主要见于海马和大脑皮质,且随着年龄增长老龄动物海马神经元细胞凋亡,皮层神经元转录水平降低,RNA、蛋白质含量也会下降,而已有学者证实 D-半乳糖处理小鼠的脑组织形态功能与上述相符合[3]。本研究通过 D-半乳糖注射建立小鼠衰老模型,以海马和大脑皮质中 SOD2、GADD45 mRNA、蛋白表达为观察指标,从mRNA表达、蛋白质分子水平探讨艾灸疗法对脑衰老的影响机制。
1 材料与方法
1.1 实验动物分组与处理
60只健康雄性 3月龄昆明雄性小鼠,体重(30±2) g。均由广西医科大学动物中心SPF实验室提供(动物许可证号SCXK桂2003-0003)。按随机数字表顺序随机分为5个组,每组12只,即生理组、模型组、艾炷灸“足三里+悬钟”穴组(艾灸1组)、艾炷灸“百会+关元”穴组(艾灸2组)、艾炷灸非穴位组“腕上+髌上”(非穴位组)。各组小鼠饲养条件均相同,饲养于广西中医药大学实验动物中心 SPF级实验室[合格证号 SYXK(桂)2010-001],室温保持在(24±2)℃,相对湿度65%,12 h昼夜交替。自由摄食和饮用纯净水。实验过程中对动物的处置符合中华人民共和国科技部2000年颁布的《关于善待实验动物的指导性意见》。
1.2 主要药品、试剂和仪器
1.2.1 主要药品和试剂
精制艾绒(苏州东方艾绒厂出品);D-半乳糖[国药集团(上海)化学试剂有限公司,批号 20131105];0.9%氯化钠注射液(贵州天地药业有限责任公司,批号A14051104);4%多聚甲醛固定液(武汉博士德生物工程有限公司,批号AR1069);SOD2、GADD45免疫组化试剂(美国 Abcam公司);Sample Protector for RNA/DNA 9750,RNase-Free Water 9012,MiniBEST Universal RNA Extraction Kit 9767(RNA提取),PrimeScriPt RT Master Mix(Perfect Real Time)RR036A(反转录),SYBR Premix Ex TaqTM Ⅱ RR820A,引物合成加验证(TaKaRa,大连宝生物);无水乙醇(上海化学试剂一厂)。
1.2.2 主要仪器
超低温冰箱(Thermo-Fishe,美国);超声波细胞破碎仪(BILON-650Y,上海比朗仪器有限公司);立式高压灭菌锅(上海博定实业有限公司医疗仪器厂),AllegraX-22r低温高速离心机(美国贝克曼康尔特有限公司),NanoDrop 2000核酸蛋白分析仪(Thermo-Fisher,美国),9700 PCR扩增仪(APPlied Biosystem,美国),7500实时荧光定量PCR仪(APPlied Biosystem,美国),奥林巴斯生物显微摄影系统(BX60 PM20,日本),全自动轮转式组织切片机(HM355S,MICROM德国)。
1.3 造模方法
参照文献[4]用 D-半乳糖颈背部皮下注射,建立亚急性衰老小鼠模型。将 D-半乳糖试剂与生理盐水按10(g):100(mL)混匀为(100 mg/mL),水迷宫行为测试7 d后模型组、艾灸1组、艾灸2组、非穴位组连续70 d (10周)每天以D-半乳糖按1000 mg/kg/d颈背部皮下注射(相当于每10 g体重注射0.l mL浓度为10%的D-半乳糖溶液),同时生理组按每10 g体重颈背部皮下注射0.l mL剂量的生理盐水。
1.4 干预方法
造模12 d后,开始艾灸治疗,每次3壮/穴,灸单侧(或两穴),共 6壮/d。穴位定位参照文献[5-6]。每日 1次,共58次。
生理组和模型组不做任何治疗性干预,但给予与各治疗组同样时间、同等程度的捉抓、固定及放置未燃烧的艾炷等刺激。
艾灸1组取足三里、悬钟。人工固定小鼠,先将穴位处剪毛,涂少量凡士林来保护小鼠的皮肤并使艾炷固定。艾炷规格为底部直径1.5 mm,高6 mm,重约12~14 mg,要求紧而结实。艾炷燃烧时间约18~20 s/壮,至小鼠挣扎时更换。
艾灸2组取百会、关元,操作同艾灸1组。
非穴位组取腕背关节上1 mm(简称腕上)和膝髌正中上沿上2 mm(简称髌上),操作同艾灸1组。
1.5 取材
治疗结束后,将各组小鼠断头于冰上取脑,每组 6只小鼠脑组织取海马20 mg,大脑皮质30 mg分别放入EP管于液氮﹣70℃保存,然后再转移至﹣80℃超低温冰箱保存,用作RT-qPCR试验;每组另外6只小鼠断头后,完整取出一侧半脑于4%多聚甲醛固定24 h,再行常规石蜡包埋,包埋后所有组织行连续冠状切片。
1.6 检测
1.6.1 免疫组化
小鼠脑组织SOD2、GADD45蛋白表达检测均采用免疫组织化学二步法染色;石蜡切片进行脱蜡和水化后,采用PBS液洗5 min×3次。采用柠檬酸液高压修复(喷气)2 min。每张切片加3% H2O2溶液,室温孵育10 min,PBS液洗5 min×3次后甩干,滴加一抗抗GADD45抗体、抗MnSOD2抗体(1:100浓度稀释),移至4℃冰箱孵育过夜。次日 PBS冲洗,滴加二抗,37℃孵育 1 h,PBS洗5 min×3次。甩去 PBS液,每张切片加 50 μL鼠PV-6001/2增强型(Polink-1)检测试剂盒,室温孵育30 min,PBS液洗5 min×3次,甩干后DAB显色10 min。采用SP法,DAB显色,阴性对照一抗以0.01 MPS液替代。在40倍物镜下随机选取皮质和海马区域不相重叠连续的 5个视野采集图片,采用IPP软件(Image-Pro Plus 6.0)对神经元细胞染色结果进行分析。分析方法为首先将 IPP程序系统进行光密度校正,把图片中神经元细胞免疫组化反应物的黄色区域定为测量区域(area of interest,AOI)进行光密度测定,测量累积光密度(integrate doptical density,IOD)和面积(area),按下列公式计算平均光密度(average optical density):AOD=IOD/area。
1.6.2 RT-qPCR
从﹣80℃超低温冰箱取出海马组织及大脑皮质,加入裂解液后用一次性研磨杵进行研磨裂解,后离心。海马、大脑皮质总RNA提取严格按TaKaRa试剂盒说明进行,并对提取的总 RNA经核酸测定仪进行浓度及纯度的测定。根据总RNA的浓度(按照20 μL体系进行逆转录反应)在 37℃下逆转录15 min,然后置于85℃5 s中停止逆转录,放置4℃ 15 min稳定cDNA,再以此cDNA为模板进行PCR扩增。SOD2、GADD45特异性引物由宝生物工程(大连)有限公司设计合成,引物序列为SOD2(上游,TCCCAGACCTGCCTTACGA;下游,TCGGTGGCGT-TGAGATTG,扩增片段长度 115bP);GADD45(上游,CCTG-CACTGTGTGCTGGTGA;下游,CCACTGATCCATGTAGCGACTTTC,扩增片段长度 106bP);GAPDH(上游,TGTGTCCGTCGTGGATCTGA;下游,TTGCTGTTGAAGTCGCAGGAG,扩增片段长度150 bP),均购买宝生物工程(大连)有限公司成品。反应条件为先95℃预变性30 s,后95℃ 5 s,60℃30 s,共40个循环进行PCR反应。SOD2、GADD45结果以 2﹣ΔΔCt法表示。
1.7 统计学方法
采用SPSS19.0软件包进行统计学分析。计量资料符合正态分布,用均数±标准差表示,采用单因素方差分析,符合方差齐性,均数间两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结果
2.1 益髓灸对小鼠海马、大脑皮质 SOD2和 GADD45蛋白水平的影响
由图1和图2可见,各组小鼠海马区、大脑皮质均可见棕黄色阳性表达。生理组海马和皮质阳性表达细胞增加、染色深。模型组海马和皮质阳性表达细胞减少、染色浅。艾灸1组海马和皮质阳性表达细胞增加、染色深。艾灸2组海马和皮质阳性表达细胞增加、染色深。非穴位组海马和皮质阳性表达细胞减少、染色浅。由表1可见,模型组海马区SOD2、GADD45蛋白水平较生理组明显降低,差异有统计学意义(P<0.05);艾灸1组和艾灸2组海马区SOD2、GADD45蛋白水平较生理组降低,较模型组升高,差异有统计学意义(P<0.05);艾灸1组与艾灸2组海马区SOD2、GADD45蛋白水平比较差异无统计学意义(P>0.05);非穴位组海马区SOD2、GADD45蛋白水平与生理组、艾灸1组和艾灸2组比较,差异有统计学意义(P<0.05,P<0.01)。模型组大脑皮质SOD2、GADD45蛋白水平较生理组明显降低,差异有统计学意义(P<0.05);艾灸 1组、艾灸 2组大脑皮质SOD2蛋白水平较生理组降低,差异有统计学意义(P<0.05),而GADD45蛋白水平稍低于生理组,但差异无统计学意义(P>0.05);艾灸1组和艾灸2组大脑皮质SOD2、GADD45蛋白水平较模型组升高,差异有统计学意义(P<0.05);艾灸1组大脑皮质SOD2水平低于艾灸 2组,差异有统计学意义(P<0.05),而两组GADD45蛋白水平比较差异无统计学意义(P>0.05);非穴位组与生理组、艾灸1组和艾灸2组比较,差异有统计学意义(P<0.05,P<0.01)。
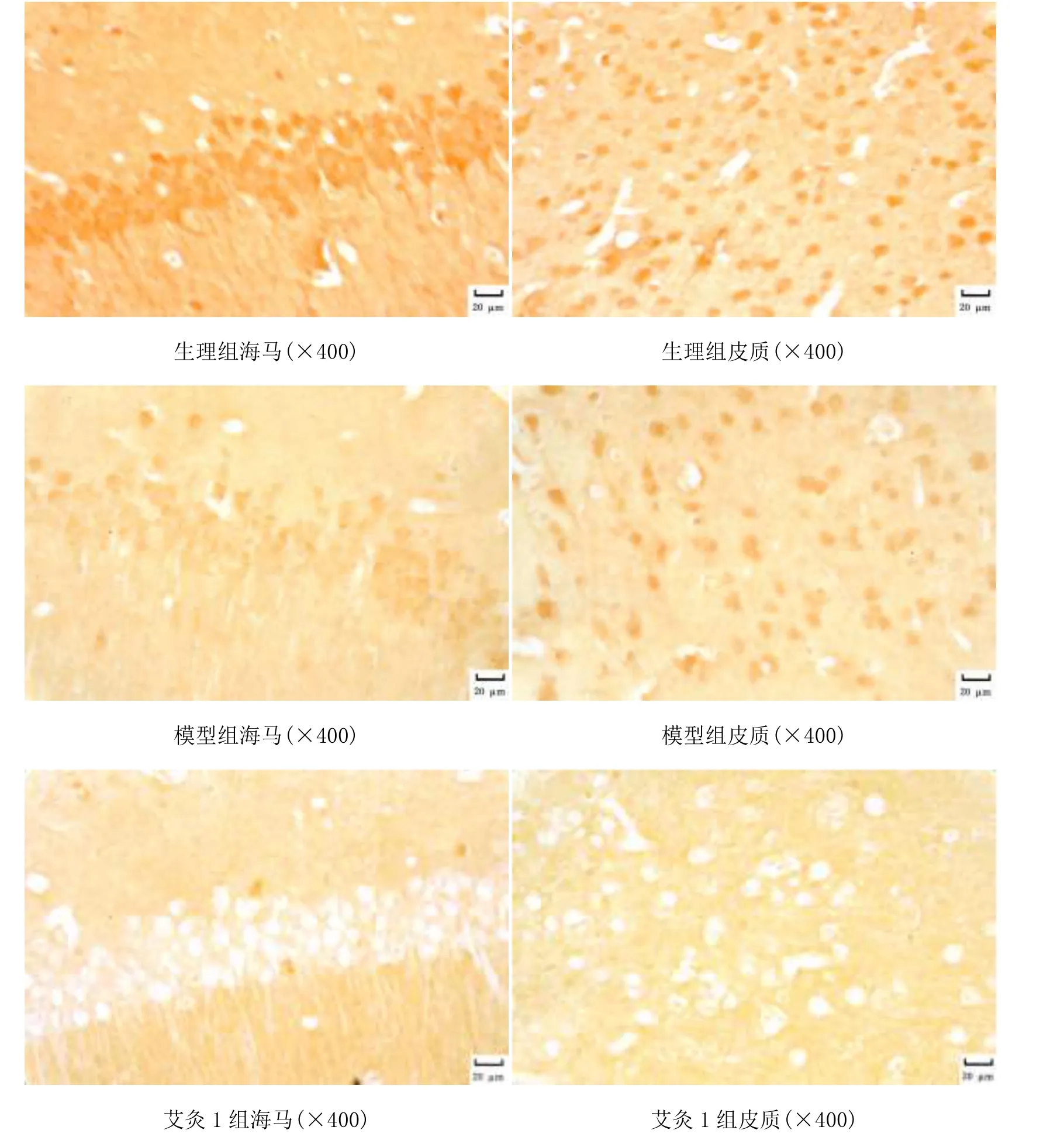
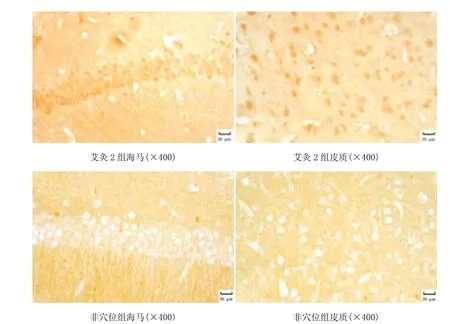
图1 光镜下各组大脑皮质、海马区SOD2蛋白的表达

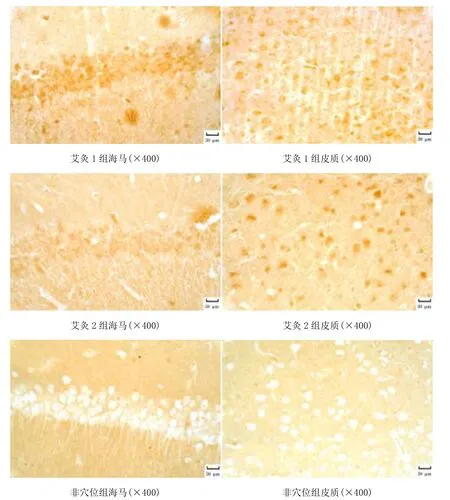
图2 光镜下各组大脑皮质、海马区GADD45蛋白的表达

表1 益髓灸对小鼠脑组织SOD2、GADD45蛋白水平的影响 (x±s)
2.2 益髓灸对小鼠海马及大脑皮质 SOD2、GADD45 mRNA水平的影响
由表2可见,模型组海马区SOD2、GADD45 mRNA水平较生理组明显降低,差异有统计学意义(P<0.05);艾灸1组和艾灸2组海马区SOD2、GADD45水平较生理组低,较模型组升高,差异有统计学意义(P<0.05);艾灸1组与艾灸2组海马区SOD2、GADD45水平比较差异无统计学意义(P>0.05);非穴位组海马SOD2、GADD45水平较生理组降低,差异有统计学意义(P<0.05);非穴位组海马区SOD2水平较艾灸2组及非穴位组海马区GADD45水平较艾灸1组与艾灸2组明显降低,差异有统计学意义(P<0.01)。模型组大脑皮质SOD2、GADD45 mRNA水平较生理组降低,差异有统计学意义(P<0.05);艾灸 1组、艾灸 2组大脑皮质SOD2 mRNA水平较生理组低下,且差异有统计学意义(P<0.05),而艾灸1组、艾灸2组大脑皮质GADD45 mRNA水平与生理组比较差异无统计学意义(P>0.05);艾灸1组、艾灸2组大脑皮质SOD2、GADD45水平较模型组升高,差异有统计学意义(P<0.05);艾灸1组与艾灸2组大脑皮质SOD2、GADD45水平组比,差异无统计学意义(P>0.05);非穴位组大脑皮质SOD2、GADD45水平较生理组降低,差异有统计学意义(P<0.05);非穴位组大脑皮质 SOD2水平较艾灸 1组及非穴位组大脑皮质GADD45水平较艾灸1组与艾灸2组明显降低,差异有统计学意义(P<0.01)。
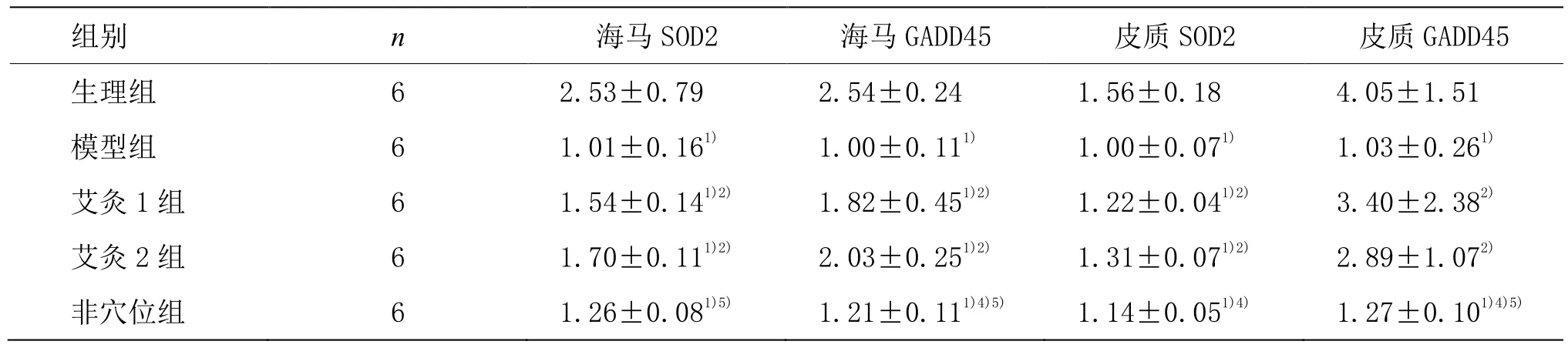
表2 益髓灸对小鼠海马及大脑皮质SOD2、GADD45 mRNA水平的影响 (x±s)
3 讨论
目前认为 D-半乳糖诱导的模型动物寿命缩短是由氧化应激所致,引起线粒体、神经损伤,进一步表现为认知功能下降[7]。SOD2,即锰超氧化歧化酶,主要分布在线粒体,是细胞内重要的抗氧化蛋白,能够减少超氧阴离子等超氧化物,是细胞对抗氧化应激的主要作用机制。SOD2能够通过减少超氧化物的生成,减轻脑组织损伤,同时通过抑制线粒体内部细胞色素 C向胞浆转移,从而抑制线粒体依赖性细胞死亡信号通路的激活[8-9]。研究发现,在大肠杆菌内重组得到SOD2通过介导进入细胞,能够清除细胞内外自由基,从而降低氧化引起的损伤[10-12]。GADD45家族(GADD45a、GADD45b、GADD45γ)具有监测细胞周期、抑制细胞凋亡等DNA损伤修复的功能[13]。相关研究发现抗氧化过程是通过 GADD45等级联的相互作用而实现的,细胞周期G0/G1期阻滞通过应力传感器激活GADD45基因蛋白,进行 DNA损伤监测及修复[14-15]。且当 GADD45b缺乏时,G2/2M细胞周期阻滞,会导致氧化应激诱导的 DNA损伤的增高。张松等[16]发现脑缺血再灌注损伤经DHCA术后,能够上调海马区 GADD45b,降低脑组织耗氧量,起到保护神经元的作用。同时GADD45蛋白可能提供潜在的治疗老年相关疾病的靶点和促进长寿。FOXO基因是一种长寿基因,FOXO4和FOXO3a转录因子是GADD45基因的启动子,通过上调GADD45对氧化应激引起的损伤而促进DNA修复,从而影响机体的寿命[17]。
衰老病位在脑,中医学认为:“脑为髓海”(《灵枢·海论》),“肾不生则髓不能满”(《素问·逆调论》),“灵机记性在脑,因饮食生气血,……化而为髓,由脊骨上行入脑,又名脑髓”(《医林改错》),脾胃为气血生化之源,髓海有赖脾胃气血滋养,所以提出“脾肾主脑髓”说[18]。元气不足,气化失常,还造成血瘀、痰浊等,故脑衰老主要病机变化是脾肾亏虚夹瘀[19]。艾灸具有温补元气、培肾固本的功效,且临床操作方便简易,无不良反应,在脑衰老的预防及治疗方面均有独特优势[20-23]。国内外相关研究及本课题组前期研究证明,D-半乳糖致衰老小鼠在形态及生理、生化的许多观测指标的改变与18月龄自然衰老小鼠相似[24-29]。艾炷灸能够提高 D-半乳糖致衰老小鼠大脑皮质及海马区神经元的密度,减少神经元细胞的变性、坏死,减轻D-半乳糖造成的氧化损伤,降低脑组织NO含量和NOS活力,保护神经元结构,延缓脑衰老[30-31]。
有学者证实D-半乳糖致衰老小鼠海马、皮层区神经元细胞中相关RNA、蛋白水平会下降[3]。足三里为胃经的合穴,胃为后天之本,为气血化生之源,其经多气多血,故足三里具有健脾益胃、强壮机体的作用;悬钟乃髓会,胆经之穴,主骨所生病,有生髓之功。两穴合用具有健脾益气、补益髓海之功,二穴亦为《针灸大成》中治疗中风、偏枯等脑病的常用穴。关元穴为足三阴与任脉的交会,元阴元阳交会之所系,为一身元气之所在,具有培补肾元、补益精血的功能,百会属督脉,且位于巅顶正中,为髓海之气转输之处,有疏通脑络、填髓充脑之功效,是治疗脑病的主穴。二穴施灸具有补肾培元、填精充髓之功效。故本实验在前期研究基础上,从“补肾益髓”和“健脾益髓”角度出发以D-半乳糖衰老小鼠作为模型,通过对海马和大脑皮质中SOD2、GADD45两种mRNA、蛋白监测,从不同角度来评估艾灸对脑衰老的影响。我们的研究结果显示,与生理组比较,模型组小鼠海马和皮质中 SOD2、GADD45的mRNA和蛋白水平显著降低(P<0.05)。与模型组比较,艾灸 1组和艾灸 2组海马、皮质 SOD2、GADD45的mRNA和蛋白水平明显升高(P<0.05)。与非穴位组比较,艾灸1组和艾灸2组海马区SOD2、GADD45的mRNA和蛋白水平明显升高(P<0.01)。本实验证实了 D-半乳糖致衰小鼠海马及大脑皮质SOD2、GADD45的mRNA和蛋白水平降低,通过艾炷灸的干预治疗可以提高 D-半乳糖衰老小鼠模型大脑皮质和海马区SOD2、GADD45的mRNA和蛋白水平。非穴位艾炷灸在一定程度上提高了衰老小鼠脑组织中的抗衰老 mRNA、蛋白,但效果远不及艾灸1组、艾灸2组,原因可能是由于艾炷燃烧时产生物理、化学因子通过表皮神经系统的传导对机体产生的一些生物物理效应[32-34]。综上所述,艾炷灸足三里、悬钟穴及百会、关元穴能够提高脑组织中SOD2、GADD45的mRNA及蛋白的表达,提高脑组织的抗氧化作用,这可能是延缓衰老的机制之一;研究结果显示“补肾益髓”灸与“健脾益髓”灸两种疗法比较无显著性差异,在临床上可轮替或联合应用,对防治老年脑病具有一定的积极作用。
[1] 余抒,府伟灵.阿尔茨海默病及诊断学研究进展[J].临床检验杂志,2016,34(1):49-51.
[2] Chen Z, Yu J, Song Y,et al. Aging Beijing:challenges and strategies of health care for the elderly[J].Ageing Res Rev, 2010,9(Suppl 1):S2-S5.
[3] 王珊,李宁,于力方,等.D-半乳糖脑老化模型小鼠海马神经细胞凋亡的研究[J].标记免疫分析与临床,2004,11(1):47-48.
[4] 徐淑云,卞如廉,陈修.药理实验方法学[M].第3版,北京:人民卫生出版社,2001:1465.
[5] 林文注,王佩.实验针灸学[M].上海:上海科学技术出版社,1999:87.
[6] 胡元亮.实用动物针灸手册[M].北京:中国农业出版社,2003:37.
[7] 许扬,吴涛,顾佳黎,等.D-半乳糖诱导衰老动物模型研究进展[J].中国老年学杂志,2009,29(13):1710-1713.
[8] Fukui M, Zhu BT. Mitochondrial Superoxide Dismutase SOD2, but not Cytosolic SOD1, Plays a Critical Role in Protection against Glutamate-Induced Oxidative Stress and Cell Death in HT22 Neuronal Cells[J].Free Radic Biol Med, 2010,48(6):821-830.
[9] Fujimura M, Morita-Fujimura Y, Kawase M,et al.Manganese superoxide dismutase mediates the early release of mitochondrial cytochrome C and subsequent DNA fragmentation after permanent focal cerebral ischemia in mice[J].J Neurosci, 1999,19(9):3414-3422.
[10] Borrelli A, Schiattarella A, Mancini R,et al. A recombinant MnSOD is radioprotective for normal cells and radiosensitizing for tumor cells[J].Free Radic Biol Med, 2009,46(1):110-116.
[11] Rahman NA, Mori K, Mizukami M,et al. Role of peroxynitrite and recombinant human manganese superoxide dismutase in reducing ischemia-reperfusion renal tissue injury[J].Transplant Proc, 2009,41(9):3603-3610.
[12] Borrelli A, Schiattarella A, Mancini R,et al. The leader peptide of a human rec. MnSOD as molecular carrier which delivers high amounts of Cisplatin into tumor cells inducing a fast apoptosis in vitro[J].Int J Cancer,2011,128(2):453-459.
[13] Hsu YC, Huang TY, Chen MJ. Therapeutic ROS targeting of GADD45γ in the induction of G2/M arrest in primary human colorectal cancer cell lines by cucurbitacin E[J].Cell Death Dis, 2014,5:e1198.
[14] Smn Mydin RB, Sreekantan S, Hazan R,et al. Cellular homeostasis and antioxidant response in epithelial HT29 cells on titania nanotube arrays surface[J].Oxid Med Cell Longev, 2017,2017:3708048.
[15] Magimaidas A, Madireddi P, Maifrede S,et al. Gadd45b deficiency promotes premature senescence and skin ag-ing[J].Oncotarget, 2016,7(19):26935-26948.
[16] 张松,金振晓,赵堃,等.深低温停循环手术早期核因子κB磷酸化增强并上调生长阻滞和 DNA损伤基因45β(GADD45β)表达[J].细胞与分子免疫学杂志,2016,32(9):1223-1226,1230.
[17] Moskalev AA, Smit-McBride Z, Shaposhnikov MV,et al. Gadd45 proteins: relevance to aging, longevity and age-related pathologies[J].Ageing Res Rev, 2012,11(1):51-66.
[18] 赵利华,陈尚杰,张家维.张家维教授治疗脑系三症经验介绍[J].新中医,2009,41(4):9-11.
[19] 刘明芳,李浩,刘剑刚,等.中医虚瘀浊毒与老年性痴呆[J].中医杂志,2010,51(7):651-654.
[20] 谭杏,杨茜芸,林亚平.艾灸“足三里”穴对衰老大鼠心、脑组织中SOD、MDA、LF的影响[J].湖南中医药大学学报,2013,33(11):86-89.
[21] 梁欣,钟愉.艾灸对亚急性衰老大鼠松果体细胞数及热休克蛋白 70表达的影响[J].针刺研究,2011,36(4):258-261,267.
[22] 赵果毅,梁瑞,葛晓静,等.艾灸对衰老模型大鼠海马神经元凋亡蛋白Bcl-2及Bax的影响[J].中西医结合心脑血管病杂志,2010,8(5):587-588.
[23] 李丽红,李丽,赵志恩,等.艾灸、中药对衰老模型大鼠线粒体DNA、血清IL-2、IL-6含量的影响[J].中国针灸,2008,28(9):681-684.
[24] 侯莉娟,刘晓莉,乔德才.大鼠游泳运动疲劳模型建立的研究[J].实验动物科学与管理,2005,22(1):1-3.
[25] 赵利华,文建军,杨柯,等.艾灸对 D-半乳糖致小鼠衰老模型抗衰老作用的研究[J].针刺研究,2008,33(4):255-257,261.
[26] Chen P, Chen F, Zhou B. Antioxidative, anti-inflammatory and anti-apoptotic effects of ellagic acid in liver and brain of rats treated by D-galactose[J].Sci Rep, 2018,8(1):1465.
[27] Heidari S, Mehri S, Hosseinzadeh H. Memory enhancement and protective effects of crocin against D-galactose aging model in the hippocampus of Wistar rats[J].Iran J Basic Med Sci, 2017,20(11):1250-1259.
[28] Kenawy S, Hegazy R, Hassan A,et al. Involvement of insulin resistance in D-galactose-induced agerelated dementia in rats: Protective role of metformin and saxagliptin[J].PLoS One, 2017,12 (8):e0183565.
[29] Aydin F, Kalaz EB, Kucukgergin C,et al. Carnosine Treatment Diminished Oxidative Stress and Glycation Products in Serum and Tissues of D-Galactose-Treated Rats[J].Curr Aging Sci, 2017. doi: 10.2174/1871530-317666170703123519
[30] 赵利华,韦良玉,王进声,等.艾炷灸对 D-半乳糖衰老小鼠大脑组织形态和超微结构的影响[J].时珍国医国药,2010,21(6):1337-1339.
[31] 赵利华,韦良玉,陈煌,等.艾灸对 D-半乳糖衰老小鼠学习记忆、大脑组织 NOS/NO-cGMP信号系统及 cfosmRNA的影响[J].上海针灸杂志,2012,31(3):194-197.
[32] 杨华元,胡追成.艾灸的生物物理特性[J].中国针灸,2009,29(11):897-899.
[33] 李莹,孙超,邝九杰,等.艾灸过程生物组织的传热特性实验研究[J].工程热物理学报,2018,39(1):150-154.
[34] 刘密,彭艳,常小荣,等.艾灸温热效应的生物物理学特性研究进展[J].湖南中医药大学学报,2010,30(1):76-78.