塞拉利昂西区拉沙热血清流行病学调查
2018-06-21,,,,,,
, ,,,,,
拉沙热是由沙粒病毒科沙粒病毒属中的拉沙病毒所引起的一种病毒性出血热。该病毒为有包膜、分节段的负链RNA病毒,首次分离于1969年尼日利亚境内东北部两名因病死亡的传教士体内[1]。拉沙热为人兽共患病,其主要的自然宿主为多乳头小鼠(Mastomys natalensis),其次还有黑家鼠等。人类可通过接触被感染鼠类的尿液和粪便以及被污染的食物和水而感染,也可通过与病患的体液等接触造成人与人之间的传播。大约80%的感染者无症状或症状很轻,仅有发热、头痛、咽痛、肌肉关节疼痛等非典型性症状。而20%的感染者症状较为严重,可出现面部肿胀、胸腔积液、皮肤黏膜及消化道出血,甚至休克、昏迷、多器官衰竭直至死亡[2]。患病6 d内及时使用利巴韦林治疗能够大大降低病死率[3]。
拉沙热主要流行于西非,每年大约有30万至50万病例,当地医院内发热病人中的10%~15%是由拉沙热引起的,平均病死率约为15%~20%,在暴发流行期病死率可高达50%以上[4]。传统观念认为拉沙热主要集中在尼日利亚、塞拉利昂、利比里亚和几内亚4个国家,但近些年来随着时间的变化,疾病的流行区域逐渐扩大,加纳、科特迪瓦和马里等国相继有拉沙热病例的报道,但该病目前主要还是集中在西非地区[5-7]。自2015年3月中塞友好生物安全三级实验室在塞拉利昂首都弗里敦正式启用以来,已承担并完成了多项任务,包括埃博拉应急检测,埃博拉幸存者项目,塞国后备人才培训带教,疟疾、拉沙热等热带疾病的监测等等。其中,拉沙热血清学调查也是比较重要的一项工作。有文献报道,在上个世纪70年代初期,塞拉利昂的东部省拥有全球最高的拉沙热发病率[8],而西部地区是塞拉利昂相对发达的地区,截止到2016年,塞拉利昂全国总人口数约为740万,将近1/5的人口集中在西区。西区分为城市和郊区,城市地区即为塞国首都弗里敦,人口约为130万,郊区人口约为30万。本研究以中塞友好生物安全实验室为依托,收集并检测了大量塞国西区人群血清样本中的拉沙病毒特异性IgG抗体,了解了拉沙热在塞国西区人群中的流行和分布特征。
1 材料与方法
1.1材料 拉沙热病毒核蛋白基因由北京擎科新业生物技术有限公司合成;感受态购自北京全式金生物技术有限公司;辣根过氧化物酶标记的羊抗人IgG抗体购自于美国sigma公司;96孔板、封闭液、样本稀释液、酶标抗体稀释液、显色液和终止液均购自北京万泰生物药业股份有限公司。820份血清样本来自塞国西区城市和郊区,90份正常人血清由本科室提供和保存。
1.2调查对象及研究方法 用现况调查随机抽样的样本量计算方法,n=Zα2×pq/d2,参照既往资料,总体流行率P取0.2,抽样误差取0.15,按照调查对象不配合或采样不合格率为15%估算,抽样数共约800人。
采集调查对象的血液样本,当天冷藏运输至中塞友好生物安全实验室并进行血清分离,保存于-80 ℃冰箱待测。在排除埃博拉病毒和疟原虫感染之后,进行拉沙热IgG抗体检测。
1.3拉沙热IgG抗体检测试剂盒的制备和检测 利用大肠杆菌表达系统表达带组氨酸标签的拉沙热核蛋白抗原,经金属离子亲和层析纯化后包被96孔ELISA板并封闭。将血清样本以1∶100稀释后按照每孔100 μL加入ELISA板中,37 ℃反应1 h。PBST洗板后加入1:2000稀释的酶标羊抗人IgG抗体,37 ℃反应1 h;PBST洗板后加入显色液,反应5 min后加入终止液,用酶标仪测定反应板中每孔液体450 nm处的吸光度值(A450)。将阴性对照的平均值加3倍标准差定义为cutoff值,OD值大于cutoff值判定为阳性。
1.4数据录入和统计学分析 将样本信息和检测结果录入微软Office Access建立数据库,用统计分析系统(Statictical Analysis System, SAS)进行统计学分析。拉沙热特异性IgG抗体阳性率的比较采用卡方检验。
2 结 果
2.1一般情况 我们总共检测了820份血清样本。性别信息有效的样本数共为785份,其中男性有498份,女性有287份,分别占总数的63.44%和36.56%。地区信息有效的例数共有732份,其中郊区184份,城市548份,分别占总数的25.14%和74.86%。年龄信息有效的例数共有808份,其中小于14岁年龄组的有119人,占14.72%,14至40岁之间年龄组的有468人,占57.92%,大于40年龄组的有221人,占27.35%。
2.2拉沙热感染率及其分布特征 在检测的所有820份样本中,拉沙热IgG抗体阳性的共有236份,阴性样本584份,阳性率28.78%。用二项分布的正态近似法估计总体率,得到95%可信区间为25.68%~31.88%。其中,男性阳性率为28.92%,女性阳性率为31.01%,但其差异并没有统计学意义(χ2=0.38,P>0.05)。小于14岁组,14至40岁组和大于40岁组的阳性率分别为21.85%,30.56%和28.96%,使用R×C列联表的检验,其总体差异并无统计学意义(χ2=3.50,P>0.05)。而对于地区的分布,城市地区阳性率为24.82%,郊区的阳性率达到43.48%,可见郊区拉沙热感染率明显高于城市,且其差异有统计学意义(χ2=23.06,P<0.05)(表1)。
3 讨 论
有文献报道,在拉沙热流行区域,血清抗体阳性率一般在1.8%~55%之间[9],而在塞拉利昂尤其是塞国东部省,拥有全球最高的拉沙热发病率。截至2012年,塞国13个行政区域中有10个有拉沙热病例报道,这些行政区域主要集中在东部和南部地区,但西部城市地区,即首都弗里敦也有阳性病例报道[10]。一般而言,由于塞国西区属于首都及其周边区域,其经济条件相对而言较为发达,但根据我们的结果,在塞国西区人群中的总体血清阳性率也可达到28.78%,这说明当地的卫生条件和疾病防控水平都处于较低的水平。
表1 不同性别、地区和年龄组人群的拉沙热IgG阳性率比较
Tab.1 Comparison of the anti-LASV IgG positivity in different gender, district and age groups
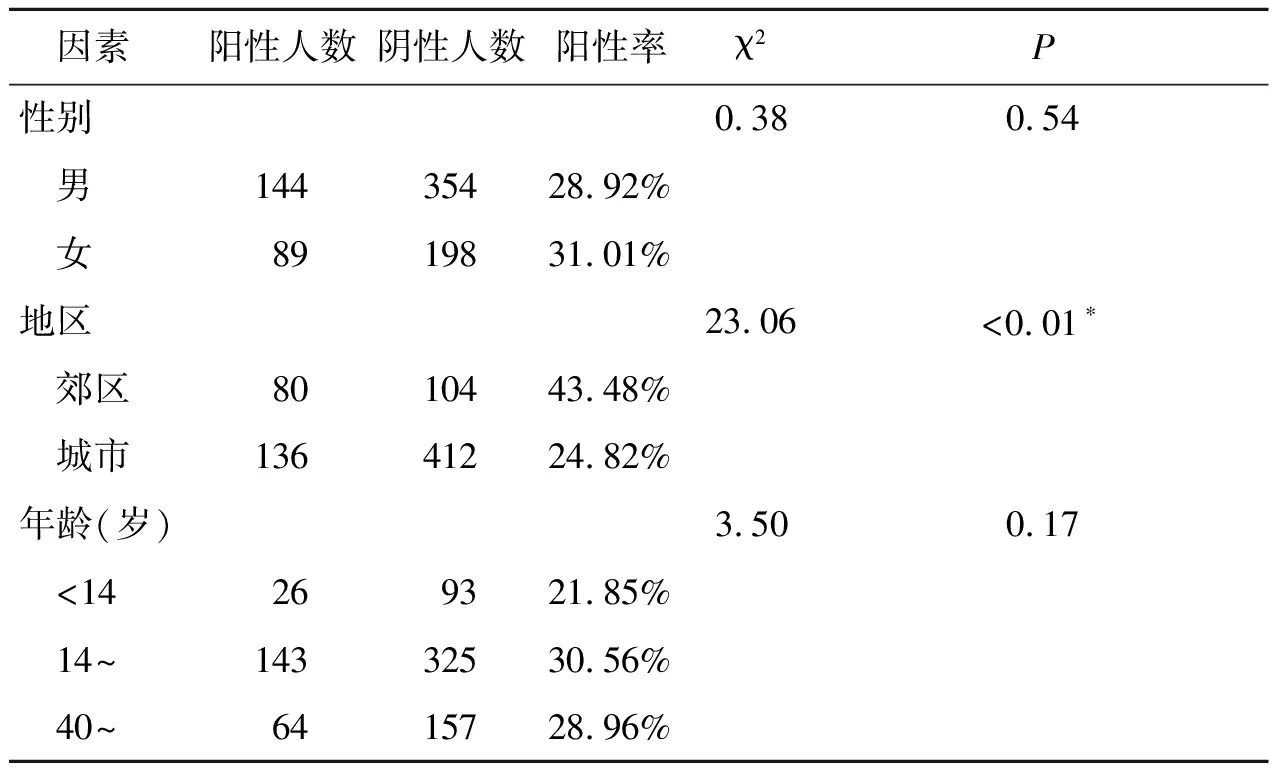
因素阳性人数阴性人数阳性率χ2P性别0.380.54 男14435428.92% 女8919831.01%地区23.06<0.01∗ 郊区8010443.48% 城市13641224.82%年龄(岁)3.500.17 <14269321.85% 14~14332530.56% 40~6415728.96%
*P<0.05,差异有统计学意义
从拉沙热在塞拉利昂西区人群中的流行和分布特征来看,其感染率在性别和年龄组的分布上无明显统计学差异差异,各类人群均是拉沙热的易感人群。而郊区的感染率明显高于城市,这与郊区的经济和公共卫生条件相对更差有关。城市中目前有自来水供应,垃圾收集,并已普遍实现了路面硬化,这些措施的实施和卫生状况的改善有助于减少人群暴露。而郊区的卫生环境普遍更差,杂草丛生、污水横流。人们为了摄取必要的蛋白质等能量,不得不捕食野生动物,这其中就包括拉沙热的宿主多乳头小鼠,从而大大增加了人群的暴露风险[11]。
目前针对拉沙热尚无有效的药物和疫苗,利巴韦林治疗虽有效果,但有效给药期短,费用昂贵。从预防着手,改善经济卫生条件,提高公共卫生防控能力是关键。要加强对人群的宣传和教育,告知人们疾病与宿主之间的关系,做好防鼠灭鼠工作,尽量减少人群对鼠的暴露,从根本上切断传染源。
拉沙热的流行区域目前尚主要集中在西非地区,但随着社会经济和交通运输业的发展,不排除该病在其他国家和地区暴发流行的可能性,2014年的埃博拉疫情和2016年的寨卡疫情就充分说明了这一点。尤其自中国提出“一带一路”的方针政策以来,我们与非洲大陆的联系愈加紧密,这同时也加大了拉沙热传入我国的风险。防控传染病最好的方式是控制源头,在塞拉利昂建立生物安全实验室就是将传染病防控阵线前移的重要手段。我们借助这一手段,对塞国西区拉沙热的血清流行病学情况做了调查,初步确定了特异性IgG抗体阳性率和其在不同性别、年龄、地区之间的差异,为拉沙热的源头防控以及进一步的采取相应的具体防控策略奠定了理论基础。
[1] Frame JD, Baldwin JMJ, Gocke DJ, et al. Lassa fever, a new virus disease of man from West Africa. I. Clinical description and pathological findings[J]. Am J Trop Med Hyg, 1970, 19(4): 670-676. DOI: 10.4269/ajtmh.1970.19.670
[2] Mccormick JB, Fisher-Hoch SP. Lassa Fever[M]. Curr Top Microbiol Immunol, 2002, 262(1): 75-109. DOI: 10.1007/978-3-642-56029-3_4
[3] Dahmane A, Griensven JV, Herp MV, et al. Constraints in the diagnosis and treatment of Lassa Fever and the effect on mortality in hospitalized children and women with obstetric conditions in a rural district hospital in Sierra Leone[J]. Trans R Soc Trop Med Hyg, 2014, 108(3): 126-132. DOI: 10.1093/trstmh/tru009
[4] Mccormick JB. Epidemiology and control of Lassa fever[J]. Curr Top Microbiol Immunol, 1987, 134(134): 69-76. DOI: 10.1007/978-3-642-71726-0_3
[5] Sogoba N, Rosenke K, Adjemian J, et al. Lassa Virus Seroprevalence in Sibirilia Commune, Bougouni District, Southern Mali[J]. Emerg Infect Dis, 2016, 22(4):657-663. DOI: 10.3201/eid2204.151814
[6] Dzotsi EK, Ohene SA, Asiedubekoe F, et al. The first cases of Lassa fever in Ghana[J]. Ghana Med J, 2012, 46(3): 166-170.
[7] Kouadio L, Nowak K, Akoua-Koffi C, et al. Lassa virus in multimammate rats, Cte d’Ivoire, 2013[J]. Emerg Infect Dis, 2015, 21(8): 1481-1483. DOI: 10.3201/eid2108.150312
[8] Fraser DW, Campbell CC, Monath TP, et al. Lassa fever in the Eastern Province of Sierra Leone, 1970-1972. I. Epidemiologic studies[J]. Am J Trop Med Hyg, 1974, 23(6): 1131-1139. DOI: 10.4269/ajtmh.1974.23.1131
[9] Yun NE, Walker DH. Pathogenesis of Lassa Fever[J]. Viruses, 2012, 4(10): 2031-2048. DOI: 10.3390/v4102031
[10] Shaffer JG, Grant DS, Schieffelin JS, et al. Lassa Fever in Post-Conflict Sierra Leone[J]. PLoS Negl Trop Dis, 2014, 8(3): e2748-60. DOI: 10.1371/journal.pntd.0002748
[11] Bonwitt J, Kandeh M, Dawson M, et al. Participation of women and children in hunting activities in Sierra Leone and implications for control of zoonotic infections[J]. PLoS Negl Trop Dis, 2017, 11(7): e0005699-719. DOI: 10.1371/journal.pntd.0005699
