致病性小肠结肠炎耶尔森菌外膜蛋白A对SD大鼠免疫保护作用研究
2018-06-21,,,,,,,
, ,, , ,,,
小肠结肠炎耶尔森菌(Yersiniaenterocolitica)是一种人兽共患病原菌,感染这种病原体可引起广泛的临床表现,如急性肠炎、小肠结肠炎、末端回肠炎和肠系膜淋巴结炎,严重者还可引发一系列后遗症如肝脾脓肿、关节炎、结节性红斑、耶尔森肝炎和败血症等疾病[1]。OmpA是镶嵌在革兰阴性菌外膜上的一种产量丰富的β-桶装蛋白,该蛋白不仅参与生物膜的形成,还可作为噬菌体和细菌素的受体,对于细菌具有重要的生理学功能[2-3]。近年来,越来越多的研究表明OmpA在鼠疫耶尔森菌、沙门菌属、溶血性曼氏杆菌和鲍曼不动杆菌中都具有良好的免疫原性[4-7],提示OmpA有可能成为研制这些病原菌疫苗的候选蛋白。本课题组前期研究工作中已发现ompA核酸序列在三种致病性耶尔森菌中高度保守,并且在25 ℃和37 ℃下均是主要的免疫原性蛋白之一,体外免疫杂交实验证明该蛋白具有明显的交叉免疫原性,具备作为致病性耶尔森菌的交叉免疫保护性抗原的潜力[8-10]。本研究使用纯化的OmpA蛋白作为免疫原对大鼠进行免疫,通过体内实验对OmpA的免疫保护作用进行分析。
1 材料与方法
1.1实验菌株和实验动物 小肠结肠炎耶尔森菌Ye92010(1b/O∶8)和Ye92010-ompA重组克隆子均来自本实验室。SD雄性大鼠14只,SPF级,体重280~320 g,购自北京大学医学部实验动物科学部。
1.2主要实验试剂 His蛋白纯化试剂盒购于Novagen公司, BCA蛋白定量试剂盒购自北京康为世纪生物科技有限公司,IPTG购于Amresco公司,弗氏不完全佐剂购于Sigma公司,细菌基因组提取试剂盒购于Qiagen公司,PBS(pH=7.4)购于Gibco公司,改良増菌液(Peptone Sorbitol Bile Broth)购于Fluka公司,O:8血清型分型血清购自日本生研株式会社,PCR扩增相关试剂购于TaKaRa公司,引物合成由上海生工生物工程有限公司完成。
1.3Ye92010-ompA的表达与纯化[10]将重组克隆子Ye92010-ompA接种于具kan抗性的LB液体培养基中,置于37 ℃摇床培养至OD600约为0.6~0.8时加入终浓度1 mmol/L的IPTG,28 ℃培养诱导8 h。使用PBS(pH=7.4)将菌体清洗3次后重悬于binding buffer中,超声裂解,5 500 r/min 离心10 min收集沉淀。将沉淀溶于含6 mol/L尿素的binding buffer中,冰浴1 h,再转入His层析柱对蛋白进行纯化。纯化后的蛋白通过SDS-PAGE电泳和考马斯亮蓝染色进行验证,使用BCA蛋白定量试剂盒通过Bradford法对纯化后蛋白进行浓度测定。
1.4OmpA免疫保护试验 实验动物分组情况见表1,SD大鼠被随机分为OmpA免疫组(6只)、对照组(6只)和空白对照组(2只)。免疫组使用OmpA纯化蛋白与弗氏不完全佐剂混合后(1.5∶1)通过腹股沟注射方式对大鼠进行免疫,对照组由等体积的PBS代替蛋白。首次免疫(0.58 mg/只)后14 d对大鼠进行加强免疫(1 mg/只)。攻毒试验使用致病性小肠结肠炎耶尔森菌Ye92010(低剂量组:106CFU、高剂量组:108CFU)通过腹腔注射方式进行。攻毒后开始为期3周的连续观察,每日测量大鼠肛温并采集粪便。
表1 OmpA免疫保护试验动物分组
Tab.1 Animal grouping of OmpA immunoprotection test

动物分组和攻毒剂量OmpA免疫组对照组空白对照组低剂量攻毒高剂量攻毒低剂量攻毒高剂量攻毒未做任何处理数量/只33332
1.5粪便排菌实验及PCR检测 将大鼠粪便称重后按1∶2的比例接种于改良增菌液中,置于4 ℃培养7 d后对小肠结肠炎耶尔森菌进行分离鉴定[11]。分别使用O∶8血清型诊断血清和PCR扩增foxA、ail基因的方法对细菌进行鉴定,引物序列及退火温度参考文献[12]。
1.6攻毒后大鼠肝、脾、肠病理切片制作与组织病理变化观察 攻毒后21d将全部实验大鼠的肝、脾、回肠末端组织完整取下,观察其大体形态。之后,使用4%多聚甲醛固定48 h,石蜡包埋切片,苏木精-伊红(HE)染色后,置于光镜下观察组织的病理变化。
1.7统计学分析 应用SPSS 21.0软件进行统计分析,差异比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1OmpA蛋白表达与纯化 将Ye92010-ompA重组克隆子表达后,采用His标签纯化柱获取目的蛋白OmpA,通过SDS-PAGE电泳对所获取的蛋白进行鉴定,结果显示纯化后的蛋白约38 kDa(图1)。与预期结果相符[10],BCA法测定目的蛋白浓度为2.01 mg/mL。
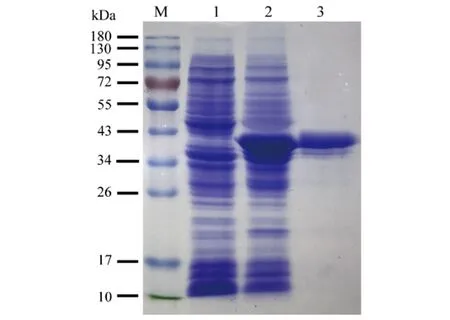
M:Marker;泳道1:未诱导的Ye92010-ompA重组克隆子全菌蛋白;泳道2:诱导后Ye92010-ompA重组克隆子全菌蛋白;泳道3:纯化的Ye92010-OmpA图1 小肠结肠炎耶尔森菌OmpA表达纯化SDS-PAGE电泳图Fig.1 SDS-PAGE electrophoretogram of purified Ye92010-OmpA
2.2大鼠攻毒试验 使用Ye92010攻毒4 h后,OmpA免疫组与对照组大鼠均表现出厌食、被毛杂乱、粪便呈松软非颗粒状等症状,至第2 d有部分恢复、第4 d全部恢复正常。连续观察3周,OmpA免疫组和对照组大鼠均未出现死亡,各组大鼠肛温无统计学差异(P>0.05)。
2.3粪便排菌检测 使用Ye92010攻毒后,每日采集大鼠新鲜粪便,通过粪便分离培养和PCR对大鼠粪便排菌情况进行检测。结果显示两组大鼠粪便排菌起始日均为攻毒后第3 d,其中OmpA免疫组中,经低剂量和高剂量攻毒的大鼠粪便排菌时间均为14 d,而对照组中经低剂量和高剂量攻毒的大鼠粪便排菌时间分别为17 d和21 d。相对于对照组,OmpA免疫组粪便排菌时间明显缩短,说明OmpA蛋白免疫原性良好。
2.4攻毒后大鼠肝、脾、肠大体形态观察 将攻毒3周后的实验大鼠进行解剖并观察各脏器的病理变化。由于Ye92010对大鼠具有较强的致病性,对照组大鼠出现了严重的病理改变,可观察到明显的组织变性及坏死灶,双侧腹股沟淋巴结肿大、肝脏黏连,甚至出现了肠脓肿和重度肠系膜液化等现象(图2b1-b4)。相比较于对照组,OmpA免疫组大鼠症状较轻,仅出现轻度的皮下肿块或脾肿大现象,肠管间界限模糊,腹股沟淋巴结肿大也仅局限于单侧(图2a1-a4)。空白对照组由于未经攻毒而无病理学改变(图2c1-c4)。
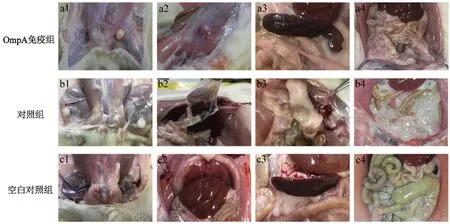
注:OmpA免疫组:经OmpA免疫后,用Ye92010攻毒的大鼠大体形态;对照组:等体积PBS代替OmpA免疫后,用Ye92010攻毒的大鼠大体形态;空白对照组:未经任何处理,正常饲养的大鼠大体形态a1:单侧腹股沟淋巴结肿大;a2:皮下肿块;a3:轻度脾水肿 a4:肠管间界限模糊;b1:双侧腹股沟淋巴结肿大;b2:肝脏黏连;b3:肠脓肿;b4:重度肠系膜液化;c1-c4:正常大鼠大体形态图2 各组SD大鼠大体形态观察Fig.2 Observation on general morphology of SD rats in each group
2.5细菌攻毒后大鼠肝组织病理学分析 在攻毒试验中,本研究同时进行高、低菌量的攻毒方案。低剂量攻毒组中,OmpA免疫组大鼠肝组织局部可见炎性细胞(淋巴细胞,嗜酸性粒细胞)灶性浸润,肝组织轻度水肿,细胞胞浆染色变浅(图3B);对照组大鼠肝组织局部可见炎性细胞(淋巴细胞,嗜酸性粒细胞)灶性浸润,肝组织水肿,细胞胞浆染色变浅,肝窦间隙水肿增宽(图3D)。高剂量攻毒组中,OmpA免疫组大鼠肝组织局部可见炎性细胞(淋巴细胞为主)灶性浸润,肝组织其他结构均正常(图3C);对照组大鼠肝组织局部可见炎性细胞(淋巴细胞,嗜酸性粒细胞)灶性浸润,肝组织水肿,肝窦间隙水肿增宽(图3E)。
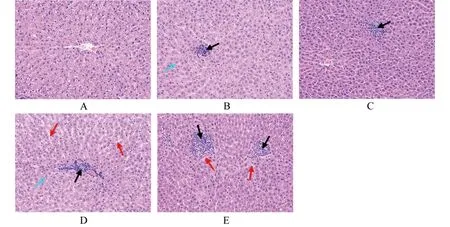
A:正常肝组织;B:低剂量攻毒OmpA免疫组大鼠肝组织;C:高剂量攻毒OmpA免疫组大鼠肝组织;D:低剂量攻毒对照组大鼠肝组织;E:高剂量攻毒对照组大鼠肝组织黑色箭头所示为炎性细胞灶性浸润,蓝色箭头所示为细胞胞浆染色变浅,红色箭头所示为肝窦间隙水肿增宽图3 小肠结肠炎耶尔森菌Ye92010攻毒后各组SD大鼠肝组织病理学改变(×200)Fig.3 Histopathologic change of liver of SD rats infected with Ye92010 in each group(×200)
2.6细菌攻毒后大鼠脾组织病理学分析 低剂量攻毒组中,OmpA免疫组大鼠脾脏外膜完整覆盖,脾窦大小正常,脾小结局部区域偶见滤泡中心变性坏死(图4B);对照组大鼠脾脏外膜完整覆盖,红髓区域可见较多中性粒细胞散在浸润,脾窦结构疏松伴轻度扩张和红髓肿胀,滤泡中心变性坏死(图4D)。高剂量攻毒组中,OmpA免疫组大鼠脾脏外膜完整覆盖,红髓区域可见组织结构疏松、水肿,伴少量中性粒细胞浸润(图4C);对照组大鼠脾脏外膜完整覆盖,局部区域脾脏结构紊乱,脾窦结构疏松伴轻度扩张,红髓肿胀且局部区域可见少量中性粒细胞浸润(图4E)。
2.7细菌攻毒后大鼠回肠组织病理学分析 低剂量攻毒组中,OmpA免疫组大鼠回肠组织粘膜层可见较多炎症细胞(中性粒细胞,单核细胞,淋巴细胞)散在浸润,伴有粘膜层及粘膜下层水肿(图5B)。对照组大鼠回肠组织粘膜层可见大量炎症细胞(中性粒细胞,单核细胞,淋巴细胞)广泛浸润,粘膜下层可见淋巴结结构,组织整体水肿(图5D)。高剂量攻毒组中,OmpA免疫组大鼠回肠组织粘膜层局部可见炎症细胞(淋巴细胞)散在浸润,伴有组织局部区域坏死,粘膜下层及肌层结构正常(图5C)。对照组大鼠回肠组织粘膜层可见大量炎症细胞(嗜酸性粒细胞,淋巴细胞)广泛浸润,粘膜下层组织水肿(图5E)。
3 讨 论
小肠结肠炎耶尔森菌属于肠杆菌科,是一种革兰阴性无芽孢杆菌。在欧洲,小肠结肠炎耶尔森菌是仅次于空肠弯曲菌和沙门氏菌的第三大人兽共患病病原菌;在我国,已知的小肠结肠炎耶尔森菌暴发感染共2次,总计500多人[13-14]。但由于对小肠结肠炎耶尔森菌的监测起步较晚,很多由该菌感染造成的疾病没有得到很好的鉴定,故该菌的发病率在我国一直被严重低估,研制对抗致病性耶尔森菌的疫苗对于肠道疾病的预防和控制具有重大意义。近几年,有大量研究表明OmpA是一种很好的免疫原性蛋白,可作为研制疫苗的候选蛋白。
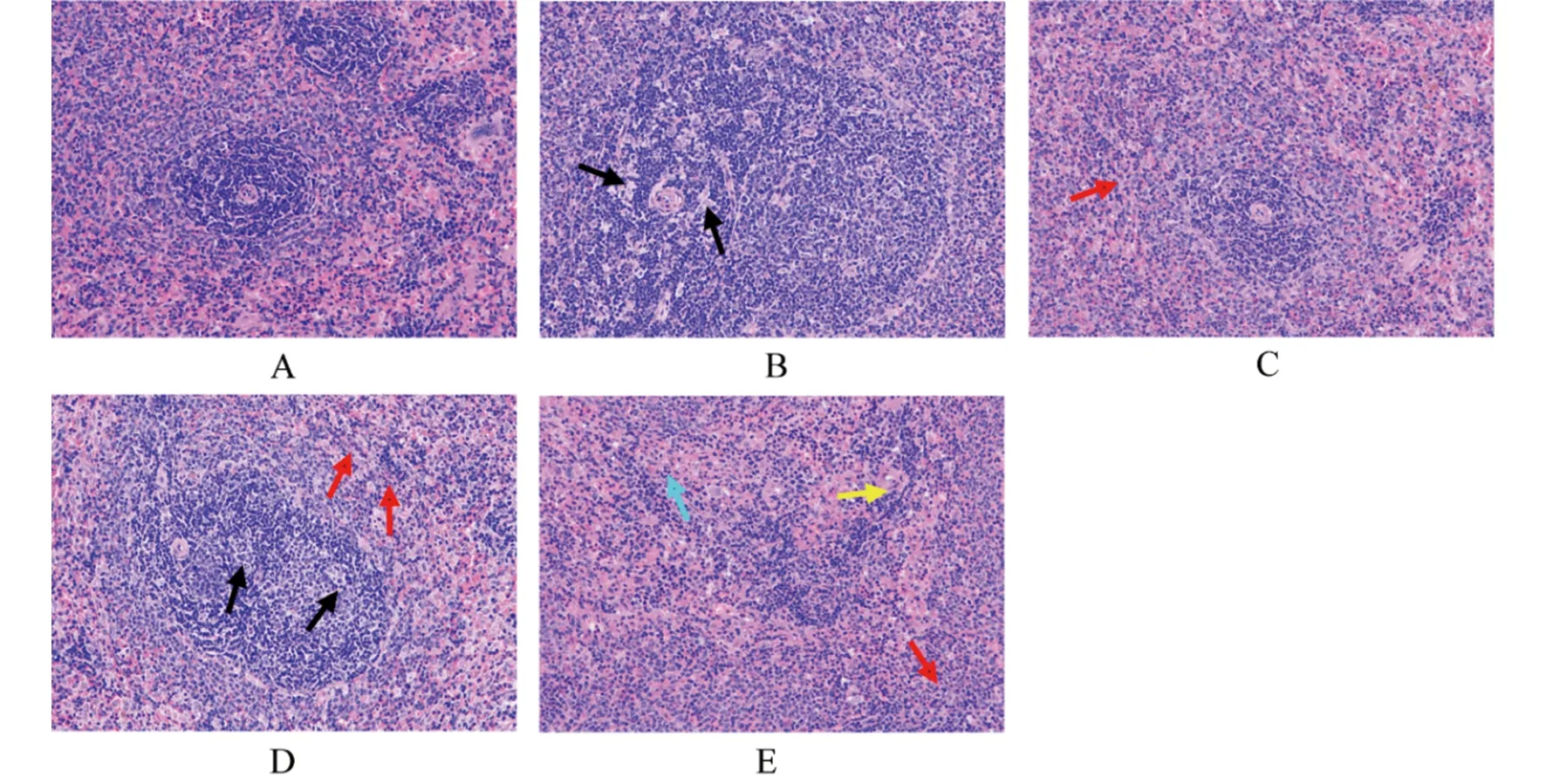
A:正常脾组织;B:低剂量攻毒OmpA免疫组大鼠脾组织;C:高剂量攻毒OmpA免疫组大鼠脾组织;D:低剂量攻毒对照组大鼠脾组织;E:高剂量攻毒对照组大鼠脾组织黑色箭头所示为滤泡中心变性坏死,红色箭头所示为中性粒细胞浸润,蓝色箭头所示为红髓肿胀,黄色箭头所示为脾脏结构紊乱图4 小肠结肠炎耶尔森菌Ye92010攻毒后各组SD大鼠脾组织病理学改变(×200)Fig.4 Histopathologic change of spleen of SD rats infected with Ye92010 in each group(×200)
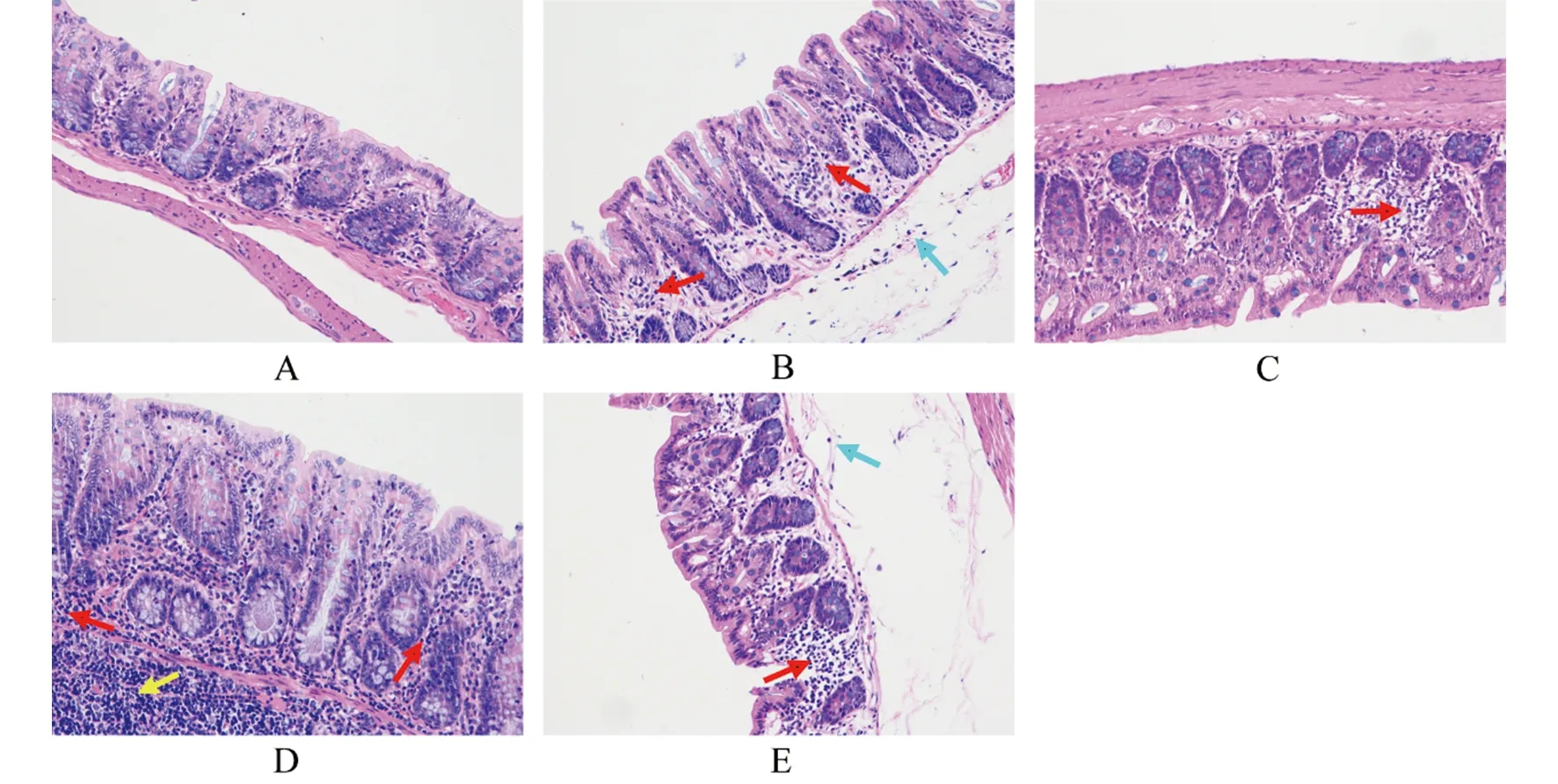
A:正常回肠组织;B:低剂量攻毒OmpA免疫组大鼠回肠组织;C:高剂量攻毒OmpA免疫组大鼠回肠组织; D:低剂量攻毒对照组大鼠回肠组织;E:高剂量攻毒对照组大鼠回肠组织红色箭头所示为粘膜层炎症及水肿,蓝色箭头所示为粘膜下层炎症及水肿,黄色箭头所示为淋巴结结构图5 小肠结肠炎耶尔森菌Ye92010攻毒后各组SD大鼠回肠组织病理学改变(×200)Fig.5 Histopathologic change of ileum of SD rats infected with Ye92010 in each group(×200)
OmpA在革兰阴性菌中广泛存在,是最主要的外膜蛋白之一。有研究表明该蛋白主要通过粘附于粘膜表面、血清抵抗、侵袭、抗菌肽抵抗和使宿主细胞活化使细菌发挥致病作用,其高拷贝数和暴露于细菌表面的特性使其能促发固有免疫和适应性免疫[15-16]。此外,OmpA可被中性粒细胞弹性蛋白酶特异性识别,并且可诱导实验动物产生较高水平的抗体,但其对被免疫动物的免疫保护能力目前尚不清楚[17-18]。
在本课题组前期工作中已经通过体外实验,将三种序列性ompA克隆表达蛋白纯化后分别免疫小鼠所得的血清与三个型的OmpA进行免疫杂交,结果证实OmpA良好的交叉免疫原性。因此本研究的目的在于证实OmpA的这种免疫原性是否能给机体带来免疫保护。本研究通过腹股沟注射的方式对大鼠进行OmpA免疫,攻毒后通过粪便分离培养和PCR鉴定菌株。结果显示经高剂量攻毒的对照组排菌时间最长,长达21 d,且长于低剂量攻毒对照组。而经低剂量和高剂量攻毒的OmpA免疫组排菌时间相同,都在攻毒后14 d检测不到排菌。排菌实验结果表明大鼠经OmpA免疫后,Ye92010在肠道的定植受到阻碍并被快速地从肠道清除。
小肠结肠炎耶尔森菌具有嗜淋巴组织特征,感染小鼠后,在肠粘膜通过M细胞进入下层的淋巴组织,即Peyer结,这种侵袭可致大量白细胞增生,并与细胞外小肠结肠炎耶尔森菌形成微小脓肿,还可通过血流或淋巴管播散到肝、脾等脏器,引发肠以外的其他脏器感染[19-20]。本研究需收集大鼠粪便进行排菌检测,故并未在急性感染期对大鼠进行组织病理分析,而在其停止排菌后对所有大鼠进行解剖,摘取肝、脾、肠,观察组织病理学改变,研究致病性小肠结肠炎耶尔森菌OmpA对大鼠的免疫保护作用。大体观察结果显示OmpA免疫组出现腹股沟淋巴结肿大、皮下肿块、脾结节、轻度肠系膜液化,对照组出现腹股沟淋巴结肿大、脾结节、肠脓肿、脾脓肿、重度肠系膜液化,其中OmpA免疫组中,低剂量攻毒组和高剂量攻毒组各有一只大鼠未观察到明显的组织病变及坏死,我们认为可能是由于大鼠个体差异。组织病理切片结果显示OmpA免疫组和对照组所有大鼠均出现不同程度的组织病变,肝病变出现炎症细胞浸润和轻度水肿,脾病变出现滤泡中心变性坏死、水肿、炎症细胞浸润,肠病变出现粘膜层和粘膜下层炎症细胞浸润和水肿。与大体观察结果中出现的脏器脓肿、液化较为一致,且均表现为OmpA免疫组的病变程度轻于对照组,说明OmpA对大鼠产生免疫保护。
综上所述,致病性小肠结肠炎耶尔森菌OmpA免疫大鼠后,可使大鼠抵抗致病性小肠结肠炎耶尔森菌的能力大大增强,排菌时间变短,组织病变变轻,OmpA对大鼠的免疫保护作用显著。本研究表明OmpA不仅在体外水平表现出良好的免疫原性,更能在体内水平给机体带来免疫保护,结合OmpA在3种致病性耶尔森菌中高度保守的特点,推测OmpA可成为包括鼠疫在内的致病性耶尔森菌疫苗的优质候选蛋白。
[1] Bottone EJ.Yersiniaenterocolitica: overview and epidemiologic correlates[J]. Microbes Infect, 1999, 1: 323-333.
[2] Koebnik R. Structural and functional roles of the surface-exposed loops of the beta-barrel membrane protein OmpA fromEscherichiacoli[J]. J Bacteriol, 1999, 181:3688-3694.
[3] Smajs D, Pilsl H, Braun V. Colicin U, a novel colicin produced byShigellaboydii[J]. J Bacteriol, 1997, 179:4919-4928.
[4] Erova TE, Rosenzweig JA, Sha J, et al. Evaluation of protective potential ofYersiniapestisouter membrane protein antigens as possible candidates for a new-generation recombinant plague vaccine[J]. Clin Vaccine Immunol, 2013, 20:227-238. DOI:10.1128/CVI.00597-12
[5] Singh SP, Williams YU, Miller S, et al. The C-terminal domain ofSalmonellaentericaserovar typhimurium OmpA is an immunodominant antigen in mice but appears to be only partially exposed on the bacterial cell surface[J]. Infect Immun, 2003, 71:3937-3946.
[6] Bhowmick R, Pore D, Chakrabarti MK. Outer membrane protein A (OmpA) ofShigellaflexneri2a induces TLR2-mediated activation of B cells: involvement of protein tyrosine kinase, ERK and NF-kappaB[J]. PLoS One, 2014, 9(10):e109107. DOI:10.1371/journal.pone.0109107
[7] Ayalew S, Shrestha B, Montelongo M, et al. Immunogenicity ofMannheimiahaemolyticarecombinant outer membrane proteins serotype 1-specific antigen, OmpA, OmpP2, and OmpD15[J]. Clin Vaccine Immunol, 2011, 18:2067-2074. DOI:10.1128/CVI.05332-11
[8] Gu W, Wang X, Qiu H, et al. Comparative antigenic proteins and proteomics of pathogenicYersiniaenterocoliticabio-serotypes 1B/O: 8 and 2/O: 9 cultured at 25 degrees C and 37 degrees C[J]. Microbiol Immunol, 2012, 56:583-594. DOI:10.1111/j.1348-0421.2012.00478.x
[9] Li K, Gu W, Liang J, et al. Gene polymorphism analysis ofYersiniaenterocoliticaouter membrane protein A and putative outer membrane protein A family protein[J]. BMC Genomics, 2014, 15:201. DOI:10.1186/1471-2164-15-201
[10] Chen Y, Duan R, Li X, et al. Homology analysis and cross-immunogenicity of OmpA from pathogenicYersiniaenterocolitica,YersiniapseudotuberculosisandYersiniapestis[J]. Mol Immunol, 2015, 68:290-299. DOI:10.1016/j.molimm.2015.09.016
[11] Wang X, Cui Z, Jin D, et al. Distribution of pathogenicYersiniaenterocoliticain China[J]. Eur J Clin Microbiol Infect Dis, 2009, 28:1237-1244. DOI:10.1007/s10096-009-0773-x
[12] Liang J, Wang X, Xiao Y, et al. Prevalence ofYersiniaenterocoliticain pigs slaughtered in Chinese abattoirs[J]. Appl Environ Microbiol, 2012, 78:2949-2956. DOI:10.1128/AEM.07893-11
[13] Backhans A, Fellstrom C, Lambertz ST. Occurrence of pathogenicYersiniaenterocoliticaandYersiniapseudotuberculosisin small wild rodents[J]. Epidemiol Infect, 2011, 139:1230-1238. DOI:10.1017/S0950268810002463
[14] Wang X, Qiu H, Jin D, et al. O:8 serotypeYersiniaenterocoliticastrains in China[J]. Int J Food Microbiol, 2008, 125:259-266. DOI:10.1016/j.ijfoodmicro.2008.04.016
[15] Smith SG, Mahon V, Lambert MA, et al. A molecular Swiss army knife: OmpA structure, function and expression[J]. FEMS Microbiol Lett, 2007, 273:1-11. DOI:10.1111/j.1574-6968.2007.00778.x
[16] Confer AW, Ayalew S. The OmpA family of proteins: roles in bacterial pathogenesis and immunity[J]. Vet Microbiol, 2013, 163:207-222.DOI:10.1016/j.vetmic.2012.08.019
[17] Lower BH, Yongsunthon R, Vellano FP 3rd, et al. Simultaneous force and fluorescence measurements of a protein that forms a bond between a living bacterium and a solid surface[J]. J Bacteriol, 2005, 187:2127-2137. DOI:10.1128/JB.187.6.2127-2137.2005
[18] Gatto NT, Dabo SM, Hancock RE, et al. Characterization of, and immune responses of mice to, the purified OmpA-equivalent outer membrane protein ofPasteurellamultocidaserotype A:3 (Omp28)[J]. Vet Microbiol, 2002, 87:221-235.
[19] Autenrieth IB, Firsching R. Penetration of M cells and destruction of Peyer’s patches byYersiniaenterocolitica: an ultrastructural and histological study[J]. J Med Microbiol, 1996, 44:285-294. DOI:10.1099/00222615-44-4-285
[20] Bottone EJ.Yersiniaenterocolitica: the charisma continues[J]. Clin Microbiol Rev, 1997, 10:257-276
