储藏条件对柏子仁污染黄曲霉毒素的影响及脱除方法探讨△
2018-06-21陈建茹董伟伟彭娟焦晓林吴馨琰高微微
陈建茹,董伟伟,彭娟,焦晓林,吴馨琰,高微微*
(1.上海同济堂药业有限公司,上海 201707;2.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
柏子仁为柏科Cupressaceae植物侧柏Platycladusorientalis(L.)Franco的干燥成熟种仁,具有养心安神,润肠通便,止汗的功效[1]。柏子仁含丰富的油脂,在储藏过程中受环境条件的影响,极易出现泛油、霉变等现象,严重影响柏子仁的品质[2]。为了保障用药安全,《中华人民共和国药典》2015年版新增了对柏子仁药材及饮片黄曲霉毒素检查项目,规定限量标准为黄曲霉毒素B1(AFB1) ≤5 μg·kg-1,黄曲霉毒素G2、G1、B2、B1总量(AFs)≤ 10 μg·kg-1。我们查阅到有关柏子仁黄曲霉毒素污染调查的8篇报道中,总共23个批次,均有黄曲霉毒素检出,其中20个批次超过《中华人民共和国药典》2015年版限量标准,不合格率高达87%[3-10],表明柏子仁黄曲霉毒素的污染问题比较严重。
黄曲霉毒素主要由黄曲霉Aspergillusflavus和寄生曲霉A.parasiticus产生,其生物合成受到温度、湿度等多种因子的影响[11-12]。目前对于中药材包装储藏研究多关注于药材性状、有效成分的变化[13-15],而储藏条件对黄曲霉毒素产生和积累的影响报道较少。对于已经污染黄曲霉毒素的中药材,如何通过有效的处理技术脱除毒素在中药材领域极少有研究,虽然在食品、农作物及饲料上有相关报道[16-18],但这些方法是否适用于中药材尚待研究。本文以黄曲霉毒素污染严重的柏子仁作为研究对象,分析对比在不同储藏条件下柏子仁中黄曲霉毒素的变化,并采用不同脱除方法处理污染样品,旨在为探寻柏子仁安全储藏及黄曲霉毒素脱除方法提供参考。
1 材料和方法
1.1 供试药材
于2017年4月至10月期间,对市场收集的10个批次柏子仁进行黄曲霉毒素污染情况的检测。选择有污染的样品用于储藏与脱毒试验。
1.2 储藏试验设计
将8 kg柏子仁样品用塑料袋或真空包装,分别放置于10 ℃低温及25 ℃常温2个贮藏库。储藏库湿度各为65%和60%,分别于储藏前及储藏后1个月、2个月取样,检测柏子仁中黄曲霉毒素的含量。取样时每个处理各取两份样品,每份样品测定1次。
1.3 黄曲霉毒素脱除试验
分别采用温水、75%乙醇处理柏子仁。取500 g柏子仁加入1000 mL 45 ℃温水或75%乙醇,搅拌5 min,置于不锈钢筛网上沥干,80 ℃干燥3~4 h,晾凉,存放于洁净的塑料袋中,待检。
1.4 黄曲霉毒素提取及含量测定
样品按四分法取45 g左右,粉碎,过24目筛。参照《中华人民共和国药典》2015年版通则2351第一法免疫亲和柱净化HPLC柱后光化学衍生化法测定黄曲霉毒素含量[19]。免疫亲合柱购于北京中科汇仁科技有限公司,高效液相色谱仪采用Agilent 1260,色谱柱采用C18反相硅胶柱(Agilent TC-C18(2),4.6 mm×250 mm×5 μm)。色谱条件以甲醇-乙腈-水(20∶18∶62)为流动相,流速0.8 mL·min-1,柱温25 ℃,进样量为20 μL。通过与已知浓度的黄曲霉毒素B1、B2、G1、G2对照品(购于中国食品药品检定研究院,浓度分别为2.04×10-3、0.86×10-3、2.12×10-3、0.76×10-3ng·mL-1)比较,计算柏子仁样品中AFB1及AFs的含量。
2 结果与分析
2.1 不同批次柏子仁黄曲霉毒素污染量
10个批次柏子仁样品中共有9批样品检出黄曲霉毒素。其中有5批次样品超出《中华人民共和国药典》2015年版限量标准(AFB1≤ 5 μg·kg-1,AFs ≤ 10 μg·kg-1),不合格率为50%(表1)。污染量最高的1批样品(批号17-06-08-04)AFB1高达247.5 μg·kg-1,AFs为270.0 μg·kg-1。

表1 10批次柏子仁黄曲霉毒素检测结果 μg·kg-1
注:ND表示未检出。
2.2 不同储藏条件下柏子仁的黄曲霉毒素含量
选择17-07-01-01批次进行储藏试验。储藏前的AFB1为3.2 μg·kg-1,AFs为3.9 μg·kg-1,均未超过《中华人民共和国药典》2015年版限量标准。在10 ℃、25 ℃的温度下储藏1个月、2个月后,两种包装的所有样品黄曲霉毒素的含量均有所增加,表现出随储藏时间延长黄曲霉毒素积累的趋势,25 ℃储藏下的毒素增加量高于10 ℃(表2)。10 ℃贮藏条件下,储藏1个月的柏子仁AFB1已经超出药典限量标准,在此时真空包装与塑料袋包装没有明显差别,AFB1的增加量为1.4和1.3倍,AFs的增加量为1.5倍和1.4倍;储藏2个月时真空包装的污染量高于塑料袋包装,AFB1的增加量为4.5和2.7倍,AFs的增加量为4.3倍和2.3倍。25 ℃贮藏条件下,储藏1个月后AFB1和AFs都超出标准,真空包装的污染量高于塑料袋包装,AFB1的增加量为5.1和2.0倍,AFs的增加量为6.3倍和2.2倍。储藏2个月时,真空包装的污染量则低于塑料袋包装AFB1的增加量为5.4和8.3倍,AFs的增加量为7.8倍和4.9倍。
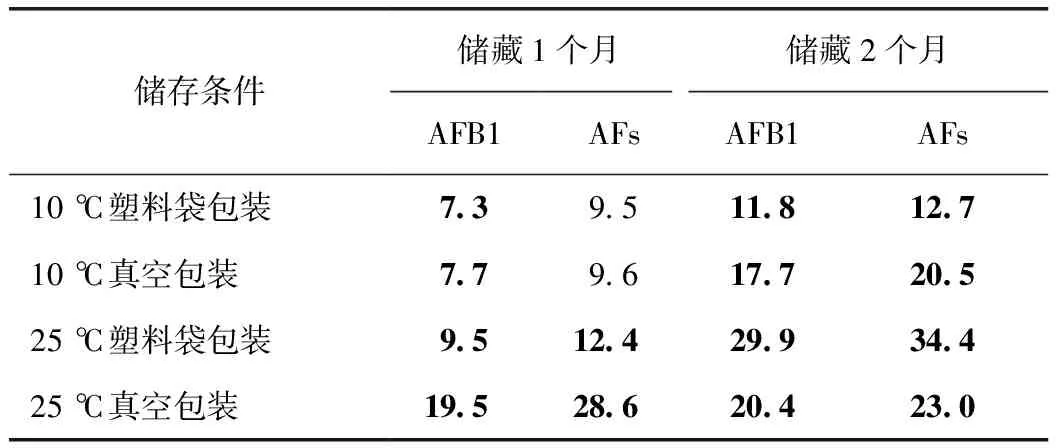
表2 不同储藏条件下柏子仁的AFB1和AFs检出量 μg·kg-1
注:表中数据为同一处理2次重复取样测定的平均值。
2.3 不同处理对柏子仁黄曲霉毒素的脱除效果
75%乙醇洗和水洗对柏子仁中黄曲霉毒素具有一定脱除作用,脱除的效率存在差异。75%乙醇洗可使柏子仁样品中AFB1由初始浓度52.6 μg·kg-1降低至5 μg·kg-1,脱除率为90.5%;AFs由初始浓度60.5 μg·kg-1,降低至5.8 μg·kg-1,脱除率为90.4%,处理后样品黄曲霉毒素的含量降低至药典限量标准以下(表3)。水洗对柏子仁AFB1的脱除率为87.7%;对AFs的脱除率为87.8%,处理后样品黄曲霉毒素的含量仍高于药典限量标准。

表3 不同方法处理柏子仁的黄曲霉毒素检出量及脱除率

3 讨论
10批次柏子仁的调查结果表明,柏子仁药材中普遍存在黄曲霉毒素污染。郝爱鱼等[3]调查了120批中药饮片的黄曲霉毒素污染状况,发现在各类药材中种子类的污染率最高,达到30%以上,认为种子类药材被污染的程度严重,应作为黄曲霉毒素监测的重点对象。种子类药材含淀粉、蛋白、糖、脂类成分较多,有报道亚油酸的过氧化物通过作用于G蛋白信号通路刺激黄曲霉菌株产生黄曲霉毒素[20-21];《中华人民共和国药典》2015年版规定了柏子仁中AFB1/AFs的限量标准,随之相关的检测数据开始积累,综合文献报道及市场调查,我们发现柏子仁在种子类药材中是污染最为严重的种类之一,推测柏子仁的脂类成分组成可能与其污染黄曲霉毒素严重有关,有待进一步研究证实。
本文涉及的两个储藏温度10 ℃、25 ℃,两种密封包装条件下,柏子仁黄曲霉毒素在储藏1个月后检出量均有所增加。文献报道A.flavus在花生上最低生长和产毒的温度为13±1 ℃[22],A.parasiticus的最低产毒温度为10 ℃[23]。本实验储藏柏子仁的低温库为10 ℃,在这个温度下柏子仁中仍有毒素产生,提示我们柏子仁上污染菌的种类及其在药材上的产毒特性值得进一步研究。我们发现在真空包装中柏子仁仍会发生黄曲霉毒素积累,这种现象在与其他一些饮片厂的交流过程中也被证实确实存在,原因一方面是污染菌在真空包装中仍然存活,产毒真菌在不生长的情况下仍然可以合成黄曲霉毒素,这一现象与刘光宪等[24]报道4种不同材料的包装袋抽真空充CO2气体贮藏花生后AFB1含量随储藏时间增加而积累的结果一致。另一方面的原因可能与柏子仁的化学成分有关,在无氧条件下柏子仁中含有的促进黄曲霉毒素合成的成分如亚油酸、亚麻酸等相对稳定[25-27],而它们的氧化产物如13S-过氧羟基-9,11-十八碳二烯酸(13S-HPODE)、脂氧合物反而可通过抑制毒素合成基因簇上aflO、cypA、ordA、aflR、aflS等基因的表达从而抑制产毒[27-28],因此无氧条件下真空包装中柏子仁的黄曲霉毒素含量有可能高于非真空包装。本研究结果与以往真空包装有利于食品保藏的观念有所不同,提示柏子仁的黄曲霉毒素污染可能有其特殊性,在今后的工作中有必要深入研究含氧量及药材成分对黄曲霉毒素合成的影响及机制。
研究结果表明,75%乙醇洗、水洗等洗脱法对于柏子仁中黄曲霉毒素的去除具有一定效果,与文献报道洗脱法可去除莲子、玉米中黄曲霉毒素的结果相一致,罗小荣等[29]报道水洗法可将莲子中黄曲霉毒素总量由75.16 μg·kg-1降低至31.05 μg·kg-1,脱毒率为59%;胡兰[18]利用水洗法去除玉米中的黄曲霉毒素,平均去毒率在80%以上。本研究表明,75%乙醇比水对柏子仁中黄曲霉毒素具有更好的脱毒效果,原因可能由于黄曲霉毒素溶于乙醇而不溶于水,75%乙醇洗不仅可以通过溶剂冲洗产生的力脱除柏子仁表面的毒素,还可以溶解出一部分内部的毒素,而水洗只产生前者作用。尽管如此,本实验中75%乙醇洗和水洗的脱毒率均达不到100%,说明柏子仁一旦污染黄曲霉毒素很难完全去除,尤其对于污染严重的样品,即使脱除了大部分毒素,脱毒后的样品可能仍高于药典的限量要求。从安全、经济的角度考虑,作者认为防毒应比脱毒更重要,如何避免产毒真菌的污染将是今后工作的重点。本研究初步探讨了柏子仁中黄曲霉毒素的脱除方法,关于脱除方法对柏子仁药理活性是否存在影响及更高效的脱除技术等还有待于进一步研究和探索。研究的结果可为其他种子类药材的相关研究提供借鉴与参考,尤其是《中华人民共和国药典》2015年版已制订黄曲霉毒素限量标准的酸枣仁、桃仁、莲子、肉豆蔻、决明子、薏苡仁等品种。
[1] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:247-248.
[2] 何嫩艳.几种易泛油霉变的药材简易贮存[J].黑龙江中医药,1994,3:52.
[3] 郝爱鱼,赵丽元,刘英慧,等.HPLC柱后光衍生荧光法测定中药饮片中黄曲霉毒素残留量[J].药物分析杂志,2012,32(12):2203-2207.
[4] 谢昕,李红艳.免疫亲和柱净化-光化学柱后衍生-高效液相色谱法测定柏子仁中的黄曲霉毒素[J].理化检验-化学分册,2016,52(5):541-544.
[5] 胡一晨,万丽,范成杰,等.免疫亲和柱净化HPLC柱后光化学衍生化法检测中药及染菌中药制剂中间体的黄曲霉毒素[J].中国实验方剂学杂志,2012,18(10):116-119.
[6] 杨晶,栾国华,杨润陆.液相色谱-串联质谱法测定柏子仁中黄曲霉毒素残留量[J].中国药业,2011,20(14):35-37.
[7] 栗建明,李纯.中国药典黄曲霉毒素检测过程有关问题分析[J].今日药学,2016,26(6):405-409.
[8] 郑润生.中药材污染真菌毒素的液质联用高通量检测研究[D].广州:广州中医药大学,2014.
[9] Chen A J,Jiao X L,Hu Y J,et al.Mycotoxins in traditional medicinal seeds from China[J].Toxins,2015,7:3858-3875.
[10] Yang M H,Hen J M,Hang X H.Immunoaffinity column clean-up and liquid chromatography with post-column derivatization for analysis of aflatoxins in traditional Chinese medicine[J].Omatographia,2005,62(9-10):499-504.
[11] Villers P.Aflatoxins and safe storage[J].Front Microbiol,2014,5:1-6.
[12] Abrar M,Anjum F M,Butt M S,et al.Aflatoxins biosynthesis occurrence toxicity and remedies[J].Crit Rev Food Sci,2013,53(8):862-874.
[13] 晋小军,黄惠英,李国琴,等.不同包装条件对党参皂甙含量的影响[J].中国野生植物资源,2002,21(5):57-59.
[14] 蒋桂华,贾敏如,马逾英,等.川芎储藏条件的研究[J].中药材,2005,28(6):464-466.
[15] 殷艳秀,韩英丽,韩烨.浅谈枸杞子的采收加工和储藏保管方法[J].黑龙江中医药,1998,2:49-50.
[16] 叶盛群,陈南南,谌刚.霉菌毒素吸附剂对牛奶中黄曲霉毒素M1含量的影响[J].饲料工业,2012,33(17):17-18.
[17] 黄达明,林琳,林克龙.加热对减少花生中黄曲霉毒素水平的作用[J].中国油脂,2006,31(7):51-53.
[18] 胡兰.饲料黄曲霉毒素的研究进展[J].饲料工业,2001,22(3):20-22.
[19] 国家药典委员会.中华人民共和国药典:四部[M].北京:中国医药科技出版社,2015:224-225.
[20] Passi S,Nazzaro-Porro M,Fanelli C,et al.Role of lipoperoxidation in aflatoxin production[J].Appl Microbiol Biotechnol,1984,19(3):186-190.
[21] Brodhagen M,Keller N P.Signaling pathways connecting mycotoxin production and sporulation[J].Mol Plant Pathol,2006,7(4):285-301.
[22] Diener U L,Davis N D.Limiting temperature and relative humidity for growth and production of aflatoxin and free fatty acids byAspergillusflavusin sterile peanuts[J].J Am Oil Chem Soc,1967,44(4):259-263.
[23] Northolt M D,Verhulsdonk C A H,Soentoro P S S,et al.Effect of water activity and temperature on aflatoxin production byAspergillusparasiticus[J].J Milk Food Technol,1976,39(3):170-174.
[24] 刘光宪,祝水兰,周巾英,等.CO2密闭贮藏对花生脂肪氧化及黄曲霉生长的影响[J].食品研究与开发,2017,38(6):197-200.
[25] 徐新刚,付加雷,闫雪生.柏子仁和柏子仁霜中脂肪酸的GC-MS比较分析研究[J].齐鲁药事,2009,28(9):523-524.
[26] Tiwari R P,Mittal V,Singh G,et al.Effect of fatty acids on aflatoxin production byAspergillusparasiticus[J].Folia Microbiol,1986,31(2):120-123.
[27] Yan S J,Liang Y T,Zhang J D,et al.Autoxidated linolenic acid inhibits aflatoxin biosynthesis inAspergillusflavusvia oxylipin species[J].Fungal Genet Biol,2015,81:229-237.
[28] Burow G B,Nesbitt T C,Dunlap J,et al.Seed lipoxygenase products modulateAspergillusmycotoxin biosynthesis[J].Mol Plant Microbe In,1997,10(3):380-387.
[29] 罗小荣,李人趙,付刚剑,等.莲子中黄曲霉毒素去除方法研究[J].现代食品,2017,19:115-119.
