影响乳腺癌术后化疗联合放疗患者远期预后的相关因素分析
2018-06-21黄大翠李晓诗
黄大翠,李晓诗
乳腺癌是女性常见恶性肿瘤之一,发生于乳腺腺上皮组织,病因尚未完全阐明,可能与肥胖、饮酒、性激素、遗传等因素相关[1]。近年来我国乳腺癌发生率呈快速上升趋势,已成为威胁女性身心健康的重大公共卫生问题[2]。随着乳腺癌生物学行为认识的加深,越来越多的研究发现,根治性手术后患者仍具有一定复发与转移风险,需结合放疗、化疗等,破坏肿瘤细胞生长与繁殖,降低复发率,争取治愈[3-4]。本研究探讨影响乳腺癌根治术后化疗联合放疗患者远期预后的相关因素。
1 资料与方法
1.1 一般资料 选取成都医学院第一附属医院2012年1月至2015年174例行乳腺癌根治术患者为研究对象。纳入标准:①乳腺癌诊断参考《中国抗癌协会乳腺癌诊治指南与规范(2011版)》[5],均为单侧乳腺癌,经手术病理证实;②在我院接受根治性手术治疗,术后进行为期3年随访;③年龄18~65岁;④患者或其家属均了解本次研究,并签署知情同意书。排除标准:①原发性双侧乳腺癌;②合并其他恶性肿瘤;③合并心脑血管疾病;④肝肾功能不全;⑤妊娠期或哺乳期妇女;⑥既往放化疗史。本研究患者均为女性,年龄28~65(46.02±8.28)岁,肿瘤部位:左侧98例,右侧76例。
1.2 治疗方法 所有患者均在根治性手术后2周接受化疗,采用AC序贯紫杉醇方法,第1天给予注射用盐酸多柔比星(国药准字H33021980,浙江海正药业股份有限公司)60 mg/m2,静脉滴注,第1天给予注射用环磷酰胺(国药准字H32026196,江苏恒瑞医药股份有限公司)600 mg/m2,静脉滴注,第1天给予紫杉醇注射液(国药准字H20063169,海口奇力制药股份有限公司)175 mg/m2,静脉滴注3 h,每2周重复1次,共4个周期。末次化疗2周后开始放疗,行区域淋巴结照射,基于CT治疗计划系统对靶区进行最佳位置定位,总照射剂量46~50 Gy,23~25次分割,每周照射5 d休息2 d。
1.3 观察指标 收集患者临床及病理资料,包括年龄、月经状态、肿瘤直径、淋巴结状态、肿瘤部位、病理类型、癌症家族史等。采用免疫组化法检测保乳手术后病理标本的雌激素受体、孕激素受体、原癌基因人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达情况,试剂盒由厦门艾德生物医药科技股份有限公司提供。所有患者进行为期3年随访,前2年每3个月复查1次,第3年每6个月复查1次,进行体格检查、血液生化检查、B超检查等,以患者肿瘤复发或死亡为终点,对患者进行分组,无病生存期(disease-free survival,DFS)≤3年患者纳入预后不良组,DFS>3年患者纳入预后良好组,比较2组临床病理资料。
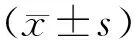
2 结果
2.1 乳腺癌患者预后影响因素的单因素分析 所有患者均接受为期3年随访,末次随访时间为2018年1月31日,失访8例,随访率为95.4%(166/174)。166例患者复发24例,死亡6例,预后不良率为18.1%(30/166)。预后良好组年龄>40岁(χ2=5.503,P=0.019)、肿瘤直径<2 cm(χ2=6.307,P=0.012)、无淋巴结转移(χ2=6.391,P=0.011)、非浸润性癌(χ2=4.014,P=0.045)、雌激素受体阳性(χ2=5.569,P=0.018)、孕激素受体阳性(χ2=5.693,P=0.017)、HER2阴性(χ2=4.198,P=0.040)患者比例显著高于预后不良组(P<0.05),月经状态(χ2=0.908,P=0.341)、肿瘤部位(χ2=0.170,P=0.680)、癌症家族史(χ2=0.484,P=0.487)等与预后不良组比较差异无统计学意义(P>0.05)。
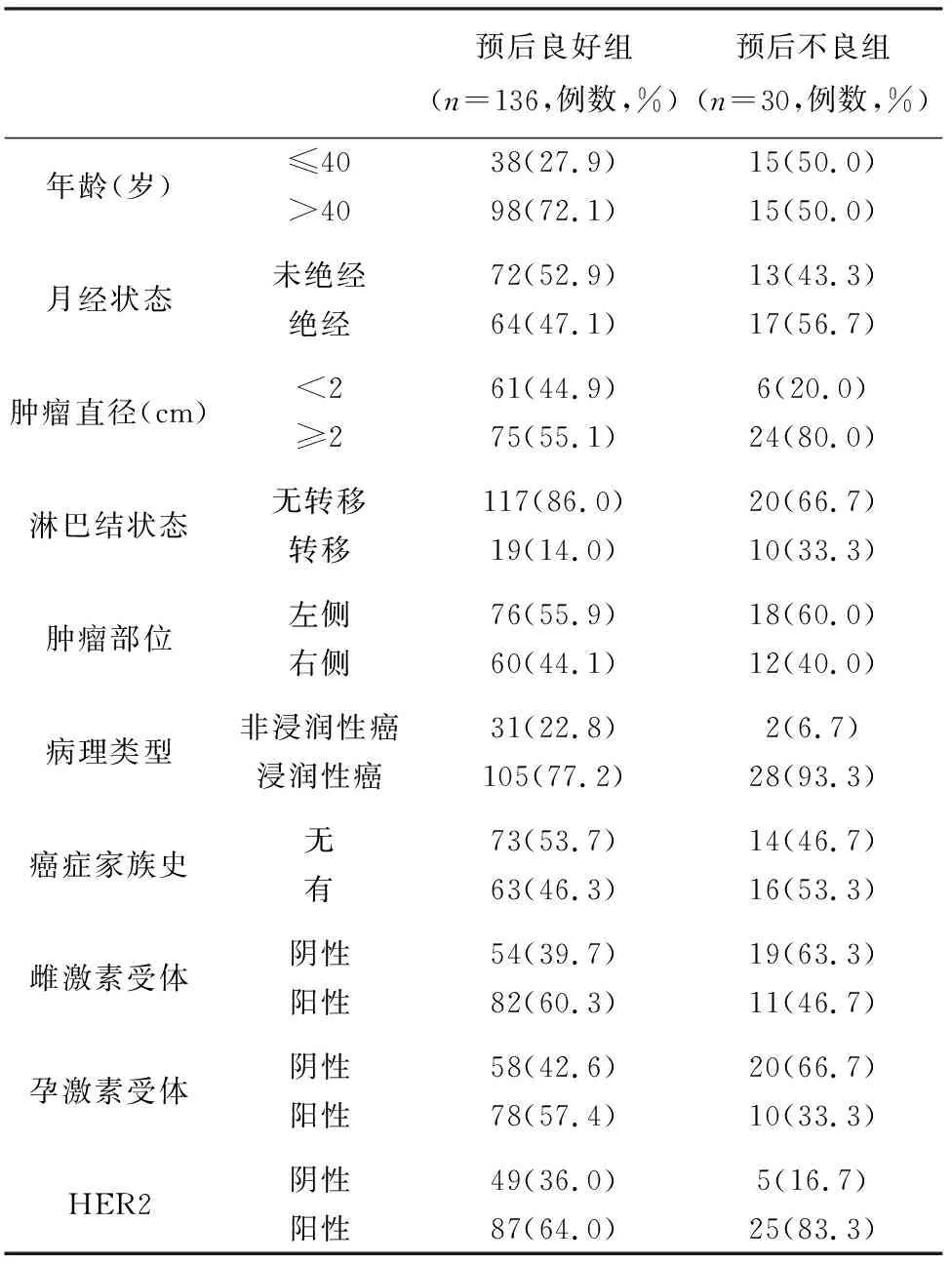
表1 乳腺癌患者预后影响因素的单因素分析
2.2 乳腺癌患者预后影响因素的多因素分析 经Logistic回归分析显示,年龄(P=0.009)、肿瘤直径(P=0.017)、淋巴结状态(P=0.006)、病理类型(P=0.035)、雌激素受体(P=0.005)、孕激素受体(P=0.002)、HER2(P=0.031)是乳腺癌患者预后独立影响因素,表2。
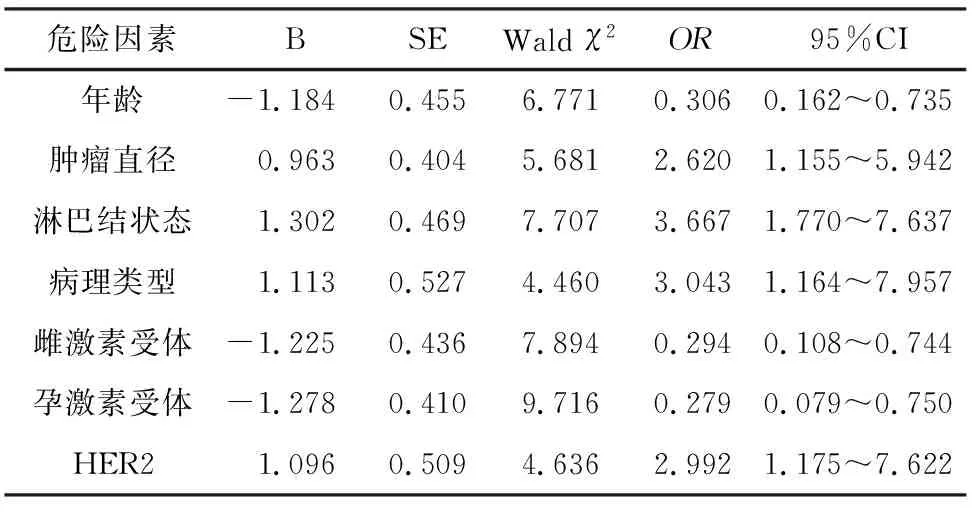
表2 乳腺癌患者预后影响因素的多因素分析
3 讨论
放射治疗是一种局部治疗方法,通过放射线照射肿瘤组织,可以有效抑制肿瘤细胞活性,杀灭肿瘤细胞,降低局部复发风险。化学药物治疗则是一种全身性治疗方法,可以抑制、杀伤手术后残留肿瘤细胞,但也可伤及正常器官组织。近年来研究证实,乳腺癌根治术后辅助放化疗可以实现肿瘤局部控制,延长患者生存期,是降低患者肿瘤复发与转移风险的重要手段[6-8]。乳腺癌根治术后放疗与化疗顺序目前尚存在一定争议[9],本研究考虑到二者同时进行可能造成毒副反应叠加,影响治疗效果,因此在化疗结束后2周再行放疗。
乳腺癌复发、转移机制较为复杂,临床上无法有效监测,如何有效评估乳腺癌患者预后成为目前临床研究的热点问题之一。年龄因素对乳腺癌患者预后影响尚存在一定争议。部分研究指出青年乳腺癌患者与中老年乳腺癌患者比较,肿瘤恶性程度高,更易发生淋巴结转移[10-11]。但也有学者指出,乳腺癌发生年龄与患者预后无明显相关性[12]。本研究显示,预后良好组年龄≤40岁患者比例显著低于预后不良组,提示年轻乳腺癌患者具有更高预后不良风险,可能由于年轻乳腺癌患者正常细胞代谢较快,内分泌系统旺盛,肿瘤细胞生长速度较快且易发生转移。内源性雌激素是乳腺癌病因之一,相关研究显示,绝经期乳腺癌患者生存期明显短于未绝经患者[13-14]。本研究中不同预后患者月经状态比较差异无统计学意义,绝经与乳腺癌患者预后的相关性需进一步研究证实。肿瘤直径与淋巴结状态是乳腺癌分期重要因子。肿瘤直径间接反映乳腺癌生物学特征,被认为是乳腺癌预后独立影响因素[15],与本研究结果相符。淋巴结状态是监测乳腺癌肿瘤负荷与转移倾向的重要指标,有研究发现,腋淋巴结转移与乳腺癌复发率呈明显相关性,腋淋巴结转移数目越多提示患者具有越高复发与死亡风险[16]。本研究显示,预后良好组腋淋巴结转移率显著低于预后不良组,证实腋淋巴结转移是乳腺癌患者预后不良的危险因素。乳腺癌可以根据肿瘤细胞的镜下特点分为不同类型,其中浸润性乳腺癌临床常见类型,大部分研究指出非浸润性乳腺癌预后最好[17-18],本研究中预后良好组非浸润性癌患者比例显著高于预后不良组,与以往研究相符。乳腺是雌激素和孕激素的靶器官,雌激素受体与孕激素受体存在于正常乳腺上皮细胞内,调节乳腺细胞增殖、生长与发育,当细胞发生癌变时,细胞内雌激素受体与孕激素受体机制破坏,部分或全部丢失。以往研究显示,雌激素受体、孕激素受体阳性者的预后较佳,具有较长生存期[19-20],与本研究结果相符。HER2是一种酪氨酸激酶,负责调控肿瘤细胞生长与转移,被公认为是乳腺癌预后判断的重要因子。本研究显示,预后良好组HER2阳性率显著低于预后不良组,临床监测中应重视HER2检查,以准确评估乳腺癌复发与转移风险。
综上,年龄、肿瘤直径、淋巴结状态、病理类型、雌激素受体、孕激素受体、HER2是乳腺癌患者预后独立影响因素。
【参考文献】
[1]Huh SJ,Oh H,Peterson MA,et al.The proliferative activity of mammary epithelial cells in normal tissue predicts breast cancer risk in premenopausal women[J].Cancer Res,2016,76(7):1926-1934.
[2]宫舒萍,房巧玲,刘守钦,等.济南市城乡女性乳腺癌2012-2015年发病和死亡分析[J].中华肿瘤防治杂志,2016,23(21):1403-1406.
[3]Colleoni M,Orvieto E,Nolé F,et al.Prediction of response to primary chemotherapy for operable breast cancer[J].Eur J Cancer,1999,35(4):574-579.
[4]夏重升,李苗苗,范敏,等.早期乳腺癌保乳术后瘤床同步加量调强放疗的临床观察[J].中华放射医学与防护杂志,2017,37(2):119-124.
[5]中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2011版)[J].中国癌症杂志,2011,21(5):367-417.
[6]Peele PB,Siminoff LA,Xu Y,et al.Decreased use of adjuvant breast cancer therapy in a randomized controlled trial of a decision aid with individualized risk information[J].Med Decis Making,2005,25(3):301-307.
[7]黄焰,曾敏.乳腺癌新辅助化疗再认识[J].中国肿瘤临床,2016,43(15):643-645.
[8]王清华,李志勇,姚旭,等.某医院乳腺癌术后化疗的生存分析[J].中国卫生统计,2017,34(3):497-498.
[9]钟秋子,王智,唐玉,等.乳腺癌保乳术后放化疗顺序对患者预后的影响[J].中华肿瘤杂志,2017,39(4):308-314.
[10]Maillart LM,Ivy JS,Ransom S,et al.Assessing dynamic breast cancer screening policies[J].Oper Res,2008,56(6):1411-1427.
[11]Ohta K,Kasahara Y,Tanaka F,et al.Is clinical breast examination effective in Japan? Consideration from the age-specific performance of breast cancer screening combining mammography with clinical breast examination[J].Breast Cancer,2016,23(2):183-189.
[12]吴晖,史静琤,欧阳取长,等.130例乳腺癌术后胸壁复发患者预后相关因素分析[J].中国现代医学杂志,2016,26(21):131-135.
[13]韦常宏,陈伊,宁淑芳,等.绝经后及年轻女性乳腺癌患者肿瘤分子分型及临床病理特征对比观察[J].山东医药,2016,56(43):93-95.
[14]Cook ED,Iglehart EI,Baum G,et al.Missing documentation in breast cancer survivors:genitourinary syndrome of menopause[J].Menopause,2017,24(12):1360-1364.
[15]沈晓东,潘高峰,刘维燕,等.乳腺癌临床病理特征对预后判断的价值[J].蚌埠医学院学报,2016,41(12):1642-1646.
[16]Xu F,He H,Huang W,et al.Decreased expression of MicroRNA-200 family in human breast cancer is associated with lymph node metastasis[J].Clin Transl Oncol,2016,18(3):283-288.
[17]李双,范红敏,肖菲菲,等.不同分子分型及临床病理特征与乳腺癌术后患者预后的关系[J].临床与实验病理学杂志,2016,32(1):39-44.
[18]汪洁,唐锋,包芸,等.临床和病理因素对双侧乳腺癌预后的影响[J].中国临床药理学杂志,2016,32(4):321-323.
[19]Fribbens C,O’Leary B,Kilburn L,et al.Plasma ESR1 mutations and the treatment of estrogen receptor-positive advanced breast cancer[J].J Clin Oncol,2016,34(25):2961-2968.
[20]DeMarchi T,Foekens JA,Umar A,et al.Endocrine therapy resistance in estrogen receptor (ER)-positive breast cancer[J].Drug Discov Today,2016,21(7):1181-1188.
