右心房憩室内显性旁道消融后并发心包填塞一例
2018-06-20刘晓宇郑杰李库林牛国栋王如兴
刘晓宇 郑杰 李库林 牛国栋 王如兴
患者女,38岁,因反复心悸20年加重一周于2017年4月6日入院治疗。否认有慢性疾病病史,既往多次心电图检查示B型预激。曾在外院和我院行二维标测下导管消融,但均未成功,本次入院拟行三维标测下导管消融。入院体格检查:体温36.5 ℃,脉搏65次/min,呼吸16次/min,血压125/65 mmHg。心肺腹部查体未见异常。血尿便常规、肝肾功能、凝血功能、心肌酶谱、NT-proBNP、胸片均未见异常。心电图(图1):V1、Ⅱ、Ⅲ、aVF导联δ波负向,QRS波负向;Ⅰ、aVL导联δ波正向,QRS波正向,提示旁道可能定位于三尖瓣环8点左右。
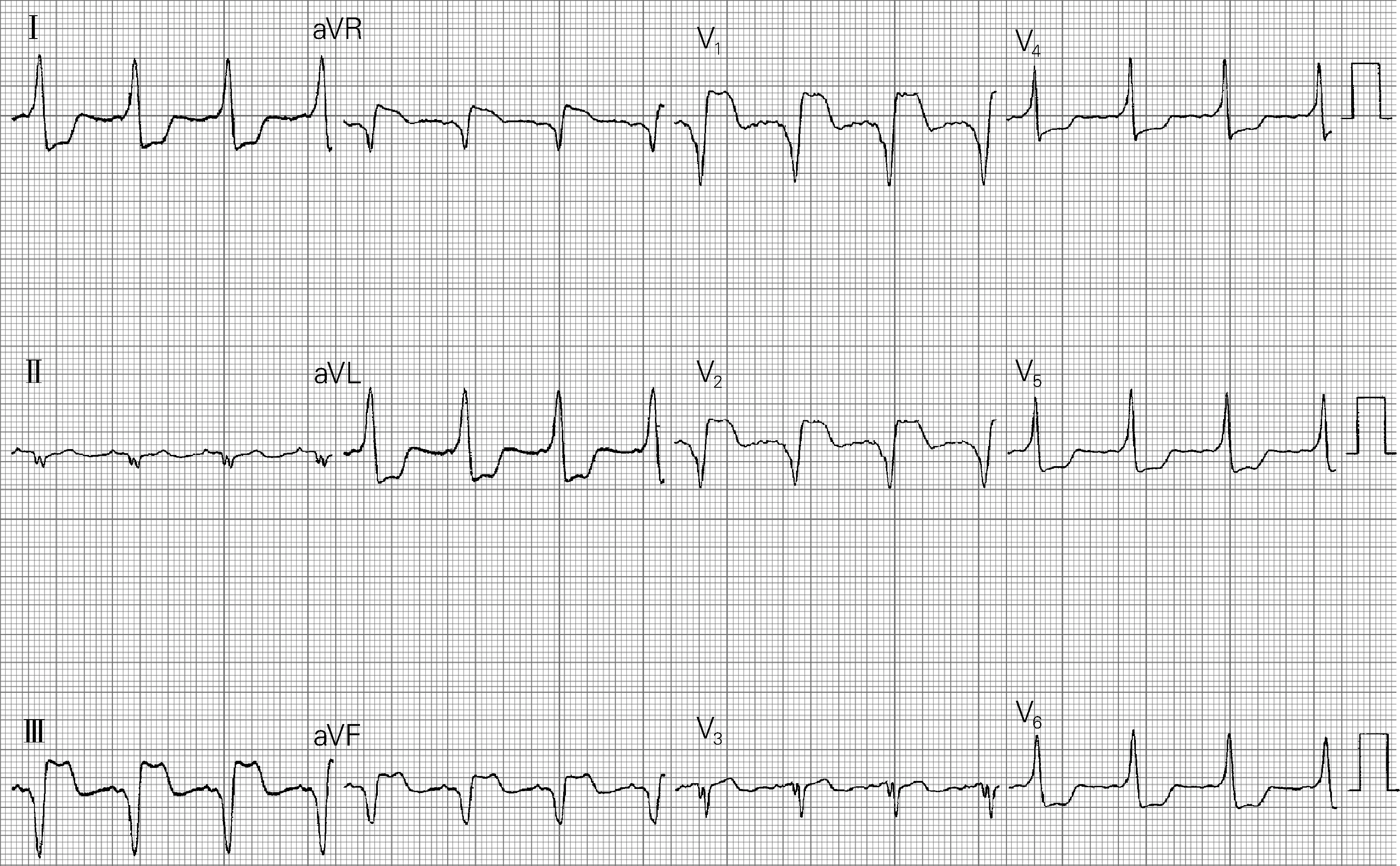
图1 患者术前12导联体表心电图
2017年4月8日在Ensite系统指导下行三维标测和导管消融术,分别穿刺右股静脉和左锁骨下静脉,放置右室电极和冠状静脉窦电极。窦性心律下腔内心电图显示,冠状静脉窦电极近端心房(A)波和心室(V)波间距较小,结合体表心电图提示右侧旁道可能性大。再次穿刺右股静脉,送入Safire消融导管(St. Jude Medical,St. Paul,MN,USA),构建右心房解剖模型。窦性心律下在三尖瓣环8点左右找到腔内心电图AV波最融合点,放电消融不成功。以心房程序刺激诱发心动过速(图2),在心动过速发作时,应用激动标测建立右心房激动顺序模型,在三尖瓣环最早逆传激动点消融也不成功。考虑旁道心房插入点可能与三尖瓣环之间有一定距离,继续应用激动标测在三尖瓣周围寻找最早逆传激动点。在导管操作过程中,导管突然落入一腔隙样结构中。在该腔隙样结构内进行标测,发现该结构从三尖瓣环心房侧向心室侧心外膜面突出,考虑为右心房憩室(图3)。在憩室内激动标测到逆传最早A波,较三尖瓣环最早A波提前10 ms,并有小的A波和V波的融合电位(图4)。在该处进行消融,5 s内心动过速终止、预激波消失(图3、图5),但功率仅能达到3~5 W,数分钟后预激波再次出现,考虑与憩室腔小、无血流冷却作用有关。换用CoolFlex盐水消融导管(St. Jude Medical,St. Paul,MN,USA),以43℃、30 W、盐水流速17 mL/min,放电消融90 s并在消融点周围巩固消融90 s。观察5 min后患者预激波未再出现,右心室起搏提示室房分离,心房和心室程序刺激不能再次诱发心动过速。为观察憩室形态,拟通过盐水灌注消融导管注射造影剂行憩室造影,但发现造影剂流入心包(图6),提示心脏穿孔。此后数分钟内,患者心率进行性增快、血压进行性下降,并很快发生阿-斯综合征,表现为神志不清、抽搐及二便失禁。立即予以心包穿刺,引流出不凝血350 mL,自体回输250 mL。当抽出不凝血约50 mL时患者神志转清,此时保留心包引流管持续引流,并送至重症监护室进一步观察治疗。术后1 d,患者无不适,心包引流管无血性液体流出,且血压和心率稳定,复查超声心动图提示心包内无积液,拔出心包引流管予以出院。术后一个月复诊,患者无心悸再发,心电图未见预激波。
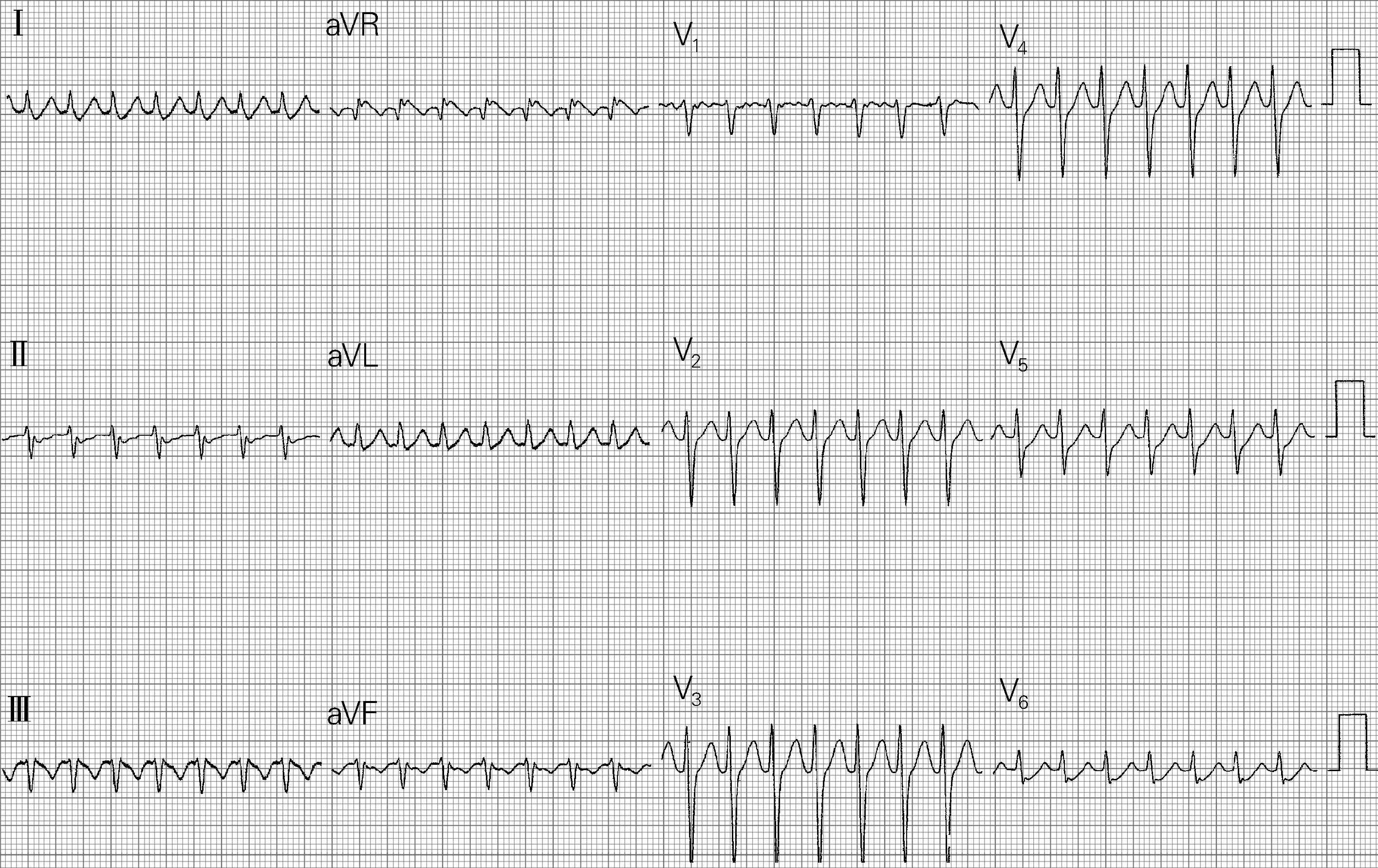
图2 患者心动过速发作时12导联体表心电图
讨论右心房憩室是一种少见的解剖结构异常[1]。目前国内尚无右心房憩室合并预激综合征的导管消融治疗并出现心包填塞报道,国外报道也较少[2-4]。本例患者有两次二维标测下消融失败病史,本次应用三维标测系统进行消融,初始在三尖瓣环附近也不能标测到满意靶点,直至最后在患者右心房异常解剖结构内标测到满意靶点并消融成功。在三维标测系统中,憩室表现为在三尖瓣环8点左右外侧,即右心房游离壁产生一突出物,并延伸到右心室的前方。从消融导管进入异常解剖结构内的过程及三维标测系统建立的解剖模型分析,该憩室考虑为右心房憩室。该憩室内径较小,导致非盐水灌注导管消融时不能达到有效消融能量,需要盐水灌注消融导管发挥足够的冷却效果,才能达到有效消融能量。尽管最后消融获得成功,但当我们拟通过造影进一步了解憩室结构时,发现在憩室消融已导致心肌穿孔。
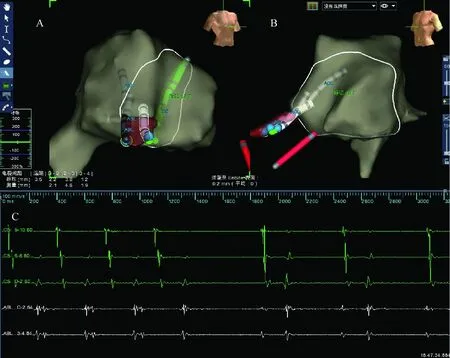
A:右心房左前斜位三维建模;B:右心房右前斜位三维建模,蓝色点和白色导管为消融

CS12:冠状窦电极远端;CS90:冠状窦电极近端;RF1:消融导管双极电图;
我们分析发生右心房憩室穿孔导致心包填塞的原因可能有如下几方面:① 憩室解剖结构异常,壁薄、腔小;② 开始我们应用非盐水导管消融,后改用盐水灌注导管消融,前后多次反复进入憩室,增加了心肌穿孔的风险;③ 使用盐水灌注消融导管尽管提高了消融成功率,但本例患者消融能量、消融时间及盐水灌注流速和普通导管消融时相同,这可能是导致患者心肌穿孔的重要原因;④ 对本例患者未应用压力导管进行消融,憩室内消融如应用压力导管,可能会减少心肌穿孔和心包填塞等严重并发症的发生。

CS:冠状窦电极;RF:消融导管;RV:右心室导管
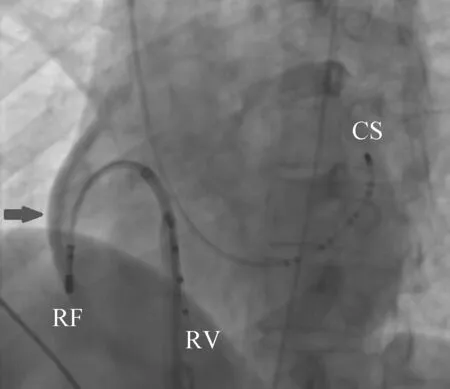
消融结束后在消融靶点造影时左前斜位影像。当造影剂由盐水灌注消融导管注入后,发现造影剂直接流入心包而并未流入右心房,提示导管前端突出心腔进入心包腔,已发生心脏穿孔。箭头指向的黑色弧形区域为造影剂。
CS:冠状窦电极;RF:消融导管;RV:右心室导管
图6造影剂进入心包图
本病例带给我们一些临床经验和教训。虽然目前预激综合征的导管消融治疗是临床上一项非常成熟的技术,但对于解剖结构异常的患者,导管消融治疗仍有较大困难,需要在三维标测系统下消融[5]。对于存在憩室的患者,导管操作务必要轻柔,消融时必须控制好温度、能量和盐水流速,应用压力消融导管或磁导航消融导管有可能减少相关并发症,从而确保手术的安全性。
本病例报道尚有不足之处,即憩室的诊断仅根据三维标测结果及消融导管进入异常解剖结构内的过程进行判断,缺少增强CT及术中完整造影结果等其他影像学证据支持,因此对于憩室的大小和形态并不十分清楚,对靶点的具体位置以及心脏穿孔发生的具体位置也难以明确。
参考文献
[1] Binder TM, Rosenhek R, Frank H, et al. Congenital malformations of the right atrium and the coronary sinus:an analysis based on 103 cases reported in the literature and two additional cases[J]. Chest, 2000, 117 (6):1740-1748.
[2] Gaita F, Haissaguerre M, Scaglione M, et al. Catheter ablation in a patient with a congenital giant right atrial diverticulum presented as Wolff-Parkinson-White syndrome[J]. Pacing Clin Electrophysiol, 1999, 22 (2):382-385.
[3] Hasdemir C, Gurgun C, Yavuzgil O, et al. Giant right atrial diverticulum associated with Wolff-Parkinson-White syndrome[J]. J Cardiovasc Electrophysiol, 2006, 17 (4):443.
[4] Chiu SN, Lin JL, Chang CC, et al. Radiofrequency ablation of a concealed right anterior accessory pathway associated with right atrial diverticulum in a child[J]. Pacing Clin Electrophysiol, 2005, 28 (1):72-74.
[5] Hocini M, Shah AJ, Cochet H, et al. Noninvasive electrocardiomapping facilitates previously failed ablation of right appendage diverticulum associated life-threatening accessory pathway[J]. J Cardiovasc Electrophysiol, 2013, 24 (5):583-585.
