miR-140-5p调控Nrf2影响结肠癌细胞5-FU耐药性
2018-06-20刘进生黄良祥李建党吴健生夏浩沄
刘进生 黄良祥 李建党 吴健生 夏浩沄
miRNAs可能参与细胞发育、增殖、分化及肿瘤发生等多种生理病理过程[1-3],被认为是结肠癌耐药的重要调节分子[4]。核因子NF-E2相关因子2(NF-E2-related factor 2,Nrf2)蛋白是一种亮氨酸拉链(leucine zipper,bZIP)蛋白,其高表达与肿瘤细胞耐药性有密切联系[5-8]。前期工作中,我们采用miRNA靶标预测数据库等预测并筛选以Nrf2为靶标的miRNA,认为miR-140-5p极可能靶向Nrf2而发挥其生物学功能。miR-140p-5p被报道与非小细胞肺癌、食管鳞癌等肿瘤发生发展密切相关[9-10]。本研究探讨miR-140-5p在结肠癌细胞5-FU耐药中的调控作用及Nrf2基因参与此过程的可能作用机制。
1 材料与方法
1.1 材料
人结肠癌细胞株SW480购于中国科学院上海细胞库。5-FU购于美国Sigmal公司;miR-140-5p的mimic、INH及其分别对照vector、NC均购于广州市锐博生物科技有限公司;兔抗Nrf2多克隆抗体、鼠抗β-actin多克隆抗体、二抗羊抗兔IgG、二抗兔抗鼠IgG购于美国Cell Signaling Technology公司;双荧光素酶报告分析试剂盒购于美国Promega公司。倒置显微镜系统购于德国Leica公司;7500Fast实时荧光定量PCR仪购于美国ABI公司;化学发光显影仪购于美国GE公司。
1.2 方法
1.2.1 细胞培养与结肠癌SW480/5-FU耐药细胞模型的构建 SW480/5-FU、SW480细胞培养于含10%FBS RPMI 1640完全培养基,置于37℃、5%CO2细胞培养箱。待细胞长至对数增长期,0.25%胰酶消化,重悬计数细胞,以0.8×105/mL细胞密度接种于96孔板中,待细胞长至汇合度为30%~40%时予不同浓度(1μmol/L、10μmol/L、50μmol/L、100μmol/L、500 μmol/L、5 000 μmol/L、10 000 μmol/L)5-FU 干预 48 h,每孔加入10 μL CCK-8,孵育2 h,采用酶标仪于450 nm处检测吸光度值。GraphPad软件计算IC50,并计算耐药指数(resistance index,RI),RI=IC50(SW480/SW480-5-FU)/IC50(SW480)。SW480/5-FU耐药细胞模型的构建方法参考文献[11]。
1.2.2 质粒构建 将WT-Nrf2-3'UTR片段和Mut-Nrf2-3'UTR片段克隆至荧光素酶报告载体(pGL4.22-luc2CP/Puro),合成WT-Nrf2-3'UTR荧光素酶报告质粒和Mut-Nrf2-3'UTR荧光素酶报告质粒。将WT-Nrf2片段和Mut-Nrf2片段克隆至pcDNA3.1质粒,构建WT-Nrf2质粒和Mut-Nrf2质粒。上述质粒均通过一代测序验证后进行大抽,用于后续实验。
1.2.3 细胞转染 SW480/5-FU、SW480细胞以4×105/mL细胞密度接种到6孔板,待细胞长至汇合度达70%~80%时转染。CCK-8、细胞集落形成实验检测细胞5-FU耐药性实验和qRT-PCR、Westernblot中,将SW480/5-FU细胞分为2组,分别转染25 pmol miR-140-5p mimic(mimic)和 25 pmol mimic 的模拟物 miR-140-5p vector(vector);将SW480细胞分为2组,分别转染25 pmol miR-140-5p inhibitor(INH)和 25 pmol INH 的模拟物miR-140-5p NC(NC)。在荧光素酶报告基因检测实验中,将SW480/5-FU细胞分为4组,分别转染25pmol mimic+20 ng WT-Nrf2-3'UTR质粒、25 pmol vector+20 ng WT-Nrf2-3'UTR质粒、25 pmol mimic+20 ng Mut-Nrf2-3'UTR质粒、25 pmol vector+20 ng Mut-Nrf2-3'UTR质粒;将SW480细胞分为4组,分别转染25 pmol INH+20 ng WT-Nrf2-3'UTR质粒、25 pmol NC+20 ng WT-Nrf-3'UTR质粒、25 pmol INH+20 ng Mut-Nrf2-3'UTR质粒、25 pmol NC+20 ng Mut-Nrf2-3'UTR质粒;以表达海肾荧光素酶的质粒作为内参照,转染48 h后检测。CCK-8和细胞集落形成实验检测Nrf2对miR-140-5p调控SW480/5-FU细胞5-FU敏感性实验中,将SW480/5-FU细胞分为4组,分别转染25 pmol mimic+20 ng WT-Nrf2质粒、25 pmol vector+20 ng WTNrf2质粒、25 pmol mimic+20 ng Mut-Nrf2质粒、25 pmol vector+20 ng Mut-Nrf2质粒;将SW480细胞分为4组,分别转染25 pmol INH+20 ng WT-Nrf2质粒、25 pmol NC+20 ng WT-Nrf2质粒、25 pmol INH+20 ng Mut-Nrf2质粒、25 pmol NC+20 ng Mut-Nrf2质粒;以表达海肾荧光素酶的质粒作为内参照。
1.2.4 CCK-8法检测细胞活力 细胞接种于96孔板干预后,每孔加入10 μL CCK-8溶液,继续培养2 h,用酶标仪在450 nm波长处检测各孔吸光度值,并计算各组细胞活力。
1.2.5 细胞集落形成实验 将上述干预后的细胞消化,按照500个细胞/孔重新接种于12孔板中,置于细胞培养箱中培养,隔天换液,待细胞长至肉眼看见集落,弃上清液,PBS清洗,4%多聚甲醛固定细胞20 min,结晶紫染色液染色15 min,PBS清洗后拍照并观察集落形成情况。
1.2.6 qRT-PCR法检测相关基因的表达水平 将上述干预后的细胞裂解并抽提miRNA,抽提总RNA,紫外线分光光度仪测定RNA的浓度和纯度。miR-140-5p表达检测参考试剂盒说明说书进行操作,以U6作为内参,miR-140-5p的逆转录引物序列:5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCTACCATA-3',上游引物序列:5'-GAGTGTCAGTGGTTTTACCCT-3',下游引物序列:5'-GCAGGGTCCGAGGTATTC-3';取 2 μg RNA 逆转录成 cDNA,按照每20 μL PCR反应体系中含有2 μg cDNA进行PCR反应,条件:95 ℃ 10 s,60 ℃ 20 s,循环 40次;72 ℃60 s。Nrf2表达检测:以GAPDH为内参,Nrf2上游引物序列:5'-CTTGGCCTGAGTGATTCTGAAGTG-3',下游引物序列:5'-CCGAGATGGTGACAAGGGTTGTA-3';取1 μg RNA逆转录成cDNA,PCR反应体系同上,条件:95 ℃ 10 min;95 ℃ 5 s,60 ℃ 30 s,循环 40 次;72℃ 60 s。收集各孔循环阈值(Ct值)。所得的结果按照2-ΔΔCt相对定量法计算目的基因的相对表达量。每个样品设置3个复孔,3次实验取均值。
1.2.7 Western blot法检测相关蛋白的表达水平 裂解细胞,获取细胞总蛋白,BCA法检测蛋白浓度,取30 μg样品调整统一上样体积。用10%SDS-PAGE凝胶电泳分离蛋白样品并转印至PVDF膜上,电泳条件:80 V 30 min,120 V 1.5 h;转膜条件:90 V 1.5 h。TBST(含吐温的Tris-HCL缓冲液)洗涤后5% 脱脂牛奶室温封闭1 h,再次TBST洗涤;兔抗小鼠Nrf2多克隆抗体(1:1 000)4℃孵育过夜。TBST洗涤后用羊抗兔IgG二抗(1:1 000)室温孵育1 h,电化学发光显影液将膜孵匀,荧光成像系统进行化学发光成像,保存图片数据。
1.2.8 预测并筛选可能以Nrf2为靶标的miRNA 通过NCBI数据库搜寻Nrf2转录本3'UTR序列,采用miRNA靶标预测数据库 TargetScan(http://www.targetscan.org/)、PicTar(http://pictar.mdc-berlin.de/cgibin/PicTar_vertebrate.cgi)和 microRNA.org(http://www.microrna.org/microrna/home.do)预测Nrf2 3'UTR可能的miRNA和结合位点。通过PubMed检索上述数据库预测出的有关miRNA在肿瘤发生发展中的研究,确定本研究感兴趣的靶基因。
1.2.9 荧光素酶报告基因检测 参照说明书操作。裂解细胞20 min,移出10 μL于96孔荧光检测板内,加入35 μL LARII工作液迅速混匀,于多功能酶标仪中读取萤火虫萤光素酶激发荧光强度F值;取出检测板加入35 μL Stop&Glo工作液混匀,读取海肾萤光素酶激发荧光强度R值。根据公式计算相对荧光素酶活性:相对荧光酶活性=F值/R值。
1.3 统计学方法
采用SPSS 17.0软件进行统计分析。多组数据间比较使用单因素方差分析,两组数据之间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 SW480/5-FU耐药细胞模型的5-FU耐药性验证
细胞的5-FU耐药性验证结果显示,5-FU能明显抑制 SW480细胞活力,其 IC50为 45.8 μmol/L;与SW480相比,SW480/5-FU对5-FU的敏感性显著降低,在100 μmol/L浓度以内的5-FU干预下,SW480/5-FU细胞活力无明显影响,其IC50为499.3 μmol/L(图1)。基于上述结果计算,SW480/5-FU的耐药指数为 10.9(RI>1.5),说明本实验所构建的 SW480/5-FU细胞模型具有较高的耐药性。
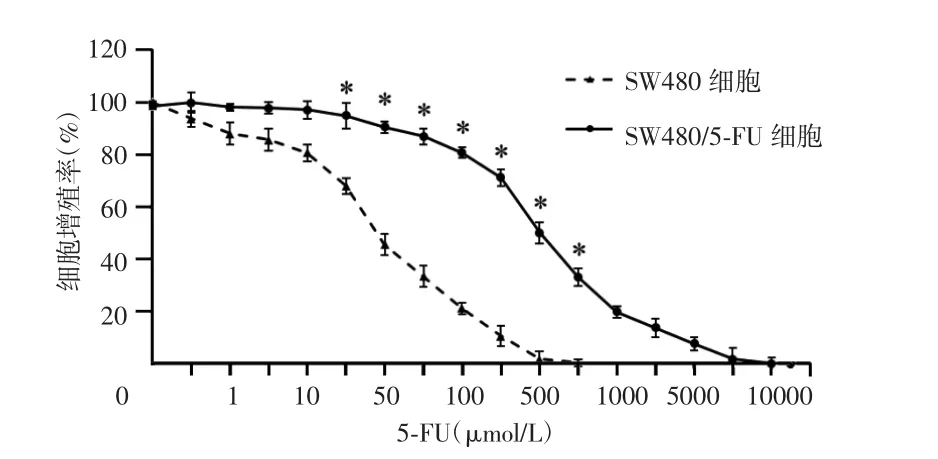
图1 CCK-8法检测5-FU对SW480细胞、SW480/5-FU细胞5-FU敏感性的影响
2.2 miR-140-5p在SW480细胞和SW480/5-FU细胞中的表达
qRT-PCR结果显示,SW480/5-FU细胞中miR-140-5p表达水平为SW480细胞的0.7倍(P<0.05)。提示miR-140-5p表达水平可能与结肠癌5-FU耐药有关。
2.3 miR-140-5p调控SW480/5-FU细胞和SW480细胞对5-FU的敏感性
CCK-8检测结果显示,与转染miR-140-5p vector的对照组比较,转染miR-140-5p mimic可降低不同浓度5-FU干预48 h后SW480/5-FU的细胞活力,并明显抑制300 μmol/L 5-FU干预下SW480/5-FU细胞的增殖能力(图2A)。在SW480细胞中,与转染miR-140-5p NC的对照组相比,转染miR-140-5p INH能增加SW480细胞不同浓度5-FU干预48 h后的细胞活力(图2B)。此外,细胞集落实验结果发现,与转染miR-140-5p vector的对照组相比,转染miR-140-5p mimic能减少SW480/5-FU细胞的集落形成能力(P<0.05)(图2C)。
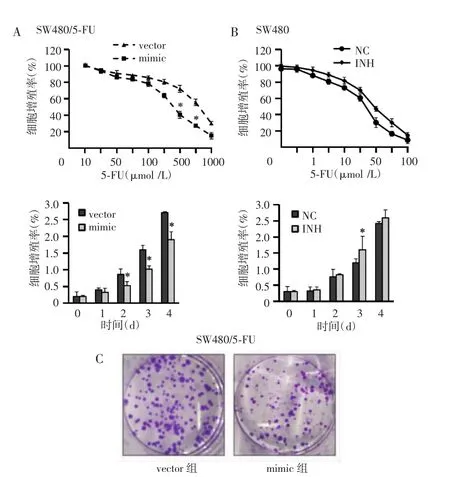
图2 CCK-8法检测过表达miR-140-5p对SW480/5-FU细胞、SW480细胞5-FU敏感性的影响
2.4 miR-140-5p可直接结合并抑制Nrf2表达
通过对公共数据库进行挖掘,推测miR-140-5p能结合于Nrf2的3'UTR(WT-3'UTR)第347-354个碱基对,提示Nrf2可能是miR-140-5p的靶基因(图3A)。实验结果表明,在SW480/5-FU细胞中,与转染miR-140-5p vector的对照组比较,转染miR-140-5p mimic能显著抑制Nrf2的 mRNA及蛋白的表达(P<0.05,图3B);在SW480细胞中,与转染miR-140-5p NC的对照组相比,转染miR-140-5p INH能上调Nrf2 mRNA及蛋白的表达水平(P<0.05,图3C)。进一步将Nrf2的3'UTR与miR-140-5p结合的位点设计突变(Mut-3'UTR),使其失去与miR-140-5p结合的能力(图3 A),并构建了带有野生型Nrf2 3'UTR的WT-Nrf2-3'UTR荧光素酶报告质粒(WT-Nrf-3'UTR质粒)和带有Nrf2 3'UTR突变的Mut-Nrf2-3'UTR荧光素酶报告质粒(Mut-Nrf-3'UTR质粒),用于荧光素酶报告基因检测。检测结果显示,在SW480/5-FU细胞中,与共转染miR-140-5p vector的对照组相比,共转染miR-140-5p mimic能显著下调WT-Nrf2-3'UTR的相对荧光素酶活性(P<0.05),而对Mut-Nrf2-3'UTR的荧光素酶活性无明显影响(P>0.05,图 3D);在 SW480细胞中,与共转染miR-140-5p NC的对照组相比,共转染miR-140-5p INH能显著下调WT-Nrf2-3'UTR的相对荧光素酶活性(P<0.05),而对Mut-Nrf2-3'UTR的荧光素酶活性无明显影响(P>0.05,图3E)。以上结果共同说明,miR-140-5p可通过与Nrf2的3'UTR结合,下调Nrf2表达。
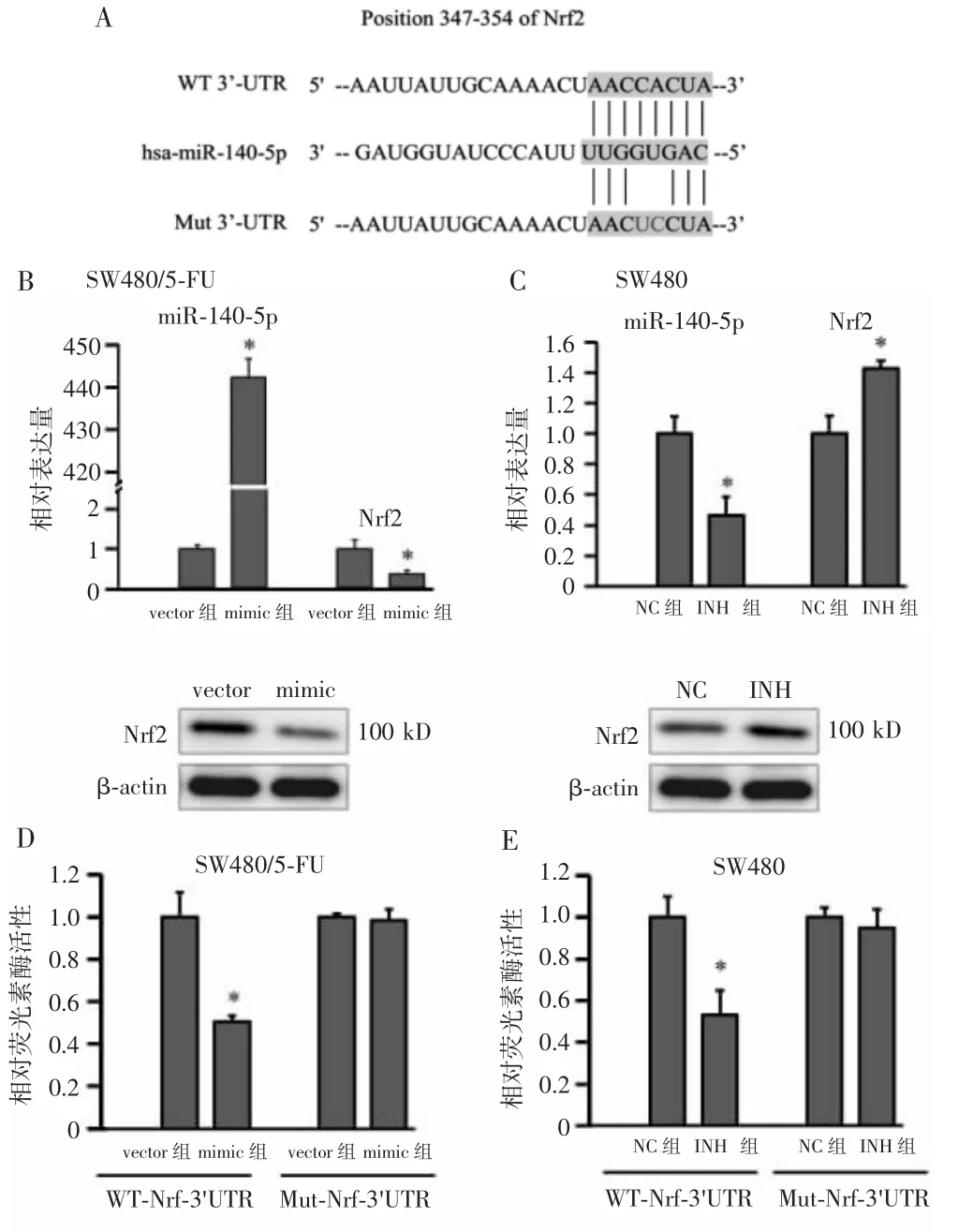
图3 miR-140-5p与Nrf2的关系
2.5 Nrf2参与miR-140-5p调控SW480/5-FU细胞对5-FU的敏感性
与共转染vector和WT-Nrf2相比,SW480/5-FU细胞共转染mimic和WT-Nrf2的细胞增殖能力明显下降(P<0.05),提示 miR-140-5p能抑制 Nrf2过表达所导致的SW480/5-FU细胞对5-FU较强的耐药性(图4A)。细胞集落形成实验结果表明,过表达WT-Nrf2使SW480/5-FU细胞的集落形成能力明显增强,且能逆转miR-140-5p mimic干预下SW480-5FU细胞的5-FU敏感性(图4B)。

图4 miR-140-5p通过调控Nrf2影响SW480/5-FU细胞的5-FU敏感性
3 讨论
耐药一直是结直肠癌临床治疗面临的棘手问题,从miRNAs中寻求其耐药靶点成为目前结直肠癌耐药性研究的热点。我们前期研究通过公共数据库的数据挖掘,推测miR-140-5p可能与肿瘤耐药性相关基因Nrf2结合,可能参与肿瘤耐药调控机制。为进一步探究miR-140-5p在结肠癌耐药研究中的潜在价值,本研究通过构建人结肠癌细胞株SW480的5-FU稳定耐药细胞株SW480/5-FU,并验证了miR-140-5p在耐药细胞SW480/5-FU中高表达,提示miR-140-5p可能参与调控结肠癌5-FU耐药。本研究还发现miR-140-5p能显著增加耐药细胞株SW480/5-FU对5-FU的敏感性,提示miR-140-5p可能在抑制细胞对5-FU的耐药中有重要作用。
miR-140-5p已被证实与结直肠癌生长、侵袭及预后有关[12-14]。以往研究更多将Nrf2视为细胞氧化应激反应过程中的关键因子,可通过调控抗氧化相关蛋白,抑制损伤和炎症中氧化应激损伤发生[15]。近年研究发现,Nrf2基因激活可能促进新的癌变发生,且Nrf2能通过调节肿瘤微环境调控肿瘤对化疗药物的耐药性[5-6,15]。因此,抑制肿瘤细胞中 Nrf2的表达是克服肿瘤细胞耐药的重要策略。为进一步分析miR-140-5p对结肠癌细胞5-FU耐药性的调控是否与其结合Nrf2的互作作用有关,本研究首先通过双荧光素酶报告基因和Western blot实验进行验证,结果发现miR-140-5p可与Nrf2结合,并抑制耐药基因Nrf2表达;进一步探究miR-140-5p调控结肠癌细胞耐药性与miR-140-5p结合并抑制Nrf2之间的相关性,发现Nrf2可影响miR-140-5p对SW480/5-FU细胞的5-FU敏感性,即miR-140-5p能通过调控Nrf2表达影响SW480/5-FU细胞对5-FU的敏感性,进一步研究miR-140-5p靶向抑制Nrf2功能而在结肠癌细胞耐药性中的作用提供依据,有关方面值得深入探讨。
综上,本研究发现miR-140-5p可通过靶向抑制Nrf2表达而降低结肠癌细胞对5-FU的耐药性,为防治结直肠癌耐药提供了新方向,miR-140-5p有望成为逆转结直肠癌耐药的靶点。
[1] Li ZH,Rana TM.Therapeutic targeting of microRNAs:current status and futurechallenges[J].Nat RevDrugDiscov,2014,13(8):622-638.
[2] Rupaimoole R,Slack FJ.MicroRNA therapeutics:towards a new era for the management of cancer and other diseases[J].Nat Rev Drug Discov,2017,16(3):203-222.
[3] van Beijnum JR,Giovannetti E,Poel D,et al.miRNAs:micro-managers of anticancer combination therapies[J].Angiogenesis,2017.
[4] 谢学成,邱海,覃宇周.microRNAs与结直肠癌[J].中国癌症防治杂志,2014,6(3):310-314.
[5] Jeddi F,Soozangar N,Sadeghi MR,et al.Contradictory roles of Nrf2/Keap1 signaling pathway in cancer prevention/promotion and chemoresistance[J].DNA Repair(Amst),2017,54:13-21.
[6] Penning TM.Aldo-Keto reductase regulation by the Nrf2 system:implications for stress response,chemotherapy drug resistance,and carcinogenesis[J].Chem Res Toxicol,2017,30(1):162-176.
[7] Ryoo IG,Lee SH,Kwak MK.Redox modulating NRF2:a potential mediator of cancer stem cell resistance[J].Oxid Med Cell Longev,2016:2428153.
[8] Samatiwat P,Prawan A,Senggunprai L,et al.Nrf2 inhibition sensitizes cholangiocarcinoma cells to cytotoxic and antiproliferative activities of chemotherapeutic agents[J].Tumour Biol,2016,37(8):11495-11507.
[9] Flamini Valentina,Jiang Wen G,Cui Yuxin.Therapeutic Role of MiR-140-5p for the treatment of non-small cell Lung cancer[J].Anticancer Res,2017,37(8):4319-4327.
[10] Zhao Ke,Chen Bao-Jun,Chen Zhi-Guo.ErbB4 as a potential molecular target in the treatment of esophageal squamous cell cancers[J].Scientific World Journal,2014,124105.
[11]胡万乐,何占红,蒋芳,等.5-Fu诱导人大肠癌SW480细胞株耐药与自噬活性的变化[J].中国中西医结合外科杂志,2013,19(3):279-282.
[12] Mosakhani N,Lahti L,Borze I,et al.MicroRNA profiling predicts survival in anti-EGFR treated chemorefractory metastatic colorectal cancer patients with wild-type KRAS and BRAF[J].Cancer Genet,2012,205(11):545-551.
[13] Zhai H,Fesler A,Ba Y,et al.Inhibition of colorectal cancer stem cell survival and invasive potential by hsa-miR-140-5p mediated suppression of Smad2 and autophagy[J].Oncotarge,2015,6(23):19735-19746.
[14] Zhang W,Zou C,Pan L,et al.MicroRNA-140-5p inhibits the progression of colorectal cancer by targeting VEGFA[J].Cell Physiol Biochem,2015,37(3):1123-1133.
[15] DeNicola GM,Karreth FA,Humpton TJ,et al.Oncogene-induced Nrf2 transcription promotes ROS detoxification and tumorigenesis[J].Nature,2011,475(7354):106-109.
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
