GHR基因单核苷酸多态性与广西肝癌家系遗传易感性的研究
2018-06-20蒋群湘魏斐斐王洪学郭辉谢裕安
蒋群湘 魏斐斐 王洪学 郭辉 谢裕安
广西地区2013年恶性肿瘤登记资料统计分析显示,肝癌发病率和病死率在广西地区均居第二位[1]。个体基因遗传多态性在肝癌发病中起重要作用,部分研究显示肝癌发病存在显著家系聚集性倾向[2-4]。单核苷酸多态性(single nucleotide polymorphism,SNP)是肝癌遗传易感性研究的基础条件,同时可解释遗传易感性在个体中的差异性[5-7]。生长激素受体(growth hormone receptor,GHR)与肝癌[8]、结直肠癌[9]等恶性肿瘤有关。但目前关于GHR SNP与肝癌遗传易感性的研究较少。本研究以广西扶绥县25个肝癌家系和17个健康对照家系为研究对象,分析GHR基因位点多态性与肝癌遗传易感性的关系,以期为肝癌发生机制研究、诊断及预防提供参考。
1 材料与方法
1.1研究对象
本研究对象均选自长期生活在广西扶绥县的人群,包括25个肝癌家系和17个健康对照家系,其中肝癌家系中肝癌患者25例(肝癌家系肝癌组)、肝癌患者直系亲属但非肝癌者81名(肝癌家系非肝癌组)。所有肝癌患者均于广西医科大学附属肿瘤医院行外科手术治疗,术后经病理学检查确诊为肝细胞癌,肝癌家系非肝癌组成员均经病史采集显示其直系亲属中至少1人确诊为肝细胞癌。肝癌家系中男性 61例,女性 45例,平均年龄(44.55±15.41)岁;饮酒(≥100 g/d)20例,不饮酒(<100 g/d)86例;吸烟(≥10支/d)25例,不吸烟(<10支/d)81例;HBsAg(+)55例,HBsAg(-)51例;AFP(+)14例(均肝癌患者),AFP(-)92 例。
健康对照家系入选80名(对照组),均为与肝癌家系居住在同一个村或生活环境相似的邻近村,且与肝癌家系无血缘关系,健康体检结果正常者,均无肿瘤病史、肝炎病史及遗传病史。其中男性50名,女性30名,平均年龄(45.90±18.38)岁:饮酒(≥100 g/d)25名,不饮酒(<100 g/d)55名;吸烟(≥10支/d)30名,不吸烟(<10支/d)50名。抽取肝癌家系非肝癌组及对照组成员晨起空腹静脉血液5 mL。本研究按国家人类基因组研究伦理学准则进行,研究对象均知情同意。
1.2 方法
1.2.1 主要试剂及仪器 血液、组织基因组DNA提取试剂盒(含离心柱型)购于北京天根生物公司;单碱基延伸引物、PCR扩增引物由深圳华大基因公司合成;PCR仪购自美国ABI公司;MassARRAY Analyzer Compact质谱系统等购自美国Sequenom公司。
1.2.2 SNP功能位点筛选 利用国际人类基因组单体型图计划数据库(http://hapmap.ncbi.nlm.nih.gov/)下载GHR基因的所有SNPs基因分型数据。经SNPs功能预测网站挑选GHR基因功能位点rs6451620作为本研究的靶向位点。
1.2.3 SNP分型 依据引物延伸反应产物质谱峰的位置确定其分子质量。1种颜色可对应2个或3个峰值,1个等位基因峰表示该点位纯合子,2个等位基因峰表示该位点杂合子。
1.2.4 样本DNA提取 采用血液/组织DNA提取试剂盒,对25例手术切除肝癌组织样本、81名肝癌患者直系亲属及80名对照家系人群静脉血样本提取DNA,经分光光度计定量,DNA纯度合格标准为OD值为1.7~2.1,将质检合格的DNA样本置于-20℃冰箱保存备用。
1.3 GHR基因检测
1.3.1 引物设计及合成引物设计 采用美国Sequenom公司AssayDesigner3.1software设计引物,每个SNP位点对应1条延伸引物和2条PCR扩增引物。PCR上游引物5'-ACGTTGGATGGTATGCCTTAAGATTGGGTG-3',下游引物5'-ACGTTGGATGCCTCTTTCACTTAGAAACAG-3',延伸引物 5'-gTTACCAGAGAAGCAGTT-3',引物均由深圳华大基因公司合成。
1.3.2DNA样本SNP的基因分型 PCR扩增DNA样本目的基因并纯化,采用美国Sequenom公司的MassARRAY时间飞行质谱技术检测,分析实验结果。
1.4 统计学方法
采用SPSS 17.0软件对数据进行分析。以χ2检验比较两组性别、年龄、基因型和等位基因分布频率的差异。采用拟合优度χ2检验进行样本基因型分布的Hardy-Weinberg遗传平衡检验。非条件logistic回归法计算比值比(OR)和95%可信区间(CI)。以P<0.05为差异有统计学意义。
2 结果
2.1 基因型检测结果
186例DNA样本基因分型检测结果显示,GHR基因rs6451620位点存在AA、GA、GG 3种基因型(图1),其中AA基因型22例,GA基因型85例,GG基因型79例。
2.2 Hardy-Weinberg遗传平衡检验
采用Hardy-Weinberg遗传平衡检验GHR基因型rs6451620位点的基因型频率,结果显示,基因型频率期望值与观察值差异无统计学意义(P>0.05),GHR基因rs6451620位点基因型频率符合Hardy-Weinberg遗传平衡,具有人群代表性,见表1。

图1 GHR基因型rs6451620位点SNP基因分型
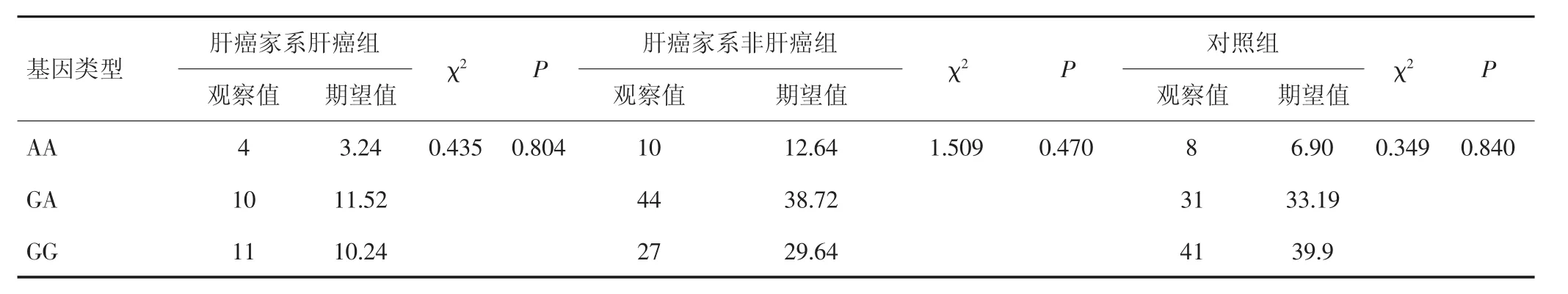
表1 GHR基因rs6451620位点基因型Hardy-Weinberg遗传平衡检验
2.3 GHR基因rs6451620位点基因多态性与广西肝癌家系遗传易性的关系
GHR基因rs6451620位点等位基因G和A在肝癌家系肝癌组中分布频率分别为64%和36%,肝癌家系非肝癌组为60.5%和39.5%,对照组为70.6%和29.4%。采用非条件logistic回归校正性别、年龄、吸烟、饮酒等条件后,以肝癌家系肝癌组和非肝癌组人群为研究对象时,携带A等位基因型的个体发生肝癌的风险是G等位基因型个体的0.81倍(95%CI:0.27~2.41,P=0.699),携带AA基因型的个体发生肝癌的风险是携带GG基因型个体的 0.63倍(95%CI:0.14~2.87,P=0.547)。以肝癌家系肝癌组和健康对照人群为研究对象时,携带A等位基因型个体发生肝癌的风险是G等位基因型个体的 1.49 倍(95%CI:0.73~3.04,P=0.274),携带基因型AA的个体发生肝癌的风险是GG基因型个体的 0.91 倍(95%CI:0.32~2.62,P=0.860)。见表2。
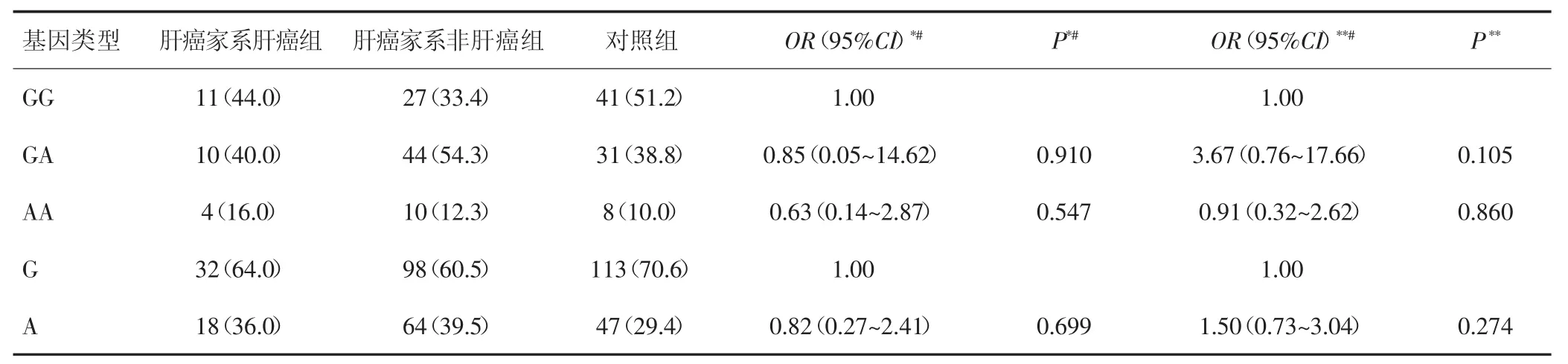
表2 GHR基因rs6451620位点基因型及等位基因与广西肝癌家系遗传易感性的关系
3 讨论
恶性肿瘤发病是多因素、多阶段的过程,研究显示在相同外界环境下,仅小部分个体罹患肝癌,提示个体间存在某种差异,可能在肝癌发病中发挥重要作用。本课题组前期研究发现PLXNC1基因rs2272335位点等位基因C、ITGβ1基因rs2298141位点等与原发性肝癌发病有关[10-11]。研究发现肺癌、肝癌、乳腺癌等患者中均有GHR表达,且与肿瘤瘤体大小、分化程度及临床分期密切相关[12]。GHR表达亦与结肠癌[13]、甲状腺癌[14]等恶性肿瘤发病风险增加有关。基于上述研究背景,且目前尚未有GHR基因rs6451620位点与肝癌的相关报道,本研究通过查找HapMap数据库并利用SNPs功能预测网站分析和预测,发现GHR基因rs6451620位点可能与肝癌遗传易感性相关,将其作为本研究的靶基因位点。
肝癌分布具有地域性,广西扶绥县是肝癌高发地区,本研究选取长期生活在广西扶绥县的25个肝癌家系和17个健康对照家系人群,经Hardy-Weinberg平衡定律检验基因型频率符合遗传平衡,提示研究对象具有人群代表性。进一步观察人群中GHR基因rs6451620位点多态性,当以肝癌家系肝癌和非肝癌人群为研究对象时,携带A等位基因的个体罹患肝癌的风险是携带G等位基因个体的0.81倍,携带AA基因型的个体罹患肝癌的风险是携带GG基因型个体的0.63倍,但差异无统计学意义;以肝癌家系肝癌和健康对照人群为研究对象时,携带A等位基因的个体罹患肝癌的风险是携带G等位基因个体的1.49倍,但差异无统计学意义。可见G、A等位基因及AA、GA、GG 3个基因型在肝癌家系非肝癌组和对照组人群中的分布没有明显差异,提示GHR基因rs6451620位点单核苷酸多态性可能与广西扶绥县肝癌遗传易感性无明显相关性。但本研究选取的样本均来自我国肝癌高发地区广西扶绥县的家系人群,种群差异性小、地域局限,且样本量较少,可能导致病例选择偏倚,有关结论仍需进一步研究。
[1] 余家华,李秋林,容敏华,等.2013年广西肿瘤登记地区恶性肿瘤发病和死亡分析[J].中国癌症防治杂志,2017,9(1):30-39.
[2] Gao Y,Jiang Q,Zhou X,et al.HBV infection and familial aggregation of liver cancer:an analysis of case-control family study[J].Cancer Causes Control,2004,15(8):845-850.
[3]张存圳,程玉强,郭卫星,等.肝癌家族聚集性发病的分子遗传学研究进展[J].中国细胞生物学学报,2014,36(7):994-997.
[4] Turati F,Edefonti V,Talamini R,et al.Family history of liver cancer and hepatocellular carcinoma[J].Hepatology,2012,55(5):1416-1425.
[5]房克华,常晓天.单核苷酸多态性与肿瘤遗传易感性的研究进展[J].中华肿瘤防治杂志,2011,18(2):151-155.
[6] Bohanes P,Yang D,Loupakis F,et al.Integrin genetic variants and stage-specific tumor recurrence in patients with stage II and III colon cancer[J].Pharmacogenomics J,2015,15(3):226-234.
[7] Barkan D,Chambers AF.beta1-integrin:a potential therapeutic target in the battle against cancer recurrence[J].Clin Cancer Res,2011,17(23):7219-7223.
[8] Liu JP,Wang HT,Ou QJ,et al.Expression of growth hormone receptor in hepatocellular carcinoma and its significance[J].Ai Zheng,2003,22(3):298-301.
[9] Wu X,Liu F,Yao X,et al.Growth hormone receptor expression is upregulated during tumorigenesis of human colorectal cancer[J].J Surg Res,2007,143(2):294-299.
[10]何承诚,谢裕安,毛赛兰,等.PLXNC1多态性与广西肝癌遗传易感的关系及其表达[J].中国肿瘤临床,2015,42(13):642-647.
[11]魏斐斐,廖燕,赵瑞强,等.广西扶绥县壮族人群ITGβ1基因多态性与肝癌家系遗传易感性的关系[J].中国癌症防治杂志,2016,8(5):273-277.
[12]刘亮,郑晓梅,王斌,等.GHR在颅咽管瘤患者中的表达及临床意义[J].实用医学杂志,2012,28(18):3039-3041.
[13]Renehan AG,Brennan BM.Acromegaly,growth hormone and cancer risk[J].Best Pract Res Clin Endocrinol Metab,2008,22(4):639-657.
[14] Dagdelen S,Cinar N,Erbas T.Increased thyroid cancer risk in acromegaly[J].Pituitary,2014,17(4):299-306.
