卵巢硬化性间质瘤10例临床病理分析
2018-06-20李海梅余金霞杨海军
李海梅 余金霞 杨海军
卵巢硬化性间质瘤(sclerosing stromal tumor of ovary,SST)是一种起源于卵巢性索-间质的良性肿瘤,发病率低。由于临床表现不典型,免疫组化标记与其他卵巢肿瘤有交叉,在临床工作中存在一定误诊率。本文回顾性分析10例SST患者的临床病理特征、免疫组化染色结果、诊断及鉴别诊断,并结合文献综合分析,以提高对该病的认识。
1 资料与方法
1.1 一般资料
收集2007年1月至2016年10月我院收治的10例SST患者的临床及病理资料,均经病理学明确诊断,所有切片经2位高年资病理诊断医师重新阅片、复核。
1.2 免疫组化染色判定方法
手术切除标本经4%中性甲醛缓冲液固定,常规脱水,石蜡包埋,4 μm厚切片,行HE染色。Vimentin、inhibin、Desmin、CR、SMA、AE1/AE3、EMA 阳性物质蛋白定位于细胞质或细胞核,随机选取10个高倍视野,记录1 000个细胞,计算阳性细胞百分数,按照细胞染色强度和阳性细胞百分比判断结果[1]。阳性细胞百分比判断标准:1%~25%为0分、26%~49%为 1分、50%~75%为2分、76%~100%为3分;染色强度按着色细胞判断:无阳性染色、淡黄色、棕黄色、棕褐色依次计为0分、1分、2分和3分,以两者评分相加的最后分值作为判定标准:0~2分为阴性(-),3~6分为阳性(+)。Ki-67阳性物质蛋白主要定位于细胞核,选取染色最强的区域阳性百分数为最后的判定结果。
2 结果
2.1 临床特点
10例患者平均年龄48.7岁(17~78岁)。肿瘤均为单侧,其中右侧8例,左侧2例。临床主要表现有下腹胀痛、酸痛、月经缩短、绝经后阴道出血及尿频,体检发现盆腔肿物1例,有卵巢囊肿切除病史1例。子宫平滑肌瘤和子宫内膜异位1例,手术后偶然发现卵巢SST。其他临床资料见表1。
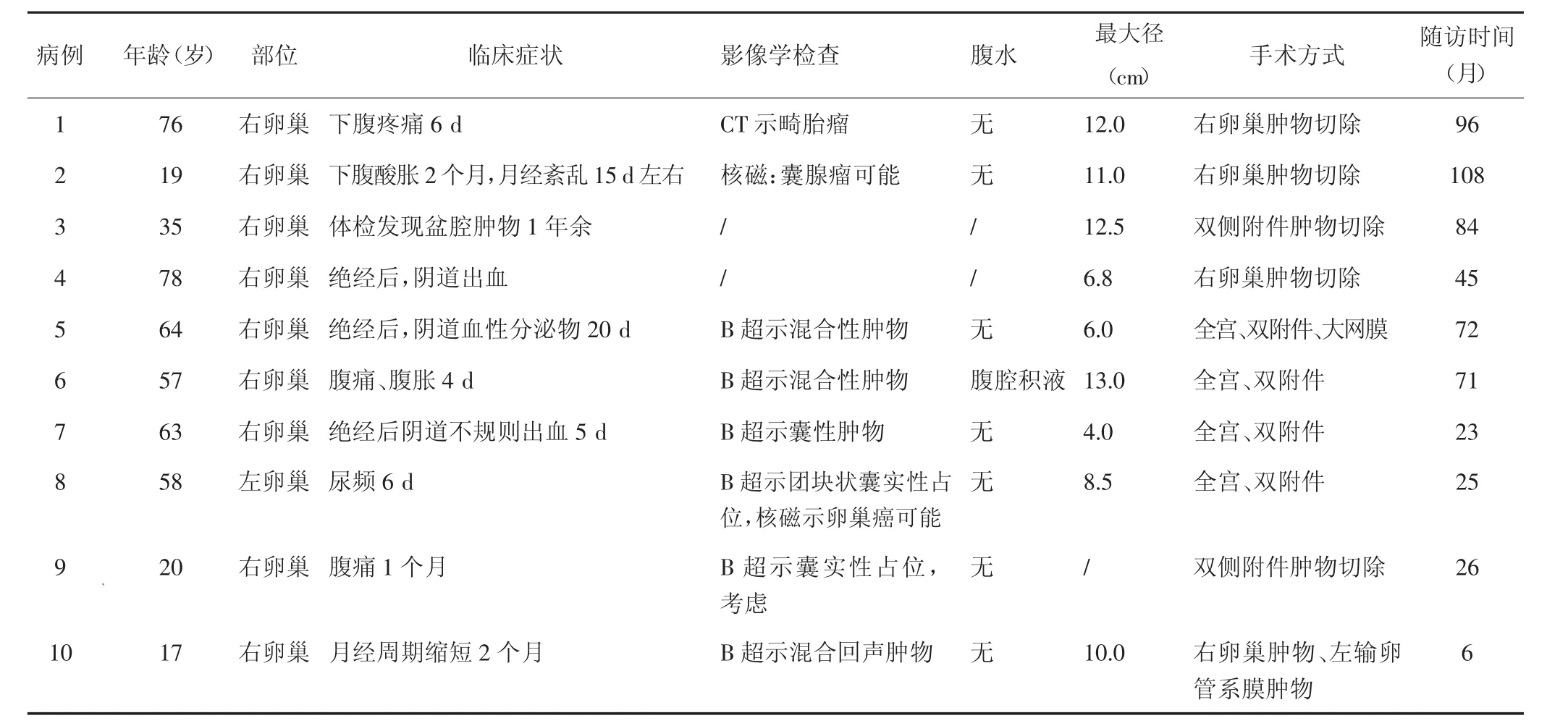
表1 10例SST患者的临床资料
2.2 眼观
10例患者的肿瘤直径范围为3.9~13.0 cm,呈圆形、椭圆形,表面光滑,切面呈囊实性,灰白灰黄色相间,质韧;呈多房囊性6例,单房囊性2例,囊壁厚1.0~3.5 cm,囊内壁大部分光滑,囊内含淡黄色液体,部分略浑浊。2例送检肿物为灰白色破碎囊壁样组织,壁厚0.8~2.5 cm,外侧面光滑,内侧面稍粗糙,质韧。
2.3 镜检
肿瘤在低倍镜下呈典型假小叶结构,假小叶内由富细胞区组成,肿瘤细胞大小不一,形态多样,以圆、椭圆、多角形为主,夹杂梭形细胞;细胞核呈圆形、卵圆形、肾形,居中或偏位,染色质细、淡然,核分裂相少见。可见上皮样细胞及印戒样细胞,小叶间为致密的胶原纤维构成的致密区及由疏松水肿、黏液变性的胶原纤维形成的疏松水肿区,与假小叶相间分布(图1A)。在小叶内及小叶间见较多薄壁血管(图1B),其中伴钙化2例。

图1 SST的镜检结果(HE染色)
2.4 免疫表型
10例患者肿瘤细胞中Vimentin均呈弥漫强阳表达(图2A)、inhibin阳性表达8例、CR阳性表达(图2B)6例、Desmin阳性表达(图2C)3例,SMA阳性表达(图2D)8例、AE1/AE3弱阳表达3例。10例均不表达EMA,Ki-67指数<5%。
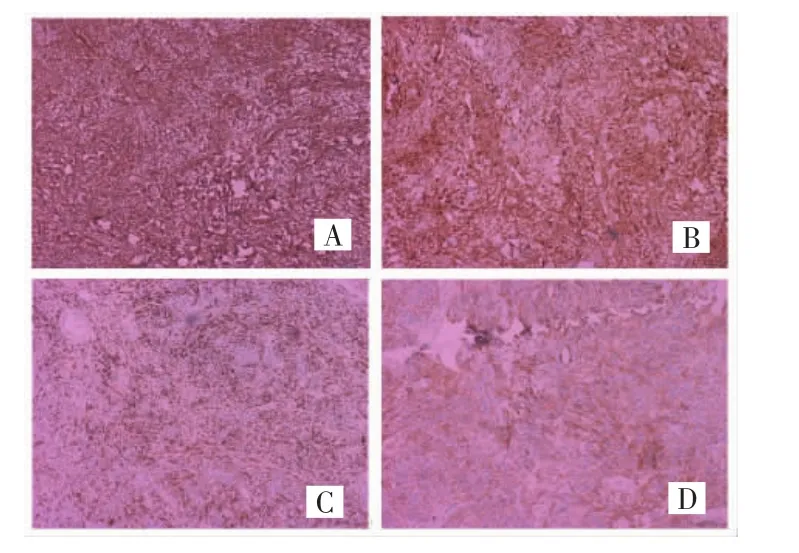
图2 SST的免疫组化检查结果(IHC,×100)
2.5 随访
10例患者失访1例,其中1例患者术后2年发现肺癌,进行肺切除术及化疗,SST术后71个月未复发;其余8例术后随访6~108个月均无复发。
3 讨论
SST由Chalvardjian及Scully于1973年首次报道并命名,此后国内外有学者相继报道[2-3]。SST是一种良性的性索-间质肿瘤,目前多认为起源于卵巢皮质中具有多向分化潜能的未分化间质细胞,较少见,常发生于青年人群[4],亦有幼儿病例报道[5]。本组病例平均年龄48.7岁,平均发病年龄较文献报道稍大。值得注意的是,有2例患者绝经后阴道出血,发现子宫平滑肌瘤和子宫内膜异位,手术后偶然发现SST,提示SST可能在青年时期即存在,因无明显症状而未发现。近年亦有SST发生于老年患者的报道,Lee等[6]报道2例63岁和59岁绝经后SST患者。因此,若老年人群症状符合,亦应警惕该病。
SST患者临床表现无特异性,常因月经不调、月经紊乱或性激素异常表现而误诊为功能性子宫出血,或因合并腹水、盆腔积液而误诊为卵巢恶性肿瘤。有研究报道典型SST临床表现为单侧、孤立、边界清楚的肿块[7]。本组病例均为单侧发病,其中右侧8例,左侧2例;病理特点为呈囊实性肿瘤,包膜完整,切面以实性为主,可见单个或多个囊泡,黄白相间,常伴水肿;典型组织学特征由富细胞区、硬化区和水肿区组成,三者之间有移行,形成假小叶结构,并可见丰富的薄壁血管,与文献报道一致[8-9]。结合本研究结果及复习相关文献,发现SST最常见的临床表现有以下方面:⑴性激素失调,月经周期改变,部分患者有性激素异常表现,如原发或继发不孕、性早熟、男性化等[10]。本组1例患者月经周期缩短。⑵可触及盆腹部肿块,可伴胸腹水,本组1例有腹腔积液;⑶合并症状如子宫平滑肌瘤、子宫内膜异位等,本组2例患者合并子宫平滑肌瘤,1例合并子宫内膜异位。
SST的影像学检查为实性肿块伴有微囊形成,囊实性占位。超声检查显示该肿瘤边界清楚,呈实性或囊实性不均质弱回声团[11-12]。但影像学检查在SST诊断中作用有限,明确诊断主要靠术后组织病理学诊断。有研究[13-14]归纳SST的CT及MR影像特点主要有以下几点:⑴早期周边显著强化,后期向心性渐进,类似“肝脏海绵状血管瘤”强化方式;⑵早期明显均匀强化,后期持续强化;⑶早期轻度强化,后期持续强化,但强化程度不如上述两种类型。本组无1例术前经影像学确诊,均为手术切除后经组织病理学检查确诊,提示影像学检查作用有限。
Kaygusuz等[15]报道,SST 肿瘤细胞中 α-inhibin、Vimentin、PR、SMA、Calrentinin、Desmin 均有不同程度阳性表达,CK、EMA阴性。本组10例患者中,Vimentin、inhibin、CR、Desmin、SMA、AE1/AE3均呈阳性表达,均不表达EMA,与上述文献报道一致。电镜观察SST,肿瘤细胞可分为以下三类[16-17]:⑴类似储脂细胞。细胞质肥硕,内含众多光面内质网,线粒体伴显著层状嵴,发育良好的高尔基氏器及类脂滴泡,中间丝醒目相当于光镜下空泡状或印戒状瘤细胞或黄素细胞;⑵纤维母细胞。梭形,核卵圆形;⑶体积小,核圆形,胞浆少,相当于光镜下小圆细胞,是原始未分化间叶细胞,可分化为前两类。用网状纤维染色显示肿瘤细胞被网状纤维围绕[9]。由于条件有限,本研究未做网状纤维染色。但若SST具有上述典型结构,不难诊断,外检工作特别是术中快速冰冻SST并不全具有上述典型结构及细胞,故易误诊。本组10例中有3例做术中快速冰冻,只有1例考虑为SST。分析可能有以下原因:SST发病率低,未警惕该病可能性;术中取材局限,未包含上述典型区域及细胞。因此,对于有腹水、盆腔实性包块、阴道不规则出血的女性,应高度考虑该病的可能性,避免过度治疗。朱娟等[18]报道1例卵巢硬化性间质瘤合并腹水亦得出相似结论。
SST应注意与以下肿瘤鉴别诊断:⑴卵巢纤维瘤或卵泡膜瘤。两者平均发病年龄较SST晚,表现为较一致的梭形细胞,血管不多,免疫组化检查SMA阴性有助于鉴别;⑵卵巢Krukenberg瘤。SST中含有脂质的细胞呈印戒样,可能误诊为Krukenberg瘤,特别是绝经后妇女。但Krukenberg瘤一般为双侧卵巢发病,常有胃肠癌病史,镜下无假小叶结构,细胞异型性大且弥漫,病理性核分裂相易见,免疫组化CK、EMA均阳性表达可与SST鉴别;⑶卵巢重度弥漫水肿。SST有时水肿区大,细胞丰富区、假小叶区少,可误诊为卵巢重度弥漫水肿。但卵巢重度弥漫水肿多为双侧发病,镜下见滤泡与其他结构周围间质明显水肿,常可见黄素化细胞群。
SST是一种良变肿瘤,手术治疗效果较好,复习文献尚未有复发及恶变报道[19-21]。本组随访6~108个月均未见复发。SST临床表现与影像学检查无明显特异性,因此临床诊断较困难,易误诊,主要依靠常规病理学诊断;术中若结构典型亦可诊断,但若未见典型结构,不易明确诊断,甚至可误诊为恶性卵巢肿瘤[22]。因此,术中应结合临床表现、影像学表现及术中冰冻结果综合诊断,如术中确诊,应选取合适的标本取材,或选取多块标本,提高诊断准确率,以免过度治疗。
[1] Virgone C,Cecchetto G,Ferrari A,et al.GATA-4 and FOG-2 expression in pediatric ovarian sex cord-stromal tumors replicates embryonal gonadal phenotype:results from the TREP project[J].PLoS One,2012,7(9):e45914.
[2] Chang YW,Hong SS,Jeen YM,et al.Bilateral sclerosing stromal tumor of the ovary in a premenarchal girl[J].Pediatr Radiol,2009,39(7):731-734.
[3] Gulati A,Kaushik R,Sharma J.Sclerosing stromal tumor of the ovary associated with benign endometrioid peritoneal implants[J].Indian J Pathol Microbiol,2009,52(4):594-595.
[4] Kurman RJ,Ellenson LH,Ronnett BM.Blaustein女性生殖道病理学[M].薛德彬.译.第 6 版,北京:北京科学技术出版社,2014:798-800.
[5] 周景,刘光,丁华野,等.幼儿卵巢硬化性间质瘤1例及文献复习[J].诊断病理学杂志,1997,4(4):217-218.
[6] Lee CM,Lim S,Cho HY,et al.Erratum to:sclerosing stromal tumor of the ovary in postmenopausal women:A report of two cases[J].J Menopausal Med,2015,21(3):175.
[7] 林瀛,陈小岩,陈佳菁.卵巢硬化性间质瘤5例临床病理分析[J].福建医药杂志,2016,38(4):70-72.
[8] Kaygusuz EI,Cesur S,Cetiner H,et al.Sclerosing stromal tumour in young women:clinicopathologic and immunohistochemical spectrum[J].J Clin Diagn Res,2013,7(9):1932-1935.
[9] Limaiem F,Boudabous E,Ben Slama S,et al.Sclerosing stromal tumour of the ovary:two case reports[J].Pathologica,2013,105(2):62-65.
[10]Chaurasia JK,Afroz N,Maheshwari V,et al.Sclerosing stromal tumour of the ovary presenting as precocious puberty:a rare neoplasm[J].BMJ Case Rep,2014,2014.
[11]周欣,闫军,高艳.卵巢硬化性间质瘤38例临床病理分析[J].中国医科大学学报,2012,41(5):435-437.
[12]杨筱,张波,姜玉新,等.卵巢硬化性间质瘤的超声影像及临床病理特征[J].协和医学杂志,2014,5(2):162-165.
[13]王志涛,邹煜,李奎.卵巢硬化性间质瘤的CT、MR表现及其病理基础[J].浙江医学,2016,38(14):1170-1174.
[14]武新英,王丽萍,杨小兵,等.卵巢硬化性间质瘤CT表现与临床病理探究[J].中国 CT 和 MRI杂志,2014,12(6):43-46.
[15]Kaygusuz EI,Cesur S,Cetiner H,et al.Sclerosing stromal tumour in young women:clinicopathologic and immunohistochemical spectrum[J].J Clin Diagn Res,2013,7(9):1932-1935.
[16]袁素,谢瑶芸,刘富金,等.卵巢硬化性间质瘤临床病理及电镜和免疫组化分析[J].临床与实验病理学杂志,2010,26(4):410-413.
[17]杨州,黄贵祥.卵巢硬化性间质瘤8例分析[J].陕西医学杂志,2014,43(5):637-638.
[18]朱娟,卞美璐,陈庆云,等.卵巢硬化性间质瘤合并腹水1例并文献复习[J].中日友好医院学报,2012,26(5):268-271.
[19]冯盼盼,卵巢硬化性间质瘤临床病理特征及鉴别诊断分析[J].中国卫生标准管理,2016,7(7):178-179.
[20] Bennett JA,Oliva E,Young RH.Sclerosing stromal tumors with prominent luteinization during pregnancy:A report of 8 cases emphasizing diagnostic problems[J].Int J Gynecol Pathol,2015,34(4):357-362.
[21] Pai RR,Shaktawat SS,Khadilkar UN,et al.Sclerosing stromal tumour of the ovary--a clinicopathologic spectrum[J].Indian J Pathol Microbiol,2005,48(3):370-372.
[22]彭丽秀,谭琛,陈晓琼,等.卵巢硬化性间质瘤1例报告并文献复习[J].中国实用妇科与产科杂志,2012,28(9):716-717.
