1-甲基环丙烯和自发气调对猕猴桃品质及活性氧代谢的影响
2018-06-19千春录殷建东王利斌王兢业肖丽霞金昌海陈学好齐晓花
千春录,殷建东,王利斌,林 晨,王兢业,肖丽霞,金昌海,陈学好,齐晓花,*
(1.扬州大学食品科学与工程学院,江苏 扬州 225127;2.南京农业大学园艺学院,江苏 南京 210095;3.扬州大学园艺与植物保护学院,江苏 扬州 225009)
猕猴桃不耐贮藏,常温下易软化腐烂[1]。抑制衰老并延长保鲜期是猕猴桃采后研究重点。植物组织正常代谢中会产生活性氧(reactive oxygen species,ROS),而抗氧化系统会清除ROS,使其维持于较低含量的动态平衡。低含量的ROS有信号传导、刺激代谢等作用,而高含量的ROS能通过氧化作用对植物组织产生损伤,从而导致衰老腐败;因此保持低水平ROS含量,维持其代谢平衡是抑制果实衰老的首要任务[2-3]。
猕猴桃是典型的呼吸跃变型果实,低浓度的乙烯就能促进果实软化衰老[4-5]。1-甲基环丙烯(1-methylcyclopropene,1-MCP)能更紧密地和乙烯作用位点结合,从而有效抑制乙烯作用。1-MCP的应用可抑制果实的呼吸作用和乙烯释放,提高果实的抗氧化能力,有效抑制果实的衰老并延长保鲜期[5-6]。自发气调(self-developed modified atmosphere,MA)通过气调袋内果实呼吸作用,降低气调袋中O2含量并提高CO2含量,并通过气调袋内外的气体交换来维持内部相对稳定的低O2高CO2平衡[7-8]。猕猴桃果实MA贮藏能有效抑制果实乙烯的产生和呼吸作用,降低代谢水平,提高抗氧化能力,从而抑制衰老进程[7-8]。有研究发现,将1-MCP处理和MA贮藏结合可有效抑制猕猴桃[9-10]和荔枝[11]低温下的衰老进程,进一步延长保鲜期。
低温贮藏可抑制猕猴桃衰老并延长其保鲜期,而对短期和短途流通的果实,常采用常温贮藏,但猕猴桃常温保鲜技术研究不足。在常温贮藏过程中,1-MCP处理和MA贮藏结合对猕猴桃衰老和软化的作用研究鲜见报道。本实验以中华猕猴桃为试材,研究1-MCP处理、MA贮藏及两者结合对猕猴桃采后常温下衰老和ROS代谢的影响,旨在为1-MCP和MA技术在猕猴桃常温保鲜中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
供试猕猴桃为中华猕猴桃(Actinidia chinensis),采自江苏省扬州市果园,七成成熟度(硬度为(2.36±0.22)kg/cm2;可溶性固形物质量分数为(9.37±0.43)%),挑选大小均匀、成熟度相对一致,无畸形、机械伤和病虫害果实为试材。
SmartFreshTM1-MCP 美国AgroFresh公司;低密度聚乙烯自发气调袋(厚40 μm;20 ℃ 1 个标准大气压下,O2透气率为9.2×103mL/(m2·d),CO2透气率为4.37×104mL/(m2·d)) 潍坊晟春元保鲜科技有限公司;乙二胺四乙酸二钠、聚乙烯吡咯烷酮、愈创木酚、还原型谷胱甘肽、氧化型谷胱甘肽、还原型辅酶Ⅰ、还原型辅酶Ⅱ、甲硫氨酸、氯化硝基四氮唑蓝、核黄素、2-硫代巴比妥酸、联吡啶(均为分析纯) 国药集团化学试剂有限公司;脱氢抗坏血酸、二硫代硝基苯甲酸(均为分析纯) 上海玉博生物科技有限公司。
1.2 仪器与设备
CheckMate Ⅱ O2、CO2测定仪 丹圣(上海)贸易有限公司;663-20型气相色谱仪 日本日立公司;GY-1型果实硬度计 上海玖荣实业有限公司;BSA-124S分析天平 北京赛多利斯仪器系统有限公司;5417R台式高速冷冻离心机 Eppendorf中国有限公司;UV-1750紫外-可见分光光度计 岛津中国有限公司。
1.3 方法
1.3.1 实验处理
猕猴桃采后2 h内运抵实验室,20 ℃预冷12 h,进行不同处理。
本实验共设4个处理组:1)对照(CK)组,即猕猴桃置于密封塑料箱(10 L)中,置于温度30 ℃恒温箱中12 h;2)1-MCP处理组,根据前期实验优化结果[1]进行,即猕猴桃置于密封塑料箱(10 L)中,在30 ℃下用1 μL/L的1-MCP熏蒸处理12 h;3)MA贮藏组,即CK组猕猴桃果实在贮藏前用低密度聚乙烯自发气调袋热封;4)1-MCP和MA结合处理(1-MCP+MA)组,即1 μL/L 1-MCP熏蒸处理猕猴桃12 h后,热封于自发气调袋中。每个处理重复3 次,每次重复60 个果实。
处理结束后,所有果实均置于温度为(20±1)℃、相对湿度为85%的恒温箱中,其中CK组和1-MCP处理组果实是裸放,而MA贮藏组和1-MCP+MA处理组的果实于自发气调袋中贮藏。贮藏期间每间隔7 d取样测定果实品质和生理指标。
1.3.2 指标测定
1.3.2.1 袋内O2、CO2体积分数的测定
O2、CO2体积分数分别采用O2、CO2测定仪测定。
1.3.2.2 乙烯释放量和硬度的测定
乙烯释放量和硬度参考千春录等[1]的实验方法测定。
1.3.2.3 可滴定酸质量分数和总糖含量的测定
可滴定酸质量分数和总糖含量参考付永琦等[12]的实验方法测定,结果以鲜质量计。
1.3.2.4 丙二醛含量和超氧阴离子生成速率的测定
丙二醛(malonaldehyde,MDA)含量和超氧阴离子生成速率参考千春录等[13]的实验方法测定,结果以鲜质量计。
1.3.2.5 相关酶活力的测定
超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR)、谷胱甘肽还原酶(glutathione reductase,GR)活力参考Qian Chunlu等[14]的实验方法测定。
1.3.2.6 抗坏血酸和谷胱甘肽含量的测定
抗坏血酸(ascorbate,ASC)和谷胱甘肽(glutathione,GSH)含量参考Qian Chunlu等[14]的实验方法测定,结果以鲜质量计。
1.4 数据分析
应用SPSS 16.0统计软件进行方差分析,差异显著性分析采用Tukey多重比较法。
2 结果与分析
2.1 贮藏过程中自发气调袋内气体成分变化
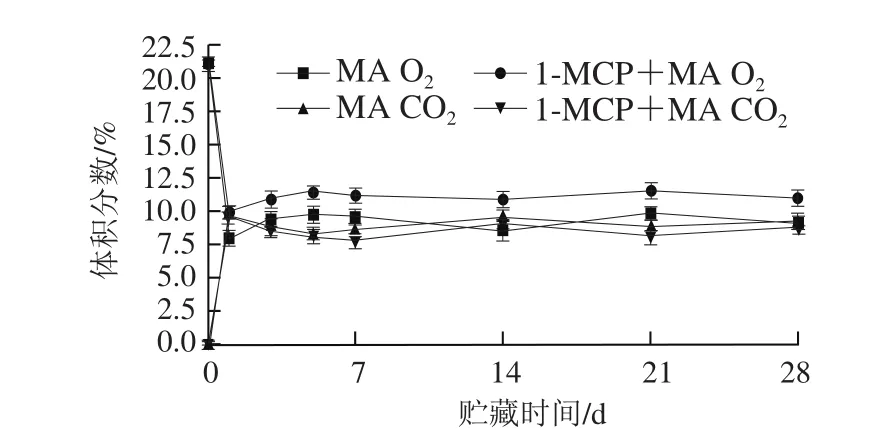
图1 猕猴桃贮藏过程中自发气调袋中气体体积分数的变化Fig. 1 Changes in gas composition of self-developed modified atmosphere during storage of kiwifruits
由图1可知,猕猴桃MA常温贮藏1 d后,气调袋内O2体积分数急剧下降而CO2体积分数急剧上升,到贮藏3 d后基本维持平衡状态,O2体积分数为8.4%~9.8%,CO2体积分数为8.2%~9.5%,O2和CO2的体积比处于0.8~1.1之间。1-MCP+MA处理组贮藏3 d后,袋内气体成分也基本稳定,O2体积分数为10.8%~11.5%,CO2体积分数为7.8%~8.9%,O2和CO2的体积比处于1.2~1.4。该现象说明猕猴桃MA贮藏能显著降低气调袋中O2体积分数,提高CO2体积分数,而1-MCP处理后MA贮藏的果实由于呼吸强度降低可在气调袋中保持相对较高的O2体积分数和较低的CO2体积分数。
2.2 不同处理对猕猴桃贮藏过程中乙烯释放量的影响
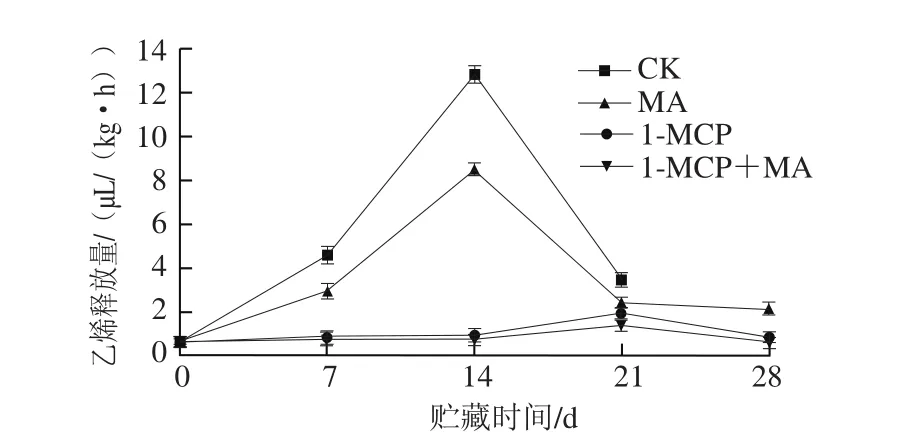
图2 不同处理对猕猴桃贮藏过程中乙烯释放量的影响Fig. 2 Effects of different treatments on ethylene production of kiwifruits during storage
乙烯能促进果实衰老,乙烯释放高峰出现是呼吸跃变型果实采后完熟的标志[5]。猕猴桃在呼吸跃变前会有乙烯释放高峰出现,而后进入后熟阶段[4]。由图2可知,CK组猕猴桃采后贮藏过程中乙烯释放量增加,在14 d左右出现乙烯释放高峰,而后释放量减少。与CK组相比,MA贮藏能显著降低猕猴桃果实乙烯释放高峰值(P<0.05),但并不能推迟乙烯峰出现;而1-MCP处理效果更佳,还能延迟乙烯峰出现时间至21 d,1-MCP+MA处理组果实的乙烯高峰于21 d出现,且峰值最小。该现象说明1-MCP处理和MA贮藏都能显著延缓果实衰老,其中1-MCP处理效果优于MA,1-MCP处理和MA贮藏可互增抑制衰老的效果。
2.3 不同处理对猕猴桃贮藏过程中硬度的影响
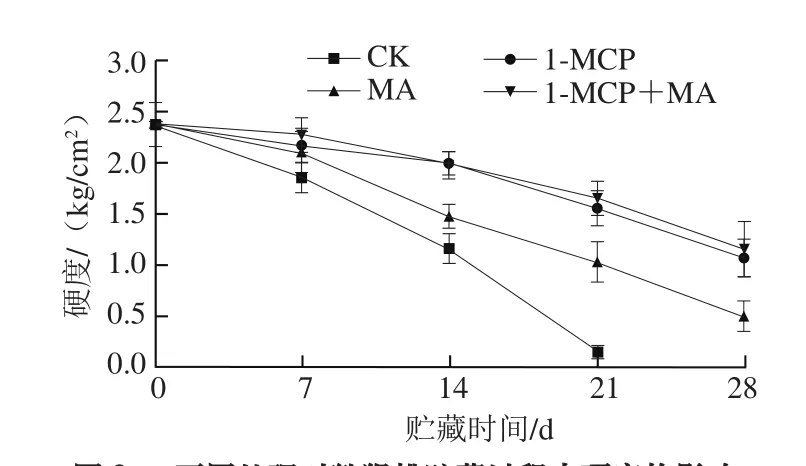
图3 不同处理对猕猴桃贮藏过程中硬度的影响Fig. 3 Effects of different treatments on firmness of kiwifruits during storage
猕猴桃采后易软化,果实硬度是其重要品质指标[1]。由图3可知,猕猴桃采后迅速软化,1-MCP、MA及1-MCP+MA处理都能保持果实硬度,在贮藏21 d时,分别是CK组果实的10.88、7.20、11.55 倍。1-MCP+MA处理组果实在贮藏后期硬度最高,但与1-MCP单独处理组差异不显著(P>0.05)。该现象说明1-MCP处理和MA贮藏都能抑制果实软化,其中1-MCP效果更佳,但两者结合处理并不能进一步显著改善果实硬度,其效果与1-MCP单独处理相当。
2.4 不同处理对猕猴桃贮藏过程中可滴定酸质量分数和总糖含量的影响
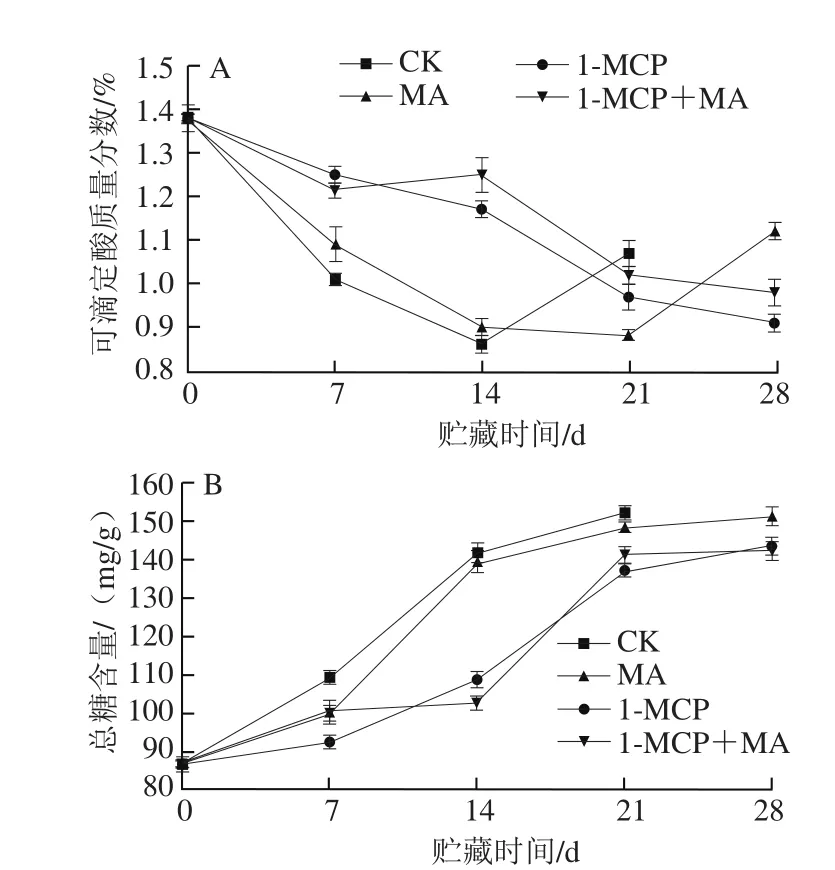
图4 不同处理对猕猴桃贮藏过程中可滴定酸质量分数(A)和总糖含量(B)的影响Fig. 4 Effects of different treatments on titratable acid (A) and total sugar (B) content of kiwifruits during storage
糖和酸含量是果实重要的品质指标[15-16]。由图4A可知,CK组猕猴桃可滴定酸质量分数在贮藏前期快速下降,14 d达到最低,而后上升。MA贮藏和1-MCP处理都可抑制果实可滴定酸质量分数下降,其中1-MCP处理组果实在贮藏前21 d可滴定酸质量分数较高,在贮藏后期1-MCP+MA处理组果实的可滴定酸质量分数更高。CK组和MA处理组果实在贮藏后期有可滴定酸质量分数上升现象,而1-MCP和1-MCP+MA处理组果实呈持续下降趋势。由图4B可知,CK组猕猴桃总糖含量在贮藏期间呈持续上升趋势,MA贮藏和1-MCP处理都抑制总糖含量上升,其中1-MCP处理组果实总糖含量较低,1-MCP+MA处理并不能进一步降低猕猴桃总糖含量。
2.5 不同处理对猕猴桃贮藏过程中MDA含量和超氧阴离子生成速率的影响
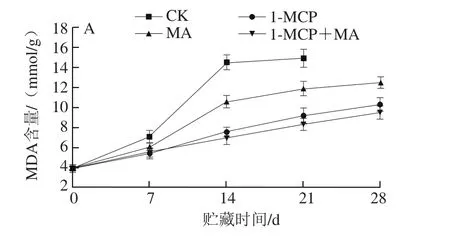
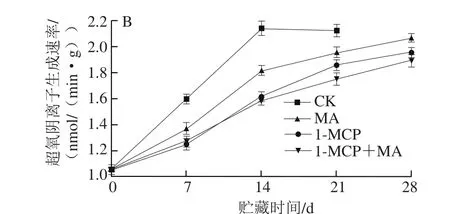
图5 不同处理对猕猴桃贮藏过程中MDA含量(A)和超氧阴离子生成速率(B)的影响Fig. 5 Effects of different treatments on MDA content (A) and production rate (B) of kiwifruits during storage
MDA是膜脂过氧化产物,其含量是判断果实衰老程度的重要指标[13]。ROS具有强氧化作用,可启动膜脂过氧化,从而破坏细胞膜系统完整性。超氧阴离子是ROS的一种,其生成速率可反映组织遭受氧化胁迫的程度[13-14]。由图5可知,CK组猕猴桃采后MDA含量和超氧阴离子生成速率变化趋势相似,在贮藏期都呈增加趋势,在贮藏的前14 d显著上升,而后变化并不显著。1-MCP处理和MA贮藏都能抑制MDA含量和超氧阴离子生成速率上升,其中1-MCP处理效果更佳,1-MCP+MA处理在贮藏前期并不能进一步降低MDA含量和超氧阴离子生成速率,但在贮藏后期表现稍明显。该现象说明1-MCP处理和MA贮藏都能抑制膜脂氧化进程,其中1-MCP处理效果更好,而两者结合处理在一定程度上抑制膜脂氧化能力最强。
2.6 不同处理对猕猴桃贮藏过程中相关酶活力的影响
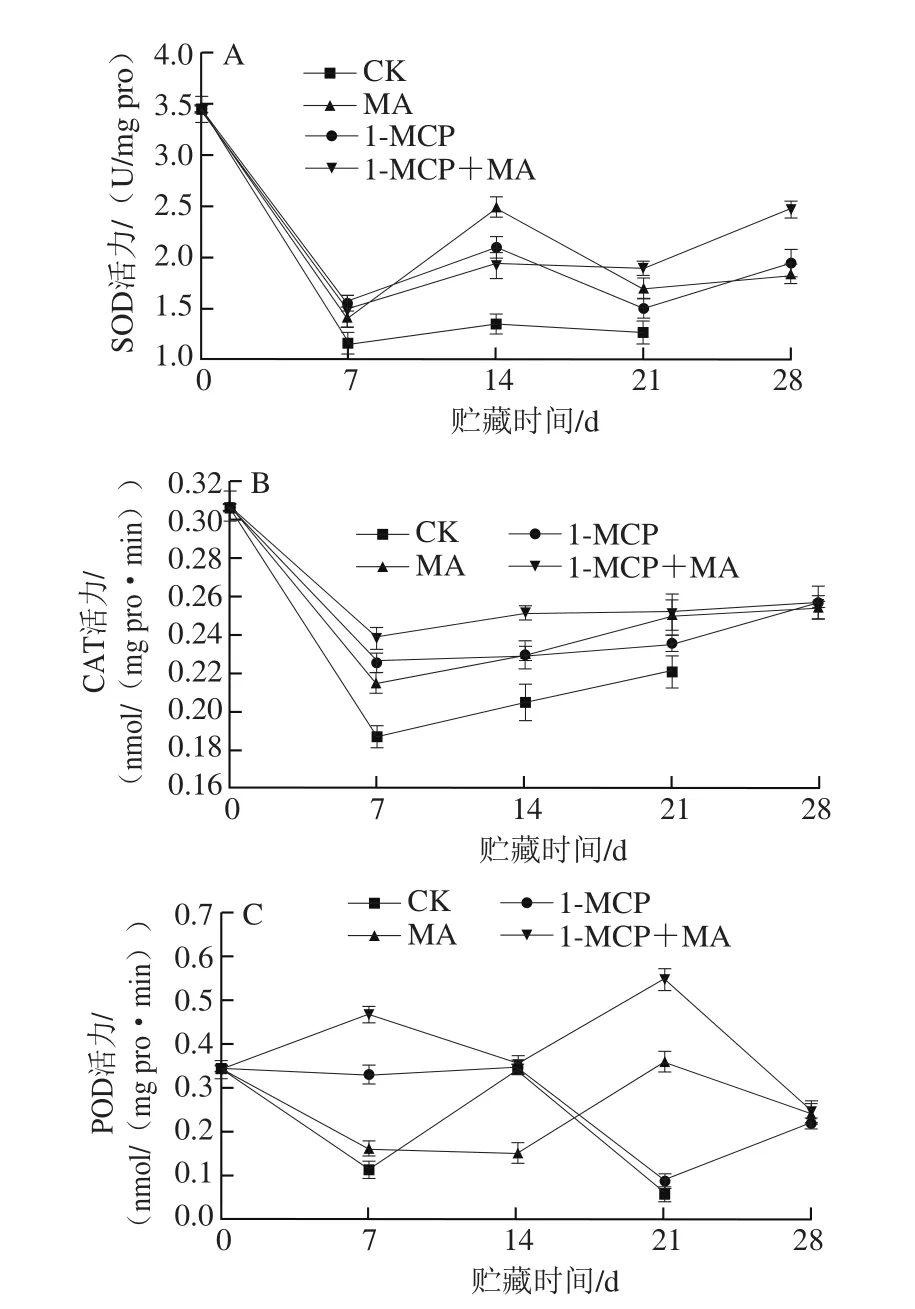
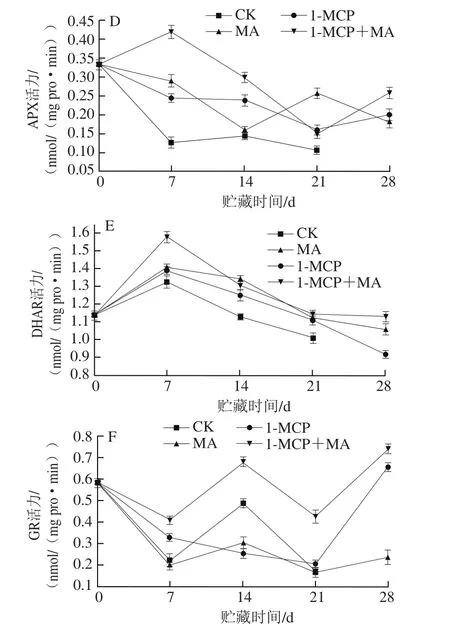
图6 不同处理对猕猴桃贮藏过程中SOD(A)、CAT(B)、POD(C)、APX(D)、DHAR(E)和GR(F)活力的影响Fig. 6 Effects of different treatments on SOD (A), CAT (B), POD (C),APX (D), DHAR (E) and GR (F) activity of kiwifruits during storage
果实衰老过程中氧化胁迫上升,一方面会加快膜脂氧化等衰老进程,另一方面会激活抗氧化系统[2-3]。抗氧化系统包括多种抗氧化酶和抗氧化物质,其中SOD能直接清除超氧阴离子生成O2和H2O2,而CAT和POD能清除H2O2,另外APX能够通过氧化ASC生成脱氢抗坏血酸,将H2O2还原清除,而DHAR能通过氧化GSH获取还原力,将脱氢抗坏血酸还原为ASC(此过程为ASC再生),同时GR可将氧化态谷胱甘肽还原为GSH,该循环是抗氧化系统中的抗坏血酸-谷胱甘肽循环[14]。
由图6A可知,CK组猕猴桃SOD活力在猕猴桃贮藏前7 d急剧下降,在7~14 d稍上升,而后活力下降。1-MCP处理和MA贮藏都能保持较高SOD活力,且14 d时活力出现明显的峰值,MA贮藏组猕猴桃果实有最高的SOD活力峰值,分别是CK、1-MCP、1-MCP+MA处理组果实的1.85、1.19 倍和1.30 倍。在贮藏后期各处理组果实SOD活力都呈上升趋势,其中两者结合处理组果实SOD活力显著高于其他处理组(P<0.05)。
由图6B可知,CK组猕猴桃CAT活力贮藏初期急剧下降,而后呈现上升趋势。各处理组果实CAT活力显著高于CK组(P<0.05),其中1-MCP+MA处理组果实最高。
由图6C可知,CK组猕猴桃果实POD活力在采后急剧下降,在7~14 d内上升,而后降低,且在21 d下降至最低水平。1-MCP处理和MA贮藏都能抑制贮藏前期POD活力下降,其中1-MCP处理能在贮藏前期保持较高的POD活力,而MA贮藏组果实在贮藏后期POD活力较高。1-MCP+MA处理组果实的POD活力最高,在贮藏前期呈上升趋势,7~14 d内下降,14 d后开始上升,21 d时上升至最高值,而后下降至与单一处理组果实相当的水平。
由图6D可知,CK组猕猴桃在贮藏初期APX活力急剧下降,7 d后变化并不明显,只在7~14 d稍上升。1-MCP处理和MA贮藏都能抑制猕猴桃贮藏期APX活力下降,而1-MCP+MA处理组果实APX活力在贮藏初期上升而后下降,保持较高活力,并于贮藏末期APX活力上升。
由图6E可知,CK组猕猴桃果实DHAR活力在贮藏初期上升,而后呈现下降趋势。1-MCP处理和MA贮藏都能提高7 d时猕猴桃DHAR活力峰值,其中1-MCP+MA处理组果实DHAR活力显著高于其他处理组果实(P<0.05),分别是CK、1-MCP、MA组果实的1.19、1.14 倍和1.12 倍,同时也能保持贮藏后期较高DHAR活力。
由图6F可知,CK组猕猴桃GR活力在贮藏前期下降,在7~14 d活力上升,而后下降。MA贮藏组果实GR活力变化趋势和CK组相似,只是14 d时GR活力高峰值显著低于CK组,且在21~28 d内GR活力略有回升。1-MCP处理组果实GR活力在贮藏期呈下降趋势,而在21~28 d时大幅上升。1-MCP+MA处理组果实GR活力变化和MA处理组果实相似,只是各时期1-MCP+MA处理组果实GR活力显著高于其他处理组果实(P<0.05)。
以上结果说明,贮藏前期猕猴桃果实直接抗氧化能力下降,14 d时抗氧化系统被激活,1-MCP处理和MA贮藏都能抑制贮藏前期果实抗氧化能力下降,且在贮藏后期保持较高的抗氧化能力,而1-MCP+MA处理组果实在贮藏期的抗氧化能力最强。
2.7 不同处理对猕猴桃贮藏过程中ASC和GSH含量的影响
由图7A可知,CK组猕猴桃ASC含量在贮藏前期呈下降趋势,在14 d时达到最低,而后在14~21 d上升,且21 d时ASC含量是14 d时的1.74 倍。与CK相比,1-MCP处理和MA贮藏都能抑制猕猴桃ASC含量在贮藏前期下降和贮藏后期上升的趋势,在14 d前各处理组果实ASC含量高于CK组,其中1-MCP处理组果实ASC含量显著高于MA贮藏组果实(P<0.05),而1-MCP+MA处理组果实ASC含量最高;14 d以后CK和1-MCP处理组果实ASC含量上升,而MA和1-MCP+MA处理组果实ASC含量持续下降至21 d后才开始上升,其中1-MCP处理组果实上升幅度最大,到28 d其ASC含量分别是MA贮藏果实和1-MCP+MA处理组果实的1.66、1.08 倍。
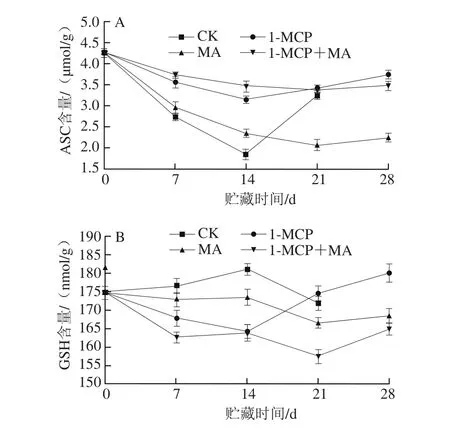
图7 不同处理对猕猴桃贮藏过程中ASC(A)和GSH(B)含量的影响Fig. 7 Effects of different treatments on ASC (A) and GSH (B) content of kiwifruits during storage
由图7B可知,CK组猕猴桃GSH含量在贮藏前期上升,14 d上升至最高值后下降。1-MCP处理组在贮藏前期、MA处理在整个贮藏期都降低果实GSH含量,14 d前MA贮藏组果实GSH含量显著高于1-MCP处理组果实(P<0.05),14 d后1-MCP处理组果实GSH含量急剧上升,且在21 d后其含量显著高于MA贮藏组果实(P<0.05)。1-MCP+MA处理组果实GSH含量在整个贮藏期最低,28 d时其GSH含量分别是1-MCP处理组和MA贮藏组果实的91.56%和97.81%。
以上结果说明,猕猴桃在常温贮藏过程中ASC和GSH含量变化趋势相反,1-MCP处理和MA贮藏都能提高果实ASC含量,但降低GSH含量,1-MCP+MA处理组果实的ASC含量最高,而GSH含量最低。因为ASC是APX的底物,且具有直接抗氧化能力,所以各处理均能提高果实的抗氧化能力,其中结合处理效果最好。
3 讨 论
果实软化是猕猴桃衰老的标志,一般认为果实硬度低于1 kg/cm2时,猕猴桃丧失商品价值[17]。本实验结果表明CK组猕猴桃在常温贮藏14 d后失去商品价值,MA贮藏可延长至21 d,1-MCP处理及1-MCP+MA处理组果实可贮藏28 d。1-MCP能更有效地保持果实硬度,抑制可滴定酸质量分数下降和总糖含量上升,可能与1-MCP能更加有效抑制乙烯生成,阻止呼吸跃变效应,从而延缓衰老有关。
MA贮藏能降低果实贮藏环境O2含量并提高CO2含量[7-8],本实验中,贮藏环境的气体浓度稳定后,猕猴桃MA贮藏环境的O2和CO2体积比处于0.8~1.1,明显小于低温自发气调的空气成分比值[17],该现象由猕猴桃常温贮藏时呼吸作用比较旺盛所致。1-MCP处理能明显降低猕猴桃呼吸强度,所以1-MCP+MA贮藏时环境O2比例提高,该现象表明结合处理可能可进一步抑制呼吸作用和乙烯释放量,延缓果实采后代谢和衰老。
果实采后ROS积累会导致氧化胁迫上升[18]。CK组猕猴桃采后常温贮藏过程中,超氧阴离子生成速率上升说明果实组织遭受氧化胁迫上升,从而导致MDA含量上升。相比MA贮藏,1-MCP处理能更有效抑制氧化胁迫上升和膜脂氧化进程,而两者结合处理效果最好,该现象与硬度品质指标表现一致。
猕猴桃贮藏前期抗氧化能力下降[18-19],植物ROS积累会激活其体内抗氧化系统[2-3]。SOD作为氧化胁迫的第一防线[20],在猕猴桃贮藏前期活力急剧降低,这可导致ROS大量积累,而贮藏14 d时果实出现SOD活力峰值,表明抗氧化系统激活,这和前期研究结果[18,21]相似。各处理都能保持较高的果实SOD活力,其中只有1-MCP+MA处理能持续提高其活力。CAT、POD和APX是能直接清除H2O2的酶,1-MCP处理和MA贮藏都能提高贮藏期猕猴桃果实CAT、POD和APX活力,其中贮藏前中期1-MCP效果较好,贮藏后期MA贮藏效果更佳,该现象和前期研究结果[18,22]类似。1-MCP+MA处理组果实CAT、POD和APX活力最高,说明这两种处理能互相促进直接清除H2O2的能力。
DHAR和GR在ASC-GSH循环中是ASC和GSH的再生酶,高活性的DHAR和GR能促进ROS清除,所以是植物对逆境的一种适应性反应[14,23]。贮藏初期CK组猕猴桃DHAR活力上升,ASC再生速率加快,该现象可抑制贮藏初期ASC含量的降低,但猕猴桃并不能保持高强度的ASC再生,在贮藏7 d后DHAR活力下降,该结果和前期研究结果[18]类似。1-MCP处理和MA贮藏都能增加贮藏7 d时猕猴桃DHAR活力,而1-MCP+MA处理组果实在贮藏7 d时DHAR活力显著高于其他处理组果实,说明结合处理能更有效提高ASC再生能力。GSH能促进ASC再生,贮藏前期CK组猕猴桃GR活力呈下降趋势,该现象可导致ASC和GSH再生受阻而含量下降,而在贮藏7~14 d内GR活力上升,可能是氧化胁迫上升导致应激反应。1-MCP和MA都不能明显提高猕猴桃果实GR活力,但1-MCP+MA处理能在贮藏各时间有效提高果实GR活力,说明结合1-MCP处理和MA贮藏能更有效促进ASC和GSH再生,从而减轻氧化胁迫。
ASC和GSH是植物体内重要的抗氧化物质,除参与ASC-GSH循环外,还参与多种代谢途径[3,24]。各处理组猕猴桃在贮藏前期ASC含量下降,在贮藏后期果实软化后上升,该现象与前期研究结果[1,21]类似。1-MCP处理和MA贮藏都能提高猕猴桃ASC含量,其中1-MCP处理效果更好,1-MCP+MA处理组果实的ASC含量最高;说明组合1-MCP处理和MA贮藏能降低ASC降解,保持果实抗氧化活性。CK果实GSH含量在贮藏前期上升,14 d后下降。1-MCP处理和MA贮藏都降低猕猴桃GSH含量,其中1-MCP+MA处理组果实最低。GSH和ASC含量变化趋势相反,该现象可能由ASC再生消耗GSH所致[1]。
猕猴桃采后衰老过程中会出现乙烯高峰和呼吸跃变,1-MCP处理[25-26]和MA贮藏[27-28]都能抑制乙烯产生。本实验中猕猴桃呼吸跃变出现在14 d左右,1-MCP处理相比MA贮藏能更有效抑制并延后乙烯产生,该现象与前期实验结果相似[21]。1-MCP处理后进行MA贮藏可进一步抑制乙烯产生,可能是由于结合处理不仅能有效抑制呼吸作用和乙烯释放,也能通过低氧的贮藏环境延缓代谢,减少失水,从而进一步延缓果实衰老。14 d左右呼吸跃变期间CK组猕猴桃硬度和可滴定酸质量分数急剧下降,同时总糖含量上升,出现后熟现象[29],同时SOD、POD、APX、GR活力和GSH含量增加;这可能是由于各种代谢加剧,ROS含量增加,最终激活抗氧化系统[30]。CK组猕猴桃并不能长期保持高水平的抗氧化能力,14 d后SOD、POD和APX活力在呼吸跃变后就下降,从而致使ROS后期积累,导致最终衰老。1-MCP处理和MA贮藏都通过抑制乙烯产生,降低了呼吸跃变对抗氧化系统的影响,特别是1-MCP+MA贮藏组的果实,贮藏期间表现出较高的SOD、POD、APX活力,抗氧化能力明显提高,从而延缓膜脂氧化和衰老进程。
综上所述,猕猴桃常温下快速软化衰老,1-MCP处理和MA贮藏都能抑制常温贮藏猕猴桃乙烯释放,提高SOD、CAT、POD、APX、DHAR活力,抑制ASC降解,从而保持较高的抗氧化性,抑制超氧阴离子生成速率升高及MDA积累,进而延缓软化和衰老进程。1-MCP处理猕猴桃果实贮藏效果优于MA贮藏,而1-MCP处理后进行MA贮藏的保鲜方式能达到更好的贮藏效果。
[1] 千春录, 陶蓓佩, 陈方霞, 等. 1-MCP对猕猴桃果实品质和细胞氧化还原水平的影响[J]. 保鲜与加工, 2012, 12(2): 9-13.
[2] FOYER C H, NOCTOR G. Oxidant and antioxidant signalling in plants: a re-evaluation of the concept of oxidative stress in a physiological context[J]. Plant, Cell and Environment, 2005, 28(8):1056-1071. DOI:10.1111/j.1365-3040.2005.01327.x.
[3] FOYER C H, NOCTOR G. Ascorbate and glutathione: the heart of the redox hub[J]. Plant Physiology, 2011, 155(1): 2-18. DOI:10.1104/pp.110.167569.
[4] ATKINSON R G, GUNASEELAN K, WANG M Y, et al. Dissecting the role of climacteric ethylene in kiwifruit (Actinidia chinensis)ripening using a 1-aminocyclopropane-1-carboxylic acid oxidase knockdown line[J]. Journal of Experimental Botany, 2011, 62(11):3821-3835. DOI:10.1093/jxb/err063.
[5] SISLER E C, SEREK M. Inhibitors of ethylene responses in plants at the receptor level: recent developments[J]. Physiologia Plantarum,1997, 100(3): 577-582.
[6] MURAKAMI S, SUZUKI M, HATTORI N, et al. Influence of harvesting time and precooling treatment on 1-methylcyclopropene efficacy in ‘Rainbow Red’ kiwifruit (Actinidia chinensis)[J].Horticultural Research (Japan), 2016, 15(1): 73-79.
[7] WANG C T, WANG C T, CAO Y P, et al. Effect of modified atmosphere packaging (MAP) with low and superatmospheric oxygen on the quality and antioxidant enzyme system of golden needle mushrooms (Flammulina velutipes) during postharvest storage[J].European Food Research and Technology, 2011, 232(5): 851-860.DOI:10.1007/s00217-011-1453-5.
[8] MCDONALD B, HARMAN J E. Controlled-atmosphere storage of kiwifruit: I. effect on fruit firmness and storage life[J]. Scientia Horticulture, 1982, 17(2): 113-123.
[9] MWORIA E G, YOSHIKAWA T, SALIKON N, et al. Effect of MA storage and 1-MCP on storability and quality of ‘Sanuki Gold’kiwifruit harvested at two diあerent maturity stages[J]. Journal of the Japanese Society for Horticultural Science, 2011, 80(3): 372-377.
[10] VIEIRA M J, ARGENTA L C, DO AMARANTE C V T, et al.Postharvest quality of ‘Hayward’ kiwifruit treated with 1-MCP and stored under diあerent atmosphere[J]. Revista Brasileira Fruticultura,2012, 34(2): 400-408.
[11] DE REUCK K, SIVAKUMAR D, KORSTEN L. Integrated application of 1-methylcyclopropene and modified atmosphere packaging to improve quality retention of litchi cultivars during storage[J].Postharvest Biology and Technology, 2009, 52: 71-77. DOI:10.1016/j.postharvbio.2008.09.013.
[12] 付永琦, 陈明, 刘康, 等. 1-MCP二次处理对猕猴桃果实采后生理生化及贮藏效果的影响[J]. 果树学报, 2007, 24(1): 43-48.
[13] 千春录, 何志平, 林菊, 等. 热处理对黄花梨冷藏品质和活性氧代谢的影响[J]. 食品科学, 2013, 34(2): 303-306.
[14] QIAN Chunlu, HE Zhiping, ZHAO Yuying, et al. Maturity-dependent chilling tolerance regulated by the antioxidative capacity in postharvest cucumber (Cucumis sativus L.) fruits[J]. Journal of the Science of Food and Agriculture, 2013, 93: 626-633. DOI:10.1002/jsfa.5858.
[15] PRASANNA V, PRABHA T N, THARANATHAN R N. Fruit ripening phenomena: an overview[J]. Critical Reviews in Food Science and Nutrition, 2007, 47(1): 1-19. DOI:10.1080/10408390600976841.
[16] LI H J, ZHU Y Q, LUO F Y, et al. Use of controlled atmospheres to maintain postharvest quality and improve storage stability of a novel red-fleshed kiwifruit (Actinidiachinensis planch. var. rufopulpa [C. F.Liang et R. H. Huang] C. F. Liang et A. R. Ferguson)[J]. Journal of Food Processing and Preservation, 2015, 39(6): 907-914. DOI:10.1111/jfpp.12303.
[17] 马书尚, 周瑗月. 秦美猕猴桃自发气调贮藏技术研究初报[J]. 中国果树, 1994, 11(3): 22-23.
[18] XIA Y X, CHEN T, QIN G Z, et al. Synergistic action of antioxidative systems contributes to the alleviation of senescence in kiwifruit[J].Postharvest Biology and Technology, 2016, 111: 15-24. DOI:10.1016/j.postharvbio.2015.07.026.
[19] MINAS I S, TANOU G, BELGHAZI M, et al. Physiological and proteomic approaches to address the active role of ozone in kiwifruit post-harvest ripening[J]. Journal of Experimental Botany, 2012, 63(7):2449-2464. DOI:10.1093/jxb/err418.
[20] ZHU S H, SUN L N, ZHOU J. Effects of different nitric oxide application on quality of kiwifruit during 20 ℃ storage[J].International Journal of Food Science and Technology, 2010, 45(2):245-251. DOI:10.1111/j.1365-2621.2009.02127.x.
[21] 樊秀彩, 张继澍. 1-甲基环丙烯对采后猕猴桃果实生理效应的影响[J].园艺学报, 2001, 28(5): 399-402.
[22] 唐燕, 杜光源, 马书尚, 等. 1-MCP对室温贮藏下不同成熟度猕猴桃的生理效应[J]. 西北植物学报, 2010, 30(3): 564-568.
[23] 吴锦程, 陈建琴, 梁杰, 等. 外源一氧化氮对低温胁迫下枇杷叶片AsA-GSH循环的影响[J]. 应用生态学报, 2009, 20(6): 1395-1400.
[24] POTTERS G, DE GARA L, ASARD H, et al. Ascorbate and glutathione: guardians of the cell cycle, partners in crime?[J]. Plant Physiology and Biochemistry, 2002, 40(6): 537-548. DOI:10.1016/S0981-9428(02)01414-6.
[25] BLANKENSHIP S M, DOLE J M. 1-Methylcyclopropene: a review[J]. Postharvest Biology and Technology, 2003, 28(1): 1-25.DOI:10.1016/S0925-5214(02)00246-6.
[26] MAO L C, WANG G Z, QUE F. Application of 1-methylcyclopropene prior to cutting reduces wound response and maintains quality in cut kiwifruit[J]. Journal of Food Engineering, 2007, 78(1): 361-365.DOI:10.1016/j.jfoodeng.2005.10.004.
[27] DOMÍNGUEZ I, LAFUENTE M T, HERNÁNDEZ-MUNOZ P, et al.Influence of modified atmosphere and ethylene levels on quality attributes of fresh tomatoes (Lycopersicon esculentum Mill.)[J]. Food Chemistry, 2016, 209: 211-219. DOI:10.1016/j.foodchem.2016.04.049.
[28] HUANG Z H, GUO L F, WANG H, et al. Energy status of kiwifruit stored under diあerent temperatures or exposed to long-term anaerobic conditions or pure oxygen[J]. Postharvest Biology and Technology,2014, 98: 56-64. DOI:10.1016/j.postharvbio.2014.07.008.
[29] WANG C Y, BUTA J G. Maintaining quality of fresh-cut kiwifruit with volatile compounds[J]. Postharvest Biology and Technology, 2003,28(1): 181-186. DOI:10.1016/S0925-5214(02)00125-4.
[30] SONG L L, GAO H Y, CHEN H J, et al. Eあect of short-term anoxic treatment on antioxidant ability and membrane integrity of postharvest kiwifruit during storage[J]. Food Chemistry, 2009, 114(4): 1216-1221.DOI:10.1016/j.foodchem.2008.10.080.
