不同病理危险度分级的胃肠道间质瘤CT表现特点
2018-06-19巢惠民王劲武
仝 莉 巢惠民 王劲武
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是起源于胃肠道的间叶组织肿瘤,通过免疫组化标记物CD34、CD117等特异性标记物对肿瘤亚型定性并获得广泛认可[1-2]。2002年美国国立卫生研究院(NIH)提出依据胃肠道间质瘤的肿瘤大小和肿瘤细胞的核分裂像数目,可将其分为极低风险组、低风险组、中度风险组和高风险组[3]。目前临床治疗间质瘤的首选方法为手术切除,对此术前影像学评价不仅是确诊GIST的主要方法,还是协助临床制定手术方案、评估手术预后的重要手段。CT因能够清晰的显示GIST病况,对于确诊GIST具有极高的价值[4]。本文以合肥第一人民医院35例胃肠道间质瘤患者为研究对象,通过比较不同病理危险度GIST的 CT影像学表现,探讨CT在判定肿瘤的病理危险度分级的可行性,为胃肠道间质瘤的诊治提供参考。
1 资料与方法
1.1 一般资料 回顾性分析2013年10月至2016年12月在合肥第一人民医院行CT检查并经手术病理和免疫组化证实的35例GIST 患者为研究对象,所有患者均符合《中国胃肠间质瘤诊断治疗共识(2013版)》[5]GIST的诊断标准。35例患者中,男性19例,女性16 例;年龄11~83岁,中位年龄61岁。按照不同病理危险度分级分为低危险度组9例(25.71%)、中危险度组12例(34.29%)及高危险度组14例(40.00%)3组, 3组患者年龄、男女比例、合并症等一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。

表1 3组患者一般资料比较
1.2 纳入与排除标准 纳入标准:①临床和病理诊断为GIST;②在本院行手术治疗;③行CT平扫及增强扫描;④患者术后无严重并发症。排除标准:①病理或CT影像学资料缺失者;②本次入院并发其他恶性肿瘤者。
1.3 方法 通过单因素分析不同病理分级肿瘤与CT征象(肿瘤的发生部位、大小、形态、有无囊变坏死、脂肪间隙情况侵犯转移情况、动态增强扫描特点、有无肿瘤血管)的关系;分析不同病理危险度分级间质瘤的CT表现。
1.3.1 CT检查 采用SIMENS SOMATOM Definition (第一代)双源CT扫描仪,Medrad双筒高压注射器(美国MEDRAD)进行检查。患者常规禁食、禁水8 h以上,于检查前夜行清肠准备。检查前30 min,患者空腹饮2.5%甘露醇(四川科伦,M15041412)等渗溶液800~1 000 mL,患者取仰卧位,扫描范围自膈顶至耻骨联合下缘,造影剂用量1.2 mL/kg,注射后继续推注生理盐水20 mL冲洗。依次行全腹部平扫及三期动态增强扫描:动脉期采用动态监测阈值触发双能量扫描模式;静脉期及延迟期分别动脉延迟75 s和300 s,采用常规螺旋扫描方式。
1.3.2 影像学分析 所有患者CT图像均由2位高年资医师独立阅片,观察参数包括GIST发生的部位、大小、形态、生长方式、有无囊变坏死(增强扫描后,CT值变化<10 HU,则认为坏死)、溃疡、瘤周脂肪间隙情况、邻近器官的侵犯、转移情况、强化程度(增强扫描后,增强峰值CT变化<20 HU为轻度强化、20≤HU≤50为中度强化、>50 HU为明显强化)、瘤内有无出血、有无肿瘤血管等。根据病灶发生部位分为胃、小肠、直肠、胃肠外4组;根据病灶最大径分为≤5 cm、5~10 cm、≥10 cm 3组;根据病灶形态分为规则和不规则2组;根据病灶的生长方式分为内生、外生、跨壁3组;根据瘤周脂肪间隙分为清晰、模糊2组;根据病灶内部有无囊变坏死分为有囊变坏死、无囊变坏死2组;根据邻近器官与病灶的分界分为有侵犯、无侵犯2组;根据有无远处转移分为有远处转移、无远处转移2组;根据患者注入造影剂后病灶强化程度分为轻度强化、中度强化、明显强化3组;根据平扫观察瘤内有无高密度出血分为有出血、无出血2组;根据增强后肿瘤内肿瘤血管的情况分为有肿瘤血管和无肿瘤血管2组。
1.4 统计学方法 采用SPSS 19.0软件对数据进行统计分析。计数资料用例/率表示,采用χ2检验,对于例数<5者,采用Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 不同危险度间质瘤与CT表现的比较 单因素分析结果显示,不同病理危险度肿瘤与肿瘤生长部位、大小、瘤周脂肪间隙、囊变坏死、肿瘤强化程度、瘤内有无出血、肿瘤侵犯临近器官、腹腔转移有关(P<0.05),与肿瘤生长方式无关(P>0.05)。详见表2。
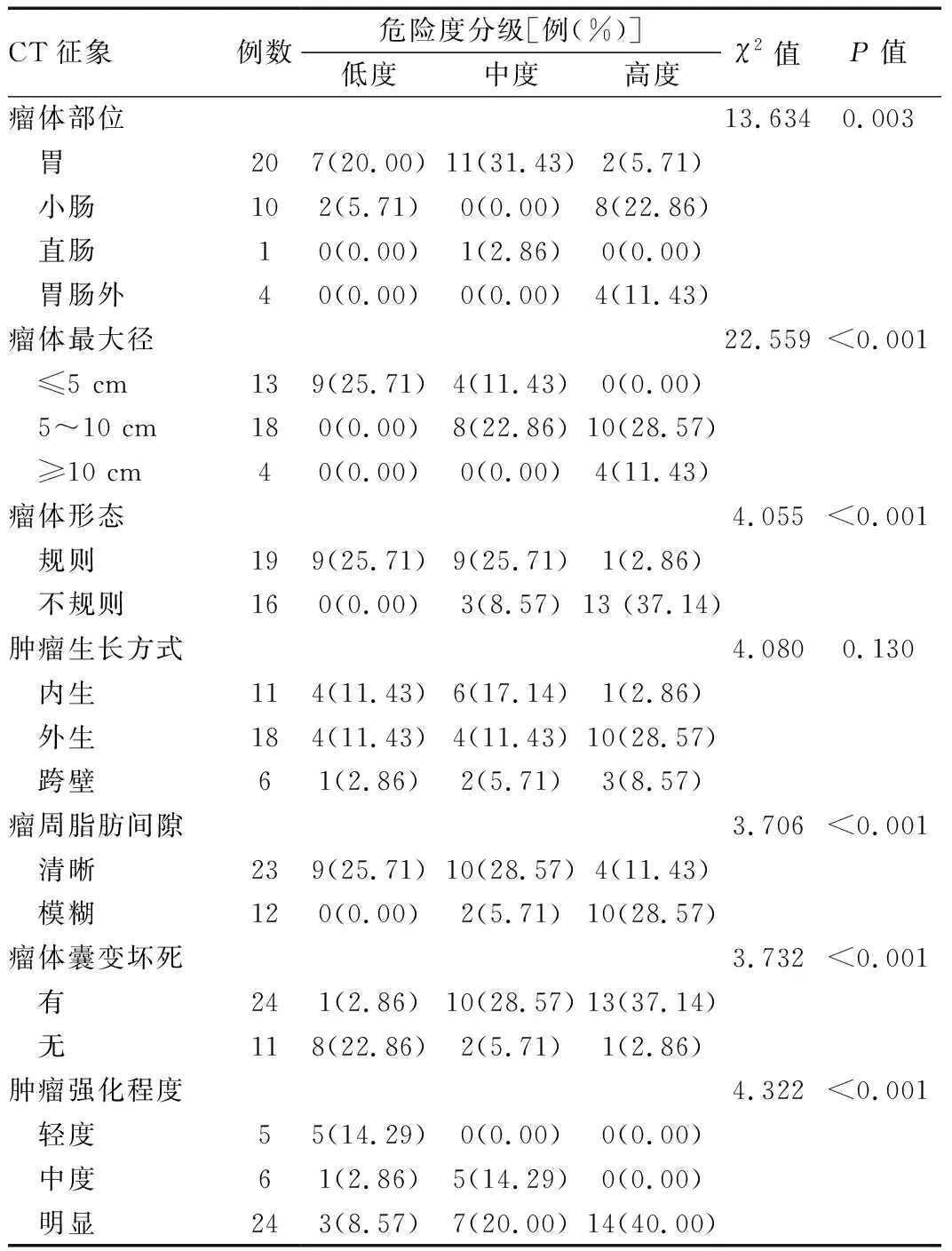
表2 不同病理分级肿瘤与CT影像学征象比较
表2续
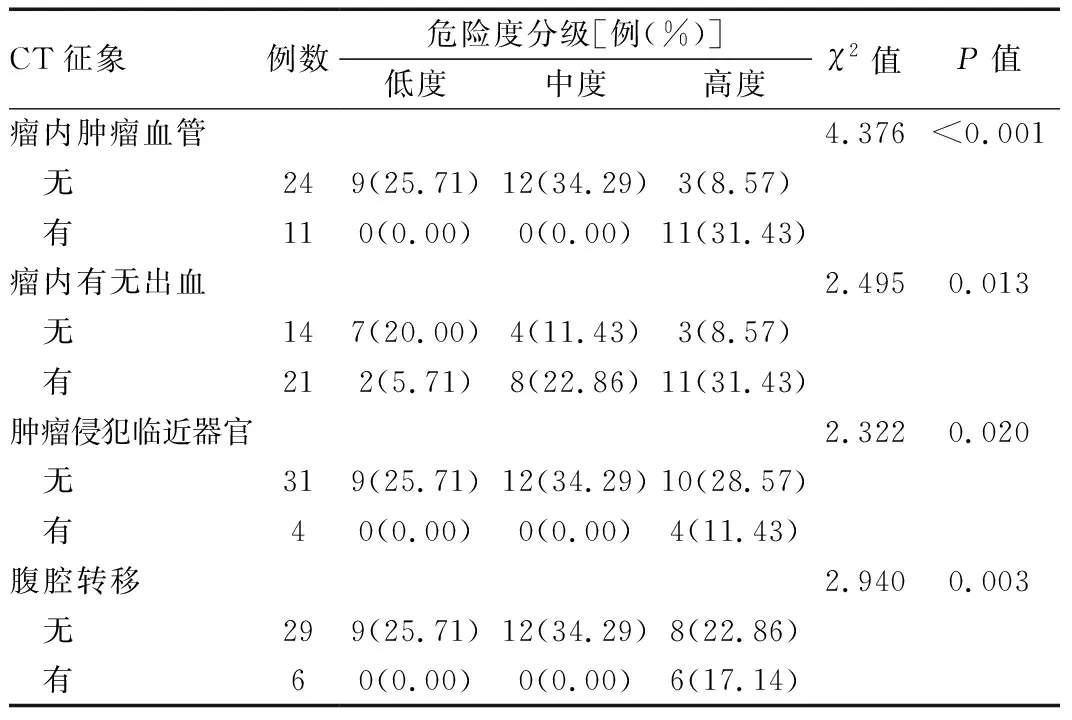
CT征象例数危险度分级[例(%)]低度中度高度χ2值 P值瘤内肿瘤血管4.376<0.001 无249(25.71)12(34.29)3(8.57) 有110(0.00)0(0.00)11(31.43)瘤内有无出血2.4950.013 无147(20.00)4(11.43)3(8.57) 有212(5.71)8(22.86)11(31.43)肿瘤侵犯临近器官2.3220.020 无319(25.71)12(34.29)10(28.57) 有40(0.00)0(0.00)4(11.43)腹腔转移2.9400.003 无299(25.71)12(34.29)8(22.86) 有60(0.00)0(0.00)6(17.14)
2.2不同病理危险度分级的GIST患者CT表现 低危险度间质瘤CT下瘤体最大径均≤5 cm,形态规则,瘤周脂肪间隙清晰,增强扫描瘤体呈轻度强化(图1A);中危险度间质瘤CT下,5 cm<瘤体最大径<10 cm,瘤内可见少许囊变坏死(图1B),瘤体增强后大多呈中度强化;高危险度间质瘤CT下瘤体最大径>5 cm,瘤内可见大面积囊变坏死(图1C),瘤周脂肪间隙模糊(图1E),瘤体增强后实质区呈明显强化,肿瘤血管生成(图1D),双能量灌注图显示,瘤体实质呈明显高灌注(图1E)。
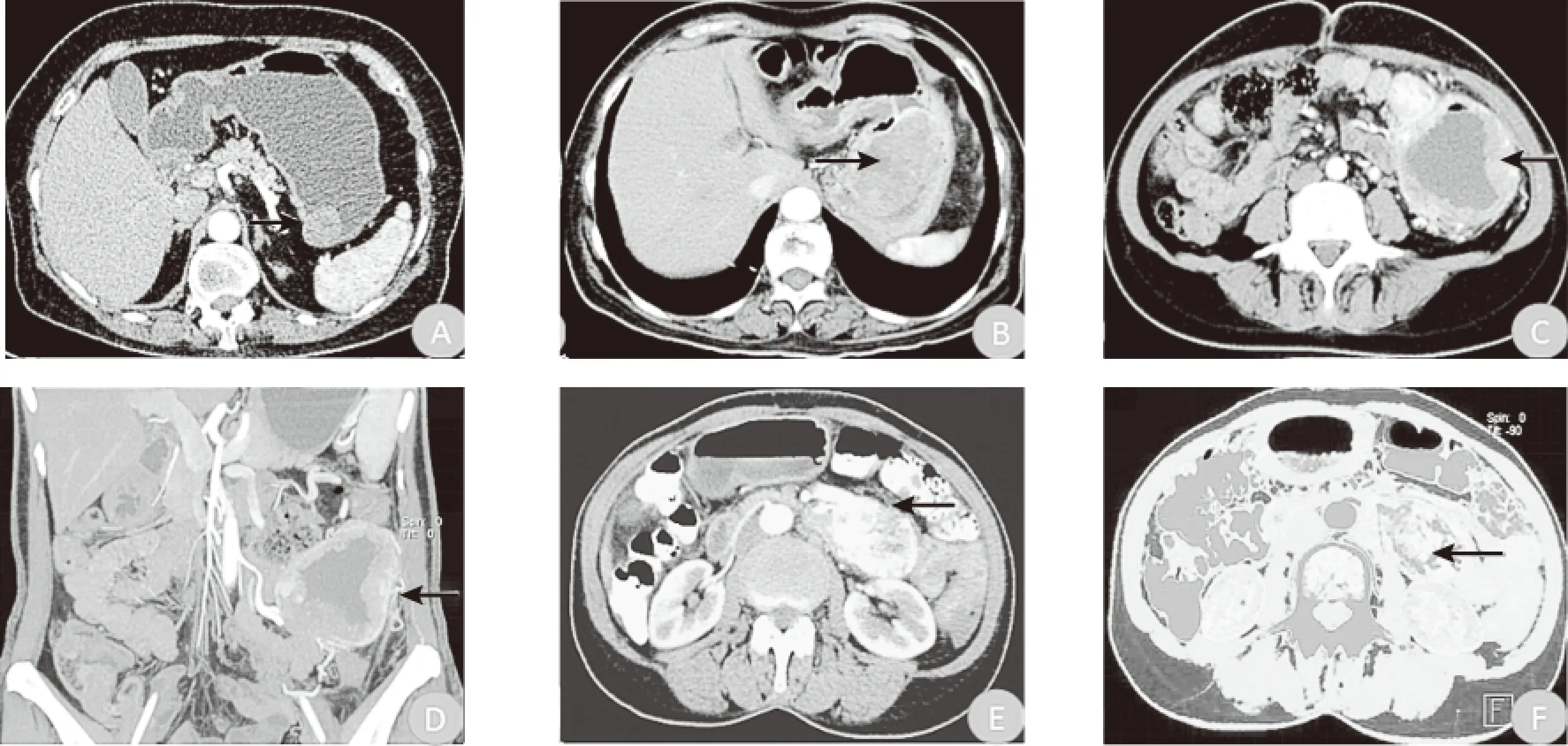
图1 不同危险度分级肿瘤CT表现
注:A为低危险度间质瘤,病灶最大径≤5 cm,腔内生长,瘤周脂肪间隙清晰(↑所示),轻度强化;B为中危险度间质瘤,5 cm<病灶最大径<10 cm,腔内生长,中度强化,其内可见少许囊变(↑所示);C为高危险度间质瘤,病灶最大径>10 cm,外生性生长,明显强化,内可见囊变坏死及点条状血管影(↑所示);D为高危险度间质瘤,在冠状位薄层最大密度投影图像上可清晰显示长条状迂曲肿瘤侧支血管影(↑所示);E为高危险度间质瘤,脂肪间隙模糊(↑所示),可见较多肿瘤血管;F与E为高危险度间质瘤,可见肿瘤血管显示, 瘤体呈高灌注(↑所示)
3 讨论
GIST是胃肠道间叶组织以梭形细胞或上皮样细胞为主且非定向分化的肿瘤,是胃肠道最常见的间叶组织来源的肿瘤。目前,临床治疗间质瘤的首选方法为外科手术切除。揭志刚等[6]提出,完全性手术切除能明显提高GIST患者的预后。唐磊[4]指出,术前CT提供的信息有利于手术方案的制定。CSCO胃肠道间质瘤专家委员会的诊断共识[5]认为,术前的影像学检查非常有必要。但是,目前国际上对根据术前影像学资料进行病理分级并未有一致的标准。
Miettinen等[7]研究发现,在其他影像学参数相似的情况下,小肠和胃肠道外间质瘤较胃部间质瘤危险程度更高。有研究[8-9]发现,在相同CT征象下,非胃部间质瘤风险显著高于胃部间质瘤。樊明等[10]对一些病例研究发现,发生于肠系膜和大网膜的间质瘤病例均为恶性,这与本研究中发现的非胃部间质瘤危险度更高基本一致。张向群等[8]研究显示,胃部间质瘤外生性生长方式危险度较高,而非胃部间质瘤腔内型生长方式危险度明显较跨壁和外生性生长方式危险度高,而本次研究发现间质瘤生长方式和危险度分级之间并无联系,与张向群的报道不一致,可能与本研究样本量偏小有关。
GIST的大小是评估肿瘤危险度的重要参数,随着肿瘤的危险度增加,其相应的生物学特性、生长方式也发生改变,中高危险度GIST呈侵袭性生长,周围脂肪间隙多模糊,有浸润征象,且由于生长过快,导致肿瘤内部血供差,易出现囊变坏死。另外,高危险度的肿瘤生长速度更快且不均匀,故高危险度GIST形态多呈不规则。这与本次研究中发现的间质瘤大小、形态、周围脂肪间隙、邻近器官侵犯转移在不同危险度等级之间有差异相一致。不仅如此,彭振鹏等[11]提出,无坏死的间质瘤一般病理分级为低危险度间质瘤,出现大片状坏死则病理分级为高危险度间质瘤可能性大,这进一步验证了我们的发现是有意义的。
总之,本结果提示,高危险度GIST患者中,大部分可以观察到肿瘤血管,增强后瘤体内可见明显强化,低及中危险度患者瘤体内均未见肿瘤血管。而且中、高危险度患者肿瘤内大部分可见出血,虽然病理标本的出血不一定在CT图像中有表现,但是有出血的患者一般肿瘤密度不均匀,如果图像中发现有出血,一般提示肿瘤危险程度高。
[1] 牛俊扬,王晓秋,胡闻.胃肠道间质瘤的临床病理及免疫组化观察[J].安徽医学,2003,24(5):22-24.
[2] KOO D H,RYU M H,KIM K M,et al.Asian consensus guidelines for the diagnosis and management of gastrointestinal stromal tumor[J].Cacer Res Treat,2016,48(4):1155-1166.
[3] FLETCHER C D,BERMAN J J,CORLESS C,et al.Diagnosis of gastro-intesinal stromal tumors:a consensus approach[J].Hum Pathol,2002,33(5):459-465.
[4] 唐磊.胃肠间质瘤外科治疗相关的影像学评价[J].中国实用外科杂志,2015,35(4):364-369.
[5] CSCO胃肠间质瘤专家委员会.中国胃肠间质瘤诊断治疗共识(2013版)[J].临床肿瘤学杂志,2013,18(11):1025-1032.
[6] 揭志刚,谢小平,秦克旺,等.胃肠道间质瘤预后因素的临床分析[J].中华胃肠外科杂志,2005,8(3):210-212.
[7] MIETTINE M,LASOTA J.Gastrointestinal stromal tumours:review on morphology,molecular pathology,prognosis,and differential diagnosis[J].Arch Pathol Lab Med,2006,130(10):1466-1478.
[8] 张向群,许乙凯,彭剑峰,等.胃间质瘤与非胃间质瘤的CT征象及病理学分级的对比研究[J].临床放射学杂志,2013,23(8):1119-1122.
[9] 李勇,黄贤会,张丽红.多层螺旋CT诊断胃肠道间质瘤的价值[J].医学影像学杂志,2014,27(6),59-62.
[10]樊明,刘平安.CT对胃肠间质瘤恶性程度的预测价值[J].安徽医学,2017,38(12),1550-1552.
[11]彭振鹏,孙灿辉,罗宴吉,等.胃肠道间质瘤的CT表现与病理分级的相关性研究[J].中华普通外科学文献(电子版),2013,7(6):461-465.
