加速康复外科护理在腹腔镜胃癌根治术中的应用效果
2018-06-19刘红霞程康文王贵和
刘红霞 程康文 王贵和
胃癌是我国常见的恶性肿瘤,主要以手术治疗为主。越来越多的研究[1-2]表明,腹腔镜胃癌根治手术,安全、可行,可减少术中出血量、减轻术后疼痛、降低术后并发症、加速术后康复、缩短住院时间等。随着医疗模式和理念的转变,医疗护理的目的不仅是常规护理,还要予以相应手段促进患者康复。基于加速康复外科(enhanced recovery after surgery,ERAS)理念的护理是通过术前、术中及术后一系列合理护理措施来减轻机体的应激反应,以利于术后康复。目前ERAS护理已广泛应用于腹部外科各个领域,但ERAS护理在腹腔镜胃癌根治术中的优越性少有报道。为此,本研究通过比较ERAS护理与常规护理对腹腔镜胃癌根治术术中、术后相关指标的影响,探讨ERAS护理在腹腔镜胃癌根治术中的应用效果,具体报道如下。
1 资料与方法
1.1 一般资料 选择2016年11月至2017年12月铜陵市人民医院胃肠外科收治的拟行腹腔镜辅助胃癌根治术治疗的胃癌(经胃镜确诊)患者40例为观察组,围术期组给予ERAS方案进行护理;同时,以2015年12月至2017年12月我科收治的40例腹腔镜辅助胃癌根治术常规护理患者为对照组。两组患者的年龄、性别、体质指数(body mass index, BMI)、手术方式、吻合方式及术后TNM分期等一般资料比较,差异无统计学意义(P>0.05),详见表1。本研究通过我院伦理委员会批准。
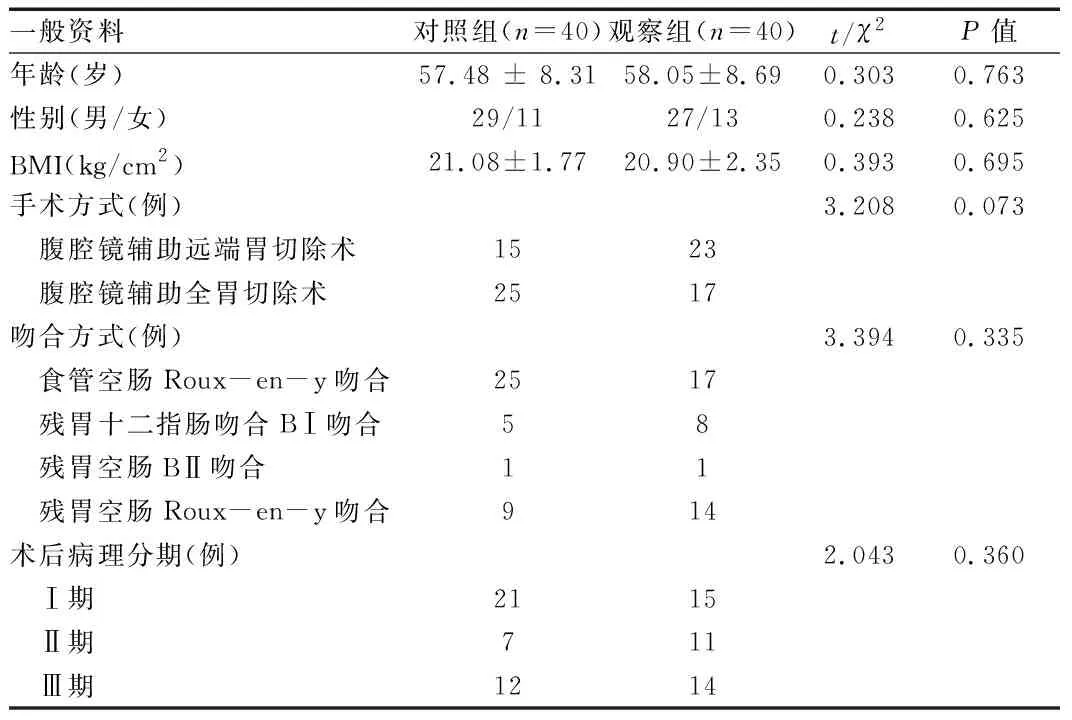
表1 两组患者一般资料比较
1.2 纳入与排除标准 纳入标准:①患者知情同意;②年龄18~75岁;③美国麻醉医师协会评分≤3分。排除标准:①全身状况差,有腹腔镜手术禁忌证;②术前行新辅助化疗患者;③既往诊断胃癌的复发患者;④未行标准D2淋巴结清扫的患者;⑤腹腔镜中转开腹患者。
1.3 手术方式 参照日本第3版《胃癌处理规约》[3]及我国《腹腔镜胃癌手术操作指南(2007版)》[4]行腹腔镜辅助下D2根治术。病灶局限于胃窦行远端胃切除,胃体或胃底可见病灶行全胃切除术。胃窦病灶切除后吻合方式首选Billroth I 式吻合,如果预计张力过大则行胃空Roux-en-Y式吻合;全胃切除后的吻合方式为胃空肠Roux-en-Y式吻合。
1.4 ERAS护理方案 ①术前高年资护士沟通交流,告知相关减少手术应激的措施;②入院后责任护士进行营养风险筛查量表2002进行评分,并常规给予口服肠内营养乳剂能全力(纽迪希亚,1 kcal /mL) 1 L/d,行饮食肠道控制及术前补充营养,对于存在营养风险且经口补充不能满足机体60%热卡需求,给予补充性肠外营养支持;③术前无需清洁灌肠及口服泻药,便秘患者予以口服乳果糖缓泻剂,必要时加用复方聚乙二醇电解质散;④术前晚21:00口服术能(宜昌人福,57.66 kcal/100 mL,每瓶355 mL)2瓶,术前3小时口服术能1瓶;⑤术前不常规放置胃管,术中置入空肠营养管一根;⑥术中使用全身麻醉+胸段硬膜外麻醉(减少阿片类药物的使用),缝皮前切口注射罗哌卡因浸润(75 mg/20 mL),术后根据患者情况术后根据情况使用非甾体类抗炎药氟比洛芬酯,并常规进行视觉模拟评分法(visual analogue scale, VAS)进行疼痛评分,>4分(Ⅱ级以上切口疼痛)追加阿片类止痛药;⑦术中根据桡动脉监测的心脏每搏量实行目标导向液体治疗,术后使用术中限制性补液;⑧术中给予患者保温毯,控制输液温度、温水腹腔冲洗;⑨术中常规放置肝下引流管1根,术后引流量<100 mL,复查CT明确腹腔内无异常及时拔除;⑩术后第1天早上拔除导尿管,如生命体征无异常,停止心电监护,由我科责任护士陪护患者下床活动,并记录下床活动时间及距离;术后第1天开始启动肠内营养百普力(纽迪希亚,0.75 kcal/mL) 20 mL/h小剂量泵控滴入,并给予饮水,之后逐渐增加肠内营养量,并更换为能全力鼻饲,期间同时启动流质饮食,并逐渐减少静脉补液量,直至停止静脉补液。
1.5 常规护理方法 常规宣教,术前禁食12 h、禁饮6 h,并行机械灌肠或口服强效泻药,术后胃管留置4~5 d,术后下床活动采取自愿原则,术后肛门排气、排便后开始逐渐试饮水、饮食。
1.6 观察指标 记录患者术中情况如:补液总量、手术时间、术中出血量;术后恢复情况如:术后通气和排便时间、首次下床活动距手术结束时间、首次经口饮食时间、术后开始肠内营养时间、术后肠外营养使用时间、鼻肠管拔除时间、术后住院时间。出院后1周电话随访(随访间隔时间7天),并通过微信平台延续随访至患者,及时发现术后30 d内相关并发症,如Ⅱ级以上切口疼痛、咽喉疼痛、恶心、腹胀和或腹泻、切口感染、肺部感染、吻合口瘘、肠梗阻发生例数。

2 结果
2.1 两组患者术中及术后相关指标比较 与对照组相比,观察组患者术中补液总量、术后通气时间、术后排便时间、首次下床活动距手术结束时间、术后开始肠内时间、首次经口流质饮食时间、术后肠外营养使用时间、鼻肠管拔除时间、术后住院时间、住院总费用均短于对照组,差异有统计学意义(P<0. 05);观察组术后Ⅱ级以上切口疼痛、咽喉疼痛发生率低于对照组,差异有统计学意义(P<0.05),详见表2。
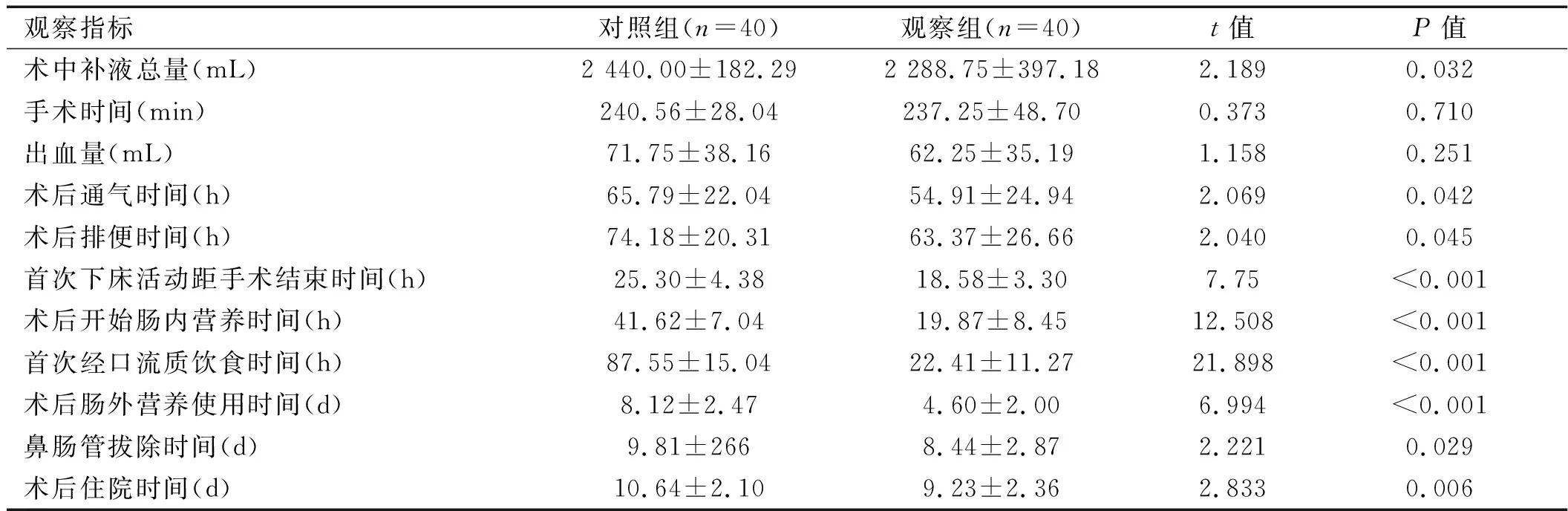
表2 两组患者术中及术后相关指标比较
2.2 两组患者并发症比较 观察组患者Ⅱ级以上切口疼痛及咽喉疼痛的发生率均少于对照组,差异有统计学意义(P<0.05);两组患者发生呕吐、腹胀和或腹泻、切口感染、肺部感染、吻合口瘘、术后肠梗阻并发症比较,差异无统计学意义(P>0. 05),详见表3。出院后1周随访至术后30天,所有患者无需要干预处理的并发症,术后30天无再入院患者。
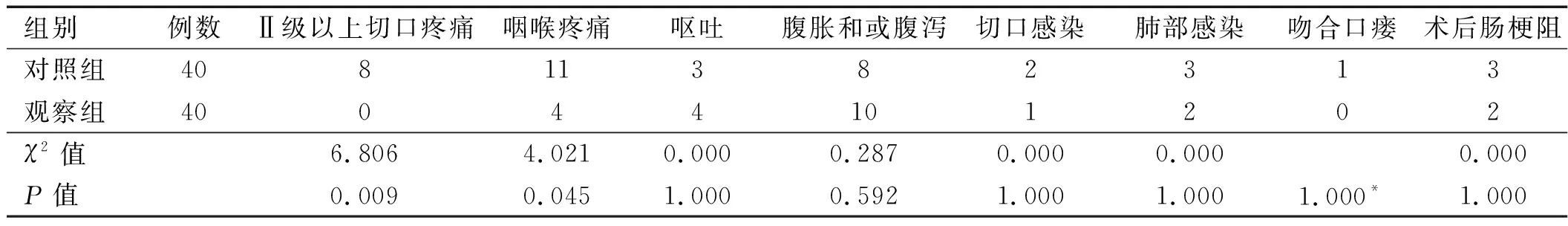
表3 两组患者术后并发症比较(例)
注:*表示Fisher确切概率法
3 讨论
国内外多项研究已表明腹腔镜手术在进展期胃癌中安全、有效[2,5-6],ERAS可减轻围手术期应激反应,保护机体的免疫功能,减轻炎症反应,维持机体内环境生理平衡机制,从而促进术后康复,减少术后并发症[7]。但ERAS在腹腔镜手术中的对比研究较少。因此,本文观察ERAS联合腹腔镜胃癌根治术的治疗效果为ERAS在腹腔镜胃癌根治术应用的可行性及有效性提供依据。
ERAS的术前宣教可减轻患者术前焦虑,是ERAS顺利开展的先决条件。多数ERAS指南不推荐机械性肠道准备,从而避免肠道水电解质的丢失及不适感[8],本组资料中部分患者因术前存在便秘,术前口服复方聚乙二醇电解质散,但是所有患者已摒弃经肛门灌肠及口服硫酸镁或磷酸钠盐等泻药。相关研究[9]认为,术前口服碳水化合物,可减轻术后胰岛素抵抗、避免术前长时间禁食导致口渴及饥饿,有利于术前机体肝脏内肝糖原合成,降低术前体内分解代谢状况,本组所有患者术前均口服碳水化合物。同时采用术中保温保护机体的凝血功能,以降低心血管并发症及切口感染率[10]。术中限制性补液可以避免循环过负荷,过量补液导致术后胃肠道水肿,影响肠功能的恢复,本组资料中,观察组术中平均补液量显著少于对照组(P<0.05)。
镇痛在ERAS中发挥重要作用,目前术后使用胸段硬膜外麻醉镇痛,从而阻断疼痛刺激引起交感神经兴奋导致炎症介质释放增加[11],镇痛中尽量减少阿片类药物的使用,首选非甾体类抗炎药,从而避免阿片类药物对胃肠功能恢复的干扰,本组资料中观察组所有患者术后VAS疼痛评分均<4分,未追加使用阿片类药物,镇痛控制良好,为术后早期下床活动奠定了基础,同时也有利于术后早期肠功能的恢复。
本组患者术后第1天早上即拔除导尿管,以减少感染发生[12],避免导管限制术后早期活动。所有患者均未放置鼻胃管减压,但术后所有患者常规放置较细的鼻肠管至上端空肠,便于术后早期管饲肠内营养,调节肠道微生态,营养肠粘膜细胞,避免术后肠源性感染的发生[13],从而可早期停止静脉补液。观察组患者逐渐恢复经口饮食后,尽早拔除鼻肠管,因长期放置鼻肠管会刺激咽喉部位导致疼痛,早期拔除可提高术后舒适度。本组资料中,观察组启动肠内营养时间早,经口流质饮食时间亦早于对照组,缩短肠外营养使用时间,从而可减少术后输液导致活动不便、避免肠外营养相关并发症,最终促进患者术后康复。
术后早期下床活动是ERAS中的关键因素[14],因早期活动可以促进胃肠功能的恢复、降低术后肺部并发症、减轻胰岛素抵抗、避免术后出现肌肉萎缩、有利于机体的血液循环而降低血栓的发生,此外,研究还表明术后早期活动可减轻术后精神错乱和认知功能障碍[15]。相比对照组,观察组患者术后首次下床活动时间距离手术结束时间较早(P<0.05),且无跌倒现象出现,表明术后早期下床活动安全、可行。
本组资料中,两组患者术后呕吐、腹胀和/或腹泻、切口感染、肺部感染、吻合口瘘、术后肠梗阻的发生率差异无统计学意义,表明ERAS方案在本组资料中是安全有效的,至少不会增加术后并发症发生率,我们前期的对照研究也证实ERAS可缩短住院时间,且不增加术后并发症[16]。
总之,本研究表明ERAS在腹腔镜胃癌根治术中,安全、有效,可促进术后康复。但因本次样本量有限,本结果有待开展大样本、多中心、前瞻性、随机对照研究去证实。
[1] 程康文,王贵和,束宽山,等.腹腔镜辅助与开腹胃癌根治术临床效果及对肠道屏障功能影响的比较[J].中国普通外科杂志,2017,26(4):450-456.
[2] STRAATMAN J, VAN DER Wielen N, Cuesta MA et al: Minimally invasive versus open total gastrectomy for gastric cancer: a systematic review and meta-analysis of short-term outcomes and completeness of resection: surgical techniques in gastric cancer[J]. World J Surg, 2016,40(1): 148-157
[3] Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2010 (ver. 3)[J]. Gastric Cancer. 2011,14:113-123.
[4] 中华医学会外科学分会腹腔镜与内镜外科学组. 腹腔镜胃癌手术操作指南(2007版)[J]. 中华消化外科杂志, 2007, 6(6):476-480.
[5] 仝德峰, 刘江文, 孙琳, 等. 进展期胃癌腹腔镜辅助D2根治术的临床疗效分析[J]. 中国普通外科杂志, 2015, 24(8):1201-1204.
[6] KIM W, KIM HH, HAN SU et al: Decreased morbidity of laparoscopic distal gastrectomy compared with open distal gastrectomy for stage I gastric can-cer: Short-term outcomes from a multicenter randomized controlled trial (KLASS-01)[J]. Ann Surg, 2016,263(1): 28-35
[7] 程康文,王贵和.加速康复外科对腹腔镜胃癌根治术患者炎症因子与免疫功能的影响[J]. 腹腔镜外科杂志,2017,22(1):30-35.
[8] MORTENSEN K, NILSSON M, SLIM K et al. Consensus guidelines for enhanced re-covery after gastrectomy: Enhanced Recovery After Surgery (ERAS©) Society recommendations[J]. Br J Surg, 2014, 101(10): 1209-29.
[9] SVANFELDT M,THORELLl A,HAUSEL J,et al.Randomized clinical trial of the effect of preoperative oral carbohydrate treatment on postoperative whole-body protein and glucose kinetics[J]. Br J Surg, 2007, 94(11) :1342-1350.
[10]SESSLER DI. Complications and treatment of mild hypothermia[J]. Anesthesiology, 2001, 95( 2) : 531-543.
[11]王贵和, 程康文. 加速康复外科对术后近期营养指标的影响[J]. 腹部外科杂志, 2017,22(4):30-35.
[12]杨万玲,黄家丽.快速康复外科护理临床应用现状及启示[J]. 安徽医学杂志, 2013,34(10):1581-1583.
[13]黎介寿. 营养支持治疗与加速康复外科[J]. 肠外与肠内养, 2015,2(2):65-67.
[14]SLIM K, JORIS J. The egg-and-chicken situation in postoperative enhanced recovery progra-mmes[J]. Br J Anaesth, 2017,118(1):5-6.
[15]KURBEGOVIC S, ANDERSEN J, KRENK L, et al. Delirium in fast-track colonic surgery[J]. Langenbecks Arch Surg, 2015,400:513-516.
[16]程康文, 王贵和, 束宽山, 等. 腹腔镜胃癌根治术中应用快速康复外科理念的研究[J].腹腔镜外科杂志, 2016,21(4) :292-296.
