牛磺熊去氧胆酸诱导牙髓干细胞的成骨分化实验研究
2018-06-18陈福扬孙艳艳谭金娣于易秀刘明月史欣胡伟平
陈福扬 孙艳艳 谭金娣 于易秀 刘明月 史欣 胡伟平


[摘要]目的:研究牛磺熊去氧胆酸(Tauroursodeoxycholic acid,TUDCA)对牙髓干细胞 (Dental pulp stem cells,DPSCs)增殖及成骨向分化的作用。方法:用不同质量浓度(0、10、100、30OnM)的TUDCA培养DPSCs,利用甲基噻唑基四唑(Methylthiazolylterrazolium,MTT)法计数检测不同浓度TUDCA对细胞增殖的影响;7d后测定不同浓度TUDCA诱导后的碱性磷酸酶(Alkaline phosphatase,ALP)活性;倒置相差显微镜下观察诱导后的DPSCs形态变化;应用茜素红染色法检测矿化结节的形成。结果:MTT法及ALP活性测定实验表明,随着TUDCA浓度的增加,ALP活性增强,细胞增殖率升高。茜素红染色显示TUDCA诱导培养28d后出现矿化结节。结论:TUDCA可促进DPSC增殖和成骨分化。
[关键词]牙髓干细胞;牛磺熊去氧胆酸;细胞增殖;成骨分化;新型生物材料;组织工程
[中图分类号]R329.2 [文献标志码]A [文章编号]1008-6455(2018)03-0097-04
Taursodeoxycholic Acid Induced the Osteogentic Differentiation Ability of Dental Pulp Stem Cells
CHEN Fu-yang1,SUN Yan-yan2,TAN Jin-di1,YU Yi-xiu1,LIU Ming-yue1,SHI Xin1,HU Wei-ping1
(1.Department of Prosthodontics,the Second Affiliated Hospital of Harbin Medical University,Harbin 150086,Heilongjiang,China;2.Department of Prosthodontics,Xuzhou Stomatology Hospital,Xuzhou 221000,Jiangsu,China)
Abstract: Objective To study the effect of tauroursodeoxycholic acid (TUDCA) on the proliferation and osteogenic differentiation in dental pulp stem cells (DPSCs). Methods Methylthiazolyltetrazolium (MTT) assay was used to evaluate the proliferation rate of DPSCs induced by different concentrations of TUDCA(0,10,100,300nM). The activity of alkaline phosphatase (ALP) after induced by different concentration of TUDCA was measured. We observed the morphologica1 changes of DPSCs by the inverted phase contrast microscope, detected the mineralize nodules stained by Alizarin red. Results The results of MTT and ALP activity measurement showed that ALP activity increased and cell proliferation rate arise with the increase of concentration of TUDCA. Alizarin red staining showed that mineralized nodules have formed after induced by TUDCA for 28 day. Conclusion TUDCA can promote the proliferation and osteogenic differentiation of DPSCs.
Key words: dental pulp stem cells; taursodeoxycholic acid; cell proliferation; osteogenic differentiation; new biomaterials; tissue engineering
组织工程再生或缺损组织修复是目前很有前途的临床治疗方法[1-2]。近年来,许多临床医生和研究人员一直致力于组织工程领域研究,很多研究报道用生物材料和细胞诱导组织再生:包括合成天然蛋白和生长因子[2-5]。虽然组织工程学的研究改进了临床治疗的特异性组织缺损,但是在组织工程中的广泛应用还是受到了限制和障碍,例如功能和新生组织形态维持。在组织工程中骨修复往往缺乏血管和机械强度,很难实现复杂的骨微结构[6]。
以往研究知道,BMP系列、地塞米松具有强大的骨诱导能力。2002年以来,在骨科中一直应用BMP-2、地塞米松。然而,进一步研究和临床应用发现,这些治疗过程中需要大量昂貴的生长因子和细胞因子[7-8],并且细胞毒性和炎症对最后骨组织形成的成功与否都起着重要的作用,从而影响治疗效果[9-10]。因此,需要发现新的药物和因子来增强骨组织再生的成功率和术后效果。化学药物牛磺熊去氧胆酸(Tauroursodeoxycholic acid,TUDCA)的出现和研究对这一难题带来了解决办法。牛磺熊去氧胆酸是一种已被美国食品和欧洲药物管理局批准的药物[11-12]。其具有解痉、抗惊厥、抗炎及溶胆石等作用。临床主要用于治疗胆囊胆固醇结石、原发硬化性胆管炎、原发胆汁性肝硬化和慢性丙型病毒性肝炎等[11-12]。最近报道了TUDCA显著增加了体外骨髓间充质干细胞(Mesenchymal stem cells,MSCs)的成骨化[13]。牙髓干细胞(Dental pulp stem cells,DPSCs)与骨髓间充质干细胞都具自我增殖和多种分化能力,在牙齿再生骨组织工程等方面发挥着重要作用,可以作为骨组织工程研究的理想种子细胞[14-19]。本实验目的是研究新型生物材料牛磺熊去氧胆酸对牙髓干细胞成骨向分化的影响。
1 材料和方法
1.1 材料:胎牛血清(Hyclone,美国);DMEM/F-12(Hyclone,美国);牛磺熊去氧胆酸(Sigma,美国20mg);I型胶原酶(Gibco,美国);0.25%胰酶(上海碧云天生物技术研究所);青霉素和链霉素(上海碧云天生物技术研究所);磷酸盐缓冲液(Phosphate-buffered saline,PBS);茜素红(Alizarin red S,Sigma,美国);碱性磷酸酶试剂盒(南京建成生物工程研究所,南京);甲基噻唑基四唑(Methyl thiazolyl tetrazolium,MTT)、DMSO、抗坏血酸、B-甘油磷酸钠、L-谷氨酰胺、地塞米松(Sigma,美国)。
1.2 牙髓干细胞的分离、培养、传代及鉴定:选择哈尔滨医科大学附属第二医院口腔外科门诊采集的因正畸拔除的正常前磨牙或阻生的正常第三磨牙(患者年龄14~25岁),所有成年患者及未成年患者家属均知情同意。依据Gronthos[15]原代细胞培养法,劈开实验牙,用镊子取出牙髓,含双抗PBS充分冲洗置于体积分数为0.3%的I型胶原酶培养皿中将牙髓组织剪成约1mm×lmm×1mm的组织块,移入离心管中在37℃的水域振荡器中消化40min,去除上清液, 加入4ml含20%胎牛血清的培养液,l 000×g离心5min,共离心2次,去上清液,加入3ml培养液吹打混匀,最后移入培养瓶中,37℃含5% CO2的培养箱中培养,每周换液2次。电镜下观察到细胞呈成纤维细胞样形态,为牙髓干细胞典型形态。待细胞覆盖瓶底的80%左右时,0.25%胰蛋白酶消化,以1:2的比例传代。
1.3 传代培养DPSCs:擦拭超净工作台,紫外灯下照射消毒30min。倒置相差显微镜下观察细胞的数量和形态,置于超净工作台上,倒掉培养瓶中的培养基,PBS溶液清洗3次。将胰酶消化液1~2ml置于培养瓶中,后将培养瓶置于培养箱中30s。将培养瓶自培养箱中取出,倒置相差显微镜下观察细胞形态,当细胞由长梭形变为圆形时立即终止消化。于超净工作台上倒掉胰酶消化液,加入10ml含15%胎牛血清的DMEM/F-12培养液,用吸管将贴附于瓶壁的细胞吹打脱落。
1.4 DPSCs多向分化能力(成脂,成软骨,成骨):取第3代DPSCs细胞,分别用成骨细胞诱导的培养液为5mM β-glycerophosphate,50mg/ml vitamin-C-phosphate 和2mM L-glutamine,培养3周。用成脂肪细胞诱导的培养液为50μmol/L indomethacin,0.5μmol/L isobutylmethylxanthine和0.5μmol/L dexamethasone,培养2周。用成软骨细胞诱导的培养液为6μg/ml Insulin,10ng/ml TGF-β1,95μmol/ml dexamethasone,37mg/ml vitamin-C-phosphate,0.8μmol/ml sodium Pyruvate,6μg/ml转铁蛋白。然后用油红O染色检测向脂肪细胞的诱导情况;甲苯胺蓝染色检测向成软骨细胞的诱导情况;茜素红(Alizarin Red S)染色检测成骨细胞诱导情况。
1.5 MTT法检测细胞增殖情况:实验共分4组,每组设6个复孔,将第3代DPSCs以5 000个/孔接种于96孔板中,培养24h后更换为含有不同质量浓度的TUDCA(0、10、100、30OnM)培养液继续培养,分别于培养后第l、3、5、7、9天用MTT法检测细胞增殖情况。
1.6 碱性磷酸酶(Alkaline phosphatase,ALP)活性测定:将第3代DPSCs以5 000个/孔接种于96孔板中,培养24h后分别用含有不同质量浓度的TUDCA(0、10、100、30OnM)培养液继续培养,每组6个复孔,于诱导培养的第7天弃去培养板中的培养液,在每孔中加入1% TritonX-100裂解液30μl覆盖满细胞,裂解30min,按说明书操作,加入基质液和缓冲液各5Oμl,充分混匀后37℃水浴15min,加入显色剂150μl,用酶标仪测量490nm处吸光度值(A490nm),比较各组细胞ALP活性。
1.7 茜素红矿化结节染色测定:将第3代细胞以1×105个/孔接种于6孔板中,分为4组,24h后将培养液更换为含有不同质量浓度TUDCA(0、10、100、30OnM)培养液培养。培养至28d进行茜素红染色,PBS缓冲液冲洗3次,95%无水乙醇固定15min,蒸馏水冲洗3次,0.1%茜素红-Tris-HC1(pH=8.3)37℃孵育30min,蒸馏水冲洗,干燥,拍照,观察各组矿化结节形成情况。
1.8 统计学分析:应用SPSS 17.0统计软件对结果数据进行处理,行单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 细胞培養情况:原代培养DPSCs,细胞在第4天贴培养瓶壁生长,随后至第7天形成克隆细胞团并具有典型的成纤维细胞样形态。培养14d后,克隆的细胞形态更统一,具有成纤维形态和长细胞突,平行排列并达到足够数量等待传代。传代后,细胞增殖迅速。见图1。
注:A.DPSCs培养第4天的形态;B.DPSCs增殖至第7天,典型的成纤维样形态;C.细胞排列呈栅栏状;D.DPSCs传代后,增殖进入活跃期
图1 DPSCs 细胞形态(40×)
2.2 DPSCs多向分化能力体外鉴定结果:细胞成脂诱导3周,成骨诱导矿化结节形成,显示矿化成功,见图2A;油红O染色形成中间为空泡的脂肪细胞,见图2B;细胞成软骨诱导3周,甲苯胺蓝染色形成蓝色结节,见图2C。
注:A.Alizarin Red S检测成骨分化的矿化基质沉积情况;B.成脂分化显示通过Oil Red O染色中性脂质聚集;C.甲苯胺蓝染色检测成软骨分化情况
图2 DPSCs多向分化能力检测结果(40×)
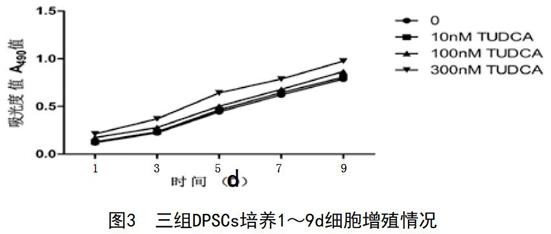
2.3 细胞增殖MTT检测结果:3组DPSCs在1~9d均呈现不同程度的生长状态。3种不同质量浓度的TUDCA对牙髓干细胞都有促进作用,并且随着TUDCA的浓度的升高促进增殖作用逐渐提高,特别是含300nM TUDCA组与其他组相比差异明显,10nM TUDCA组与培养液组相比无明显差距。见图3。
图3 三组DPSCs培养1~9d细胞增殖情况
2.4 ALP活性检测结果:将第3代DPSCs诱导9d后,牛磺熊去氧胆酸对人牙髓干细胞ALP活性有促进作用,对照组、10nM、100nM、300nM TUDCA组的ALP活性分别为0.08403±0.06275、0.20808±0.0835、0.26392±0.0846、0.38267±0.1022,各实验组与对照组比较,差异有统计学意义(P<0.05)。
2.5 矿化结节检测结果:取克隆化第3代DPSCs培养28d,可见部分细胞发生成骨细胞样多角形以及锥体形态改变。DPSCs在矿化诱导后逐渐产生白色点状晶体。经茜素红染色后光学显微镜下均可見橘红色矿化结节,呈团状或条状不规则形态。对比后发现300nM TUDCA组可见数目多、面积较大的橘红色矿化结节,因此证明成骨活性活性更强(见图4)。
注:A.10nM TUDCA组;B.100nM TUDCA组;C.300nM TUDCA组
图4 牙髓干细胞矿化诱28d后矿化结节染色结果(茜素红染色低倍放大,40×)
3 讨论
牙髓间充质干细胞是种子细胞,来源广泛,取材方便,具有自我更新和多向分化能力,体内、体外实验均已证实其具有很强的成骨能力。种子细胞是作为骨组织工程的关键因素,探寻合适的对象,优化培养条件,真正实现体外成骨,形态可塑,对治疗严重骨缺损具有重要的意义[20-25]。从目前研究来看,虽然组织工程学的研究改进了临床治疗的特异性组织缺损,但是在组织工程中的广泛应用还是受到限制和障碍,例如功能和新生组织形态维持。在组织工程中骨修复往往缺乏血管和机械强度,很难实现复杂的骨微结构[6]。
以往研究发现,BMP系列、地塞米松等都具有强大的诱导骨组织再生的能力,也已经在临床得到了进一步应用和发展,但是正是在不断的发展中,发现了各种问题,其不仅价格昂贵,还具有细胞毒性和术后炎症反应,对于最终临床患者的应用带来了一定风险和不良预后。近几年,越来越多的研究者们正在尝试各种新型生物材料,而牛磺熊去氧胆酸的研究与进展给予了骨组织工程希望。
牛磺熊去氧胆酸作为一种治疗痉挛、抗惊厥、抗炎及溶胆石等作用的药物,随着Byung-Hyun Cha等[13]研究发现牛磺熊去氧胆酸可以促进骨髓间充质干细胞的成骨分化,通过抑制骨髓间充质干细胞的成脂分化。骨髓间充质干细胞和牙髓间充质干细胞都是作为种子细胞,属于多能干细胞。通过牛磺熊去氧胆酸对于体内小鼠的骨再生的研究,发现小鼠骨再生的支架生物相容性非常好,能够增加置入组织的血管化,血管化、骨再生和骨融合是骨缺损移植修复的重要环节。这使得骨髓间充质干细胞与牛磺熊去氧胆酸之间相互作用的研究成为了热点。
ALP是一种分泌型蛋白,他的表达是成骨细胞分化的早期指标,参与钙化组织的形成、代谢和再生,其活性的高低可以反映不同组织、细胞的矿化能力以及向成骨方向分化的趋势。间充质干细胞矿化的另一个经典指标是矿化结节,是一种比ALP更晚期的检测指标。在本实验中通过MTT检测显示细胞在加入TUDCA培养液的第9天已到达细胞增殖的顶峰,同时检测了第9天ALP的活性,300nM组的ALP活性变化最显著。根据Byung-Hyun Cha等研究[13],为了能够更好地取得实验效果,本次将TUDCA的质量浓度分为(0、10、100、30OnM)4组,0nM作为对照组。MTT结果显示TUDCA作用后的DPSCs的增殖情况和成骨分化能力的改变,表明TUDCA具有促进DPSCs增殖的能力。这与TUDCA在骨髓间充质干细胞研究结果一致。不同质量浓度TUDCA的ALP活性呈现递增的趋势,本次分组中300nM组活性最高,各组间比较差异具有统计学意义。随后又继续进行茜素红染色实验,得出的结论与MTT,ALP的检测结果一致。
牛磺熊去氧胆酸对于骨髓间充质干细胞有促进成骨分化的作用。本次实验结果显示,TUDCA对于牙髓干细胞的成骨分化具有重要作用。对于开展口腔颌面部缺损的修复带来一次机遇。300nM TUDCA实验组对于牙髓干细胞的成骨分化促进效果最明显,证实牛磺熊去氧胆酸诱导人DPSCs是一种可行、有效的促进成骨活性的方法,与之前的实验结果一致。
牛磺熊去氧胆酸作为一种药物,在临床应用中才能证实其在骨再生方面的能力,应进一步实验研究其在体内的成骨作用,并对牙髓间充质干细胞成骨分化的潜在药物作用机制进一步研究。为了最大限度地提高骨形成和减少潜在副作用,应用动物实验确定药物最佳剂量,进行大型动物实验以确定骨再生效果。
综上,本研究表明TUDCA能促进DPSCs分化为骨组织,尽管需进一步进行体内试验,但此研究表明了一种新型的促进成骨分化的新型生物材料,牛磺熊去氧胆酸有着广阔的研究前景。
[参考文献]
[1]Langer R,Vacanti JP.Tissue engineering[J].Science,1993,260:920-926.
[2]Shin H,Jo S,Mikos AG.Biomimetic materials for tissue engineering[J].
Biomaterials,2013,24(24):4353-4364.
[3]Cha BH,Kim JH,Kang SW,et al.Cartilage tissue formation from dedifferentiated chondrocytes by codelivery of BMP-2 and SOX-9 genes encoding bicistronic vector[J]. Cell Transplant,2013,22(9):1519-1528.
[4]Cheng Z,Teoh SH.Surface modification of ultra thin poly (epsilon-caprolactone) films using acrylic acid and collagen[J].Biomaterials,
2014,25(11):1991-2001.
[5]Jeong SI,Kwon JH,Lim JI,et al.Mechano-active tissue engineering of vascular smooth muscle using pulsatile perfusion bioreactors and elastic PLCL scaffolds[J].Biomaterials,2005,26(12):1405-1411.
[6]Butler DL,Goldstein SA,Guilak F.Functional tissue engineering: the role of biomechanics[J].J Biomech Eng,2000,122(6):570-575.
[7]Liporace FA,Breitbart EA,Yoon RS,et al.The effect of locally delivered recombinant human bone morphogenetic protein-2 with hydroxyapatite/tri-calcium phosphate on the biomechanical properties of bone in diabetes-related osteoporosis[J].J Orthop Traumatol,2015,16(2):151-159.
[8]Kang SW,Kim JS,Park KS,et al.Surface modification with fibrin/hyaluronic acid hydrogel on solid-free form-based scaffolds followed by BMP-2 loading to enhance bone regeneration[J].Bone,2011,48(2):298-306.
[9]Bosch P,Musgrave D,Ghivizzani S,et al.The efficiency of muscle-derived cell-mediated bone formation[J].Cell Transplant,2000,9(4):463-470.
[10]Ito C,Evans WE,McNinch L,et al.Comparative cytotoxicity of dexamethasone and prednisolone in childhood acute lymphoblastic leukemia[J].J Clin Oncol,1996,14(8):2370-2376.
[11]Kars M,Yang L,Gregor MF,et al.Tauroursodeoxycholic acid may improve liver and muscle but not adipose tissue insulin sensitivity in obese men and women[J]. Diabetes,2010,59(8):1899-1905.
[12]Ozcan U,Yilmaz E,Ozcan L,et al.Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse modelof type 2 diabetes[J].Science,2006,313(5790):1137-1140.
[13]Cha BH,Jung MJ,Moon BK,et al.Administration of tauroursodeoxycholic acid enhances osteogenic differentiation of bone marrow-derived mesenchymal stem cells and bone regeneration[J].Bone,2016,83:73-81.
[14]張智慧,胡伟平,郭阳,等.SHH和bFGF体外诱导人牙髓干细胞向神经细胞分化的研究[J].口腔医学研究,2010,26(5):631-635.
[15]Gronthos S,Brahim J,Li W,et a1.Stem cell properties of human dental pulp stem cells[J].J Dent Res,2002,81(8):531-535.
[16]Nakatsuka R,Nozaki T,Uemura Y,et a1.5-Aza-2,-deoxycytidine treatment induces skeletal myogenic differentiation of mouse dental pulp stem cells[J].Arch Oral Biol,2010,55(5):350-357.
[17]张晓艳,李小彤,曾祥龙.矿化液诱导人前磨牙牙髓干细胞向成骨细胞样细胞的分化[J].上海口腔医学,2010,19(4):398-402.
[18]DAlimonte I,Nargi E,Mastrangelo F,et a1.Vascular endothelial growth factor enhances in vitro proliferation and osteogenic differentiation of human dental pulp stem cells[J].J Biol Regul Homeost Agents,2011,25(1):57-69.
[19]Karbanova J,Soukup T,Suchanek J,et a1.Osteogenic differentiation of human dental pulp—derived stem cells under various ex-vivo culture conditions[J].Acta Medica(Hradec Kralov-e),2010,53(2):79-84.
[20]Akintoye SO,Lam T,Shi S,et a1.Skeletal site-specific characterization of orofacial and iliac crest human bone marrow stromal cells in same individuals[J].Bone,2006,38(6):758-768.
[21]Yang X,van den Dolder J,Walboomers XF,et a1.The odontogenic potential of STRO-1 sorted rat dental pulp stem cells in vitro[J].J Tissue Eng Regen Med,2007,1(1):66-73.
[22]Arthur A,Rychkov G,Shi S,et a1.Adult human dental Pulp stem cells differentiate toward functionally active neurons under appropriate environmental cues[J].Stem Cells,2008,26(7):1787-1795.
[23]Struys T,Moreels M,Martens W,et a1.Ultrastructural and immunocytochemical analysis of multilineage differentiated human dental pulp-and umbilical cord-derived mesenchymal stem cells[J].Cells Tissues Organs,2015,193(6):366-378.
[24]Paino F,La Noce M,Tirino V,et a1.Histone Deacetylase inhibition with Valproic Acid down-regulares Osteocalcin gene ex-pression in Human Dental Pulp Stem Cells and Osteoblasts:Evi-dence for HDAC 2 involvement[J].Stem Cells,2014,32(1):279-289.
[25]Inoue T,Sugiyama M,Hattori H,et a1.Stem cells from human exfoliated deciduous tooth-derived conditioned medium enhance recovery of focal cerebral ischemia in rats[J].Tissue Eng Part A,2013,19(1-2):24-29.
