试谈突破“元素化合物”复习难点的有效方法
2018-06-15陈方
陈方
[摘 要]
对2016年和2017年,江苏、上海两省市高考化学卷中涉及元素化合物知识的考点进行统计和分析。提出了突破元素化合物知识学习难点的方法,特别是在复习中要注意引导学生用所学理论知识(概念),来指导元素化合物知识学习的观点。详细阐述了用相关理论(概念)来分析、理解有关化学反应的方法,以提升学生的化学学科素养,突破“元素化合物”复习的难点,减轻学生学习负担,提高复习效率。
[关键词]
高中化学;化学方程式;元素化合物
一、有关背景
人教版高中化学教材主要是在《化学1》中呈现元素化合物知识。由于学段、课时等原因,与以往的教材相比,该部分内容显得较为浅显,且由于采用横向编排(注意了同类物质间的比较),知识的系统性(如同种元素及其化合物间的转化关系等)不够。在复习无机元素及其化合物之前,学生往往感觉到元素化合物知识内容多而繁杂,复习时记忆量很大,特别是对于化学方程式的书写,学生的错误五花八门,特别的混乱。尤其是他们不能用相关理论去理解和分析相关化学反应,这使得许多元素化合物知识成为无源之水无本之木,这对于元素化合物知识的学习非常不利,成为“元素化合物”复习的难点所在。
化学方程式是简洁、概括地认识和理解化学的工具;是我们学习化学的独特语言和符号;是化学学科区别于其他学科的最典型特征;也是各地高考化学试卷中不可或缺的亮丽的风景线。而有关化学方程式的书写,是考查元素化合物知识的最直接和最主要的方式。现将2016年和2017年江苏和上海化学高考卷中直接考查方程式书写或应用的考点以及牵涉方程式考查的考点(有机反应未列出)列举说明如下:
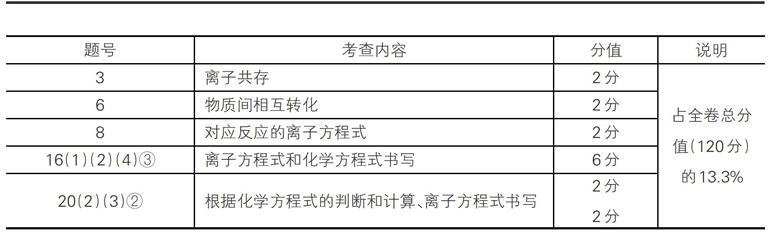
2016年江苏卷:
另外,像第1题(燃料的环保问题,2分)、第4题(物质的性质和应用,2分)、第7題(由相关反应进行分析判断,2分)、第11题(由水解、电解等反应分析有关问题,4分)、第13题(涉及相关反应的实验考查,4分)、第16题(4)①②(由性质判断气体的分步吸收或收集,4分)等,都牵涉到对方程式的考查。它们的总分值占全卷总分值的15%,两项合计占28.3%。
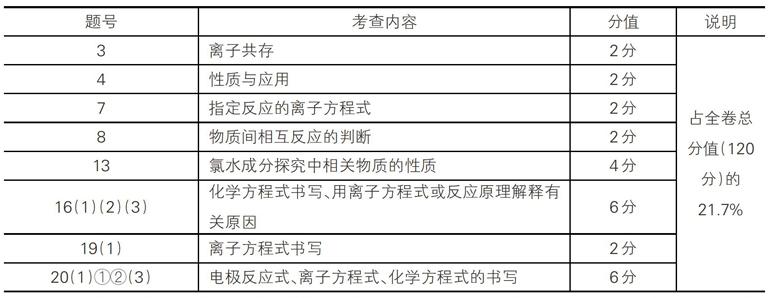
2017年江苏卷:
另外,像第6题(由有关反应判断电子转移数,2分)、第11题(对水解、等反应原理的分析判断,4分)等,也牵涉到对方程式的考查。两项合计也占全卷总分的26.7%。
2016年上海卷:
此外,像第6题(侯氏制碱法,3分)、第14题(锌、铁与酸等反应原理分析,3分)、第18题(氧化还原反应中的计算,4分)、第22题(涉及CuS和Cu2S相关反应的计算,4分)、第41题(围绕硫酸和亚硫酸钠反应及亚硫酸钠被氧化的计算,4分)、第十一题(围绕碳酸氢钠和碳酸钠性质的计算,14分)等,都牵涉到对方程式书写及运用的考查。它们的总分值占全卷总分值的21.3%,两项合计多达41.3%。
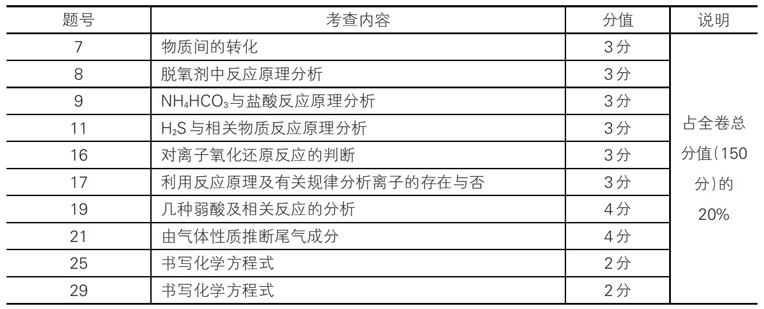
2017年上海卷:
此外,像第8题(推测BeCl2的性质,3分)、第12题(对有关电化学反应原理的分析,3分)、第15题(模拟“候氏制碱法”实验中的有关操作,3分)、第16题(围绕砒霜有关反应的计算,3分)、第22题(由CO2参与反应的沉淀量的计算,4分)、第36、37题(碳酸氢钠与盐酸反应的计算与分析,6分)、第39题(盐酸和漂粉精反应的计算,2分)、第十题(围绕硫酸、硫化氢等有关反应的计算,14分)等,都牵涉到方程式书写及运用的考查。它们的总分值占全卷总分值的25.3%,两项合计更是高达46%。分析统计其他省、市高考化学试题,发现有相似的情况。因此,在复习元素化合物知识时,对化学方程式的理解、分析和掌握就成了重中之重。
而Ⅱ卷中对元素化合物知识的考查,常常结合有关反应原理进行,以强调理论知识对元素化合物知识的指导作用。如江苏卷2016年16题考查H2O2氧化Fe2+的反应及硫与热的NaOH溶液的歧化反应,20题考查Na2HPO4溶液加CaCl2溶液酸碱性变化所涉及的反应;2017年16题涉及Al3+水解平衡移动的相关反应。综上所述,从氧化还原反应原理、反应速率概念、化学平衡、水解平衡的理论等角度,来理解和书写有关反应成了近几年江苏高考的重要特点之一。
复习课旨在通过“温故”,帮助学生强化已学过的知识,并达到知新、悟出新意、加深理解、融会贯通、系统地掌握所学知识的目的。[1] 《普通高中新课程方案导读》中提到“(2)教师在以各种表征的方式呈现重要的内容时,应该尽量以强而有力的观念为核心,将其组织成为相互关联的资讯网络,以便学生能以统整的方式来汲取这些内容;(3)教师在讲解与诠释内容时,应该以这些重要的观念及其间的关联为焦点;” [2]我们认为,元素化合物知识是学习化学基本概念和理论、化学计算、化学实验、化学反应原理等的基础和载体,因此对这部分知识的学习是非常重要的。复习中要特别注意引导学生运用物质结构和元素周期律(表)理论、氧化还原反应理论、电解质溶液理论、化学平衡理论对有关反应的书写进行思考和分析,这也体现了理论知识(概念)对元素化合物知识学习的指导作用,是突破复习中难点的最重要的方法。此外,引导学生从物质属类的角度去理解物质的性质;通过典型案例,使学生逐步认识和体会研究物质性质的一般过程和方法等,也能起到突破复习中难点的效果。
二、突破元素化合物知识学习难点的方法
(一)充分发挥理论知识(概念)对元素化合物学习的指导作用
1.利用氧化还原反应理论
如书写SO2与酸性KMnO4(Fe3+)溶液反应的离子方程式,可按写出氧化剂(还原剂)、氧化产物(还原产物)→用电子得失守恒配平氧化剂(还原剂)、氧化产物(还原产物)的计量数→结合溶液酸碱性用电荷守恒配平H+ (OH-)、H2O的计量数→用原子守恒配平其他微粒的计量数→检查。实际上,所有离子型氧化还原反应方程式的书写都可采用以上方法程式化地进行。
2.利用电解质溶液理论及离子反应的概念
对于溶液中的离子反应,可从能否在反应中产生挥发性物质、难溶物、难电离物质(即能否通过反应来减小反应物的浓度)去理解和分析。如SO32-(HSO3-)、CO32-(HCO3-)与H+反应,Ca(OH)2与NaHCO3反应,饱和NaCl 溶液中通NH3和CO2(侯氏制碱法)的反应,Fe3+与SCN-的反应等。
3.利用化学平衡理论
如对高温下SiO2与CaCO3(Na2CO3)的反应,可从产生的CO2的挥发性对相关平衡的影响去考虑;从Na、K的沸点高低去认识,在一定温度下Na+KCl[]K↑+NaCl这一反应的发生;从NH3+H2O[]NH3·H2O[]NH4+ +OH-去理解NH4+与OH-的反应;从H+ +AlO2-+H2O[]Al(OH)3[]Al3++ 3OH-平衡的存在,去分析理解从Al3+、AlO2-的溶液中得到Al(OH)3的方法,而且对于诸如向NaAlO2溶液中通入少量(过量)CO2的反应也能顺利写出。
4.利用物质结构和元素周期律(表)理论
如通過N2的分子结构去理解和N2与H2、O2等反应的条件;通过Si与Al在周期表中位置的关系去分析Si、Al与NaOH反应的相似性等;通过对角线规则去理解Be与Al、Li与Mg的单质及其化合物性质的相似性;从S、Cl两种元素在周期表中的位置及两种原子结构上的异同去理解S和Cl2分别与Fe、Cu反应的产物的差异等;用同周期(同主族)元素原子结构及元素性质递变规律去理解同周期(同主族)金属(非金属)单质与氧气、水、酸、盐等(与氢气)反应条件的差异或反应产物的不同。
5.利用溶液酸碱性强弱
我们在学习诸如:CO2 +H2O+Na2SiO3[ ]Na2CO3+ H2SiO3↓、CO2 +H2O+2Na ClO[ ] Na2CO3+2HClO等反应,以及分析CO2通入CaCl2溶液中、SO2通入BaCl2溶液中、H2S通入FeCl2溶液中等不能发生反应时,习惯用“强酸能制备弱酸”的观点去理解。其实,此类反应的一般模式为“较强酸性物质+较强碱性物质→较弱酸性物质+较弱碱性物质”。这样我们就不难理解如:CO2 +H2O+ Na2CO3[ ]2NaHCO3及CO2 +H2O+→+ NaHCO3(而不是Na2CO3)等反应。而当出现H2S与Cu2+、Cl2与H2S、NaCl固体与H3PO4等反应,看似违背“强酸制备弱酸”反应规律时,我们会尝试用溶度积的概念、氧化还原反应理论、平衡移动原理去认识和分析。
6.利用水解反应原理
我们在学习诸如:Al2S3、Mg3N2、CaC2(甚至Na2O2)与 H2O等反应时,可利用水解原理分析。即将这些物质中的阴阳离子分别与水电离出的H+ 或OH-结合,生成两种新的化合物,再进行配平即可。按照这样的程序和思路去分析,如Al3+与AlO2-的双水解、泡沫灭火器中反应时的反应原理问题(甚至许多有机物水解的反应问题)等均可迎刃而解。
(二)注重从物质属类的角度去理解物质的性质
首先各类物质有各类物质的通性。如:活泼金属(Na、Mg等)与非金属(O2、Cl2等)、H2O、H+、盐等反应;活泼非金属(如Cl2、S等)与金属(Fe、Cu等)、H2、碱等反应。这将有助于我们理解如:S与NaOH溶液反应跟Cl2、Br2与NaOH溶液反应的相似性等。再如酸性氧化物(如SO2、SO3、CO2等)与H2O、碱性氧化物(如Na2O、CaO等)、碱【如NaOH、Ca(OH)2等】等反应;两性氧化物(两性氢氧化物)与H+ 、OH-反应;难溶性碱的生成与分解规律(如用Fe3+、Al3+与强碱或NH3·H2O反应来制备Fe(OH)3、Al(OH)3,以及难溶性碱可加热分解为对应氧化物);氧化性酸(如浓H2SO4、浓HNO3)与金属(如Fe 、Al、Cu等)及非金属(如C等)的反应规律。从这一角度去分析、理解物质的性质,将为我们解决相关问题插上联想的翅膀。
(三)引导学生学会用类比、归纳、演绎等科学思维方式去理解相关反应
在学习硫及其化合物性质时,可引导学生总结出硫及不同价态的硫的化合物间的变化规律如下:
在学习了SO2+Cl2+H2O[ ]H2SO4+2HCl反应后,如将氧化剂从Cl2→Br2→I2进行变换,反应类似;再将还原剂从SO2→H2SO3→Na2SO3进行变换,反应本质仍然相似,这样一下可将九个反应纳入同一反应原理中。又如+4价S(包括SO2 、H2SO3、Na2SO3等)均可在一定条件下被O2等氧化剂所氧化,如:2SO2+O2 [催化剂△]2SO3 (工业制硫酸的一步重要反应)、2H2SO3+O2[ ]2H2SO4 (酸雨酸性增强的原理)、2Na2SO3+O2[ ]2Na2SO4(Na2SO3变质的原因)等反应,不但形似,而且神似【如n(还原剂):n(氧化剂)均为2:1等】。再如Fe2+被X2(如Cl2、Br2)、H2O2等氧化,Fe3+被I-、S2-等还原,均分别具有高度的相似性,学习时可“一网打尽”。
(四)使学生逐渐认识和体会研究物质性质的一般过程和方法
例如SO2是一种典型的酸性氧化物,在学习其化学性质时,首先研究其属类,由属类理解其通性;再由SO2中硫元素的化合价为+4价,处于中间价态,显然它既有氧化性,又有还原性,且以还原性为主(如SO2被O2、X2 、Fe3+ 、KMnO4、HNO3等氧化);最后再研究其有无特性,如SO2具有漂白性,能使品红褪色(其漂白原理区别于H2O2、HClO、活性炭等)。这样的学习脉络分明、思维流畅。
(五)通过结点连线成网,从整体的高度把握元素化合物知识的学习
复习课教学应从“罗列知识”向“建构整理”转变。复习课所涉及的知识是以往的教学中比较零散地学到的,复习时将这些有内在联系的知识建构成一个有机的整体非常重要。[3]故教学中我们可引导学生按照“知识主线→知识点→知识网”的方式,将知识条理化、系统化、结构化和网络化。具体地说,首先依据新教材所呈现的元素化合物的相关知识,结合学生的认知规律,帮助学生总结出中学所学的5种主要金属(Na 、Mg 、Al 、Fe 、Cu)及5种主要非金属(Cl、S 、N、C、Si)的元素化合物知识的主线。
可用下列主线串联和统摄金属元素化合物知识主线:
由知识主线引出各主要知识点,知识点给出了研究元素化合物的方法和重点。而对每个知识点,又可引导学生按下图进行联想复习:
显然,元素及其化合物的性质、存在、制法和用途等知识不是孤立的,互不相关的,而是互相联系的,其中各类物质的性质是最核心的内容,也是学习过程中必须要形成的 “坚强核心”。
最后可把相关知识点进行联系,使学生得到整体的、互相联系的、结构化的并便于提取和应用的知识网络(知识网)。让学生掌握学习元素化合物知识的一般方法,变无序记忆为有序储存。此外,还可在不同元素间进行串接和联系【如Al ~Fe(铝热反应)、卤素~ Na(电解饱和食盐水,制漂白粉或漂白液、)Fe~ S 、N(氧化还原反应)】等。
三、结语
通过以上分析,用相关理论(观念)来指导元素化合物知识的学习、从物质属类的角度去理解物质的性质、从整体的高度来统整和把握元素化合物知识的学习等,既能提高学生学习化学的档次和品味,提升学生的化学素养;更能起到突破“元素化合物”复习的难点,达到事半功倍的学习效果,从而提升了复习课的效率。
[参 考 文 献]
[1]刘家访.上课的变革.北京:教育科学出版社,2007:115.
[2]钟启权.普通高中新课程方案导读.上海:华东师范大学出版社,2003:137.
[3]刘家访.上课的变革.北京:教育科学出版社,2007:117.
(责任编辑:张华伟)
