关注知识生长 引导深度学习
2018-06-15黄爱民
黄爱民

[摘 要]
分析知识生长的走向、路径、关键点,设计深度学习的问题,关注知识的生长、引导学生进行深度学习。
[关键词]
初中化学;知识的生长;深度学习
教材所呈现多是生长后的知识经过整理的面貌,是静态的和文本的,这也是师生会形成以记忆和再现为主的浅层学习的原因之一。然而如果教师做一个有心人,将同一主题不同学段的教材联系起来,就会发现知识生长的走向,如果再将这些走向中缺失的部分给揭示出来,则可以较为清晰地看到知识生长的具体路径;此时,若教师能找出这个知识生长的具体路径的关键点,设计出深度学习问题用于教学,则必定能促使学生进入深度学习状态。下面以必修2“化学反应速率”为例进行说明,以供大家参考。
一、“化学反应速率”知识生长的走向的分析
知识的生长遵循着由浅表到深入、由简单到复杂、由定性到定量等一般规律。为了更为清楚地找出知识生长走向,特将由同一主编编写的沪教版初中化学教材与苏教版化学必修2“化学反应速率”联系起来,寻找知识和方法两个维度上的生长的走向;具体如下:
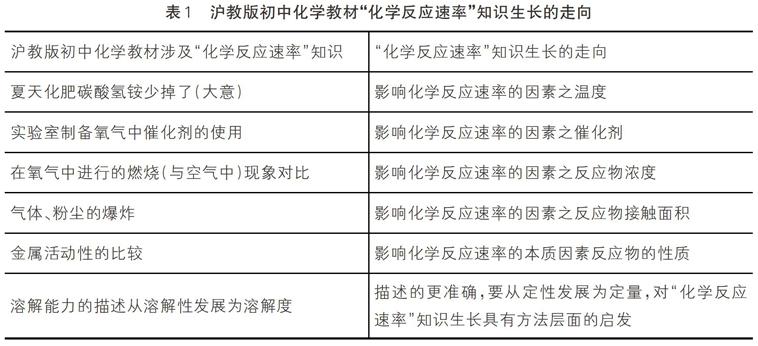
沪教版初中化学教材中有时用反应激烈程度来描述反应快慢,有时直接使用反应快慢;联系苏教版化学必修2“化学反应速率”的內容,可分析出其“化学反应速率”知识生长的走向。见表1。
表1 沪教版初中化学教材“化学反应速率”知识生长的走向
附注:初中物理中对运动快慢用速率的描述,对“化学反应速率”从定性发展为定量有技术层面的,即如何定量化有重要启发。
二、“化学反应速率”知识生长具体路径的分析
当知识生长的走向清楚后,就要进一步分析知识生长的具体路径,但这个具体路径经常是草蛇灰线,需要发挥教师的主观能动性才能补充成功的,因而它又可能是多样化的,但无论怎样的多样化,它都必须是科学合理的。“化学反应速率”知识生长具体路径如下:
由知识生长的走向分析知道:①反应物性质是决定化学反应快慢的内在的本质因素; 通过研究反应快慢去比较反应物的一些性质,这当然是研究反应快慢的价值之一,然而研究反应快慢的重要价值还在于我们想调控反应的快慢,使化学反应合适地应用于生产与生活。因此与之相联系的生长具体路径是:研究影响化学反应快慢的外在的可变因素及其对反应快慢的影响,②发现了定性描述的不足;因而与之相联系的生长具体路径是:产生定量描述化学反应快慢的想法,进而研究具体的定量化方式。“化学反应速率”知识生长的路径具体如图1所示:
图1 “化学反应速率”知识生长具体路径
三、“化学反应速率”知识生长具体路径关键点的分析
知识生长具体路径关键点一是指知识生长的由浅表到深入、由简单到复杂、由定性到定量等的生长节点,二是指知识生长中难以理解的易混易错点。“化学反应速率”知识生长具体路径关键点包括:①生长节点:对比分析法(即控制变量法)、运用对比分析法分析初中涉及“化学反应速率”的事例得出外在的可变因素及其对反应快慢的影响(当然也可以使用教材中更为科学规范的对比实验来进行分析)、发现了定性描述的不足、产生定量的想法②难以理解的易混易错点主要集中在如何定量化这一方面,包括:物理中如何从跑的快慢比较中产生速率概念、变化量何以为数值(或正值)、物理中速率概念抽象、迀移应用到化学反应产生化学反应速率概念、如何定义变化量、如何保证△C>0、△C=0情形如何处理、反应速率用不同反应物或生成物计算时何以会有不同值、这些不同值有何关系、怎样使用这些速率值。
四、引导“化学反应速率”知识生长的深度学习问题的设计
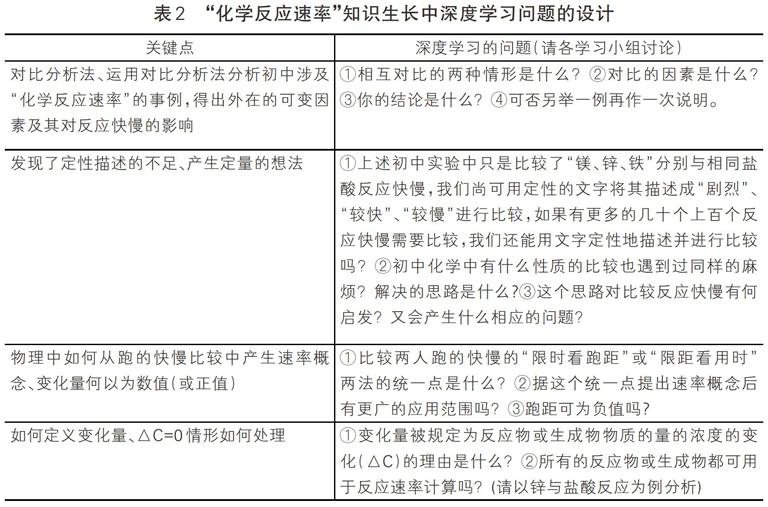
关键点的教学处理直接关系到学生采用何种学习方式,若只采用针对关键点的讲解,则不能发挥学生学习的主动性、妨碍学生采用高阶思维进入深度学习状态;若针对关键点的问题设计仅停留在书本上有现成答案的“是什么”层次上,那也同样无助于学生采用开放、质疑的态度和思维进入深度学习状态;当然,受制于学生基础和授课时长,不可能将引导知识生长的问题都设计成深度学习的问题,这就像一个再好的睡眠也不会全是深度睡眠一样。“化学反应速率”知识生长中深度学习问题的设计具体如表2。
表2 “化学反应速率”知识生长中深度学习问题的设计
五、“化学反应速率”学案设计
[教学活动环节 教师所设计的问题 学生分组讨论的结果 教学活动环节的小结 导入 播放“初中实验:镁、锌、铁、铜分别与相同盐酸反应”的视频 活动1.
发展对化学反应的快慢认识
上述初中实验中“镁、锌、铁”分别与相同盐酸反应现象有什么不同?由此得到的结论是什么?如果从“化学反應快慢与反应物性质的关系”重新审视上述实验你又会得到什么结论,又会产生什么相应的问题 反应现象表现为反应快慢不同,结论则是金属活动性这一化学性质上有相应的不同。因此这个实验是通过反应快慢研究了反应物性质,之所以能这样进行研究是因为:现象(反应快慢)反映性质(金属活动性);而性质(金属活动性)决定现象(反应快慢)。由此产生的一个结论是:反应物性质是决定化学反应快慢的内在的本质因素。产生的相应问题则是:影响化学反应快慢的外在的可变因素又有哪些?分别有着什么样的影响? 1.反应物性质是决定化学反应快慢的内在的本质因素;相应的问题是:影响化学反应快慢的外在的可变因素又有哪些?有着什么样的影响?
2.发现了定性描述的不足;相应的问题是:该如何定量化地描述反应快慢? ①上述实验中只是比较了“镁、锌、铁”反应快慢,尚可用定性的文字将其描述成“剧烈”、“较快”、“较慢”进行比较,若有几十个上百个反应快慢需要比较,还能用文字定性的描述并进行比较吗?②初中化学中有什么性质的比较也遇到过同样的麻烦?解决的思路是什么?③这个思路对比较反应快慢有何启发?④又会产生什么相应的问题 面对海量的化学反应,仅用文字定性的描述并进行反应快慢比较是不可能做到的;就像面对海量的物质,仅用文字定性的描述并进行溶解性比较是不可能做到的一样,需要从定性描述上升为定量描述才能进行精确的比较。也就是说描述反应快慢需要从定性上升为定量。产生的相应问题则是:该如何定量化地描述反应快慢? 活动2.有关化学反应速率的计算
①比较两人跑的快慢的“限时看跑距”或“限距看用时” 两法的统一点是什么? ②据这个统一点提出速率概念后有更广的应用范围吗? ③跑距可为负值吗? ①两法的统一点在△S/△t上,不唐管用哪一法,只要△S/△t大便快;②由此定义速率V=△S/△t,此后不限时不限距时也可用速率V比较跑的快慢。进一步抽象出,对任何一个变化过程都有,平均变化速率=变化量/变化所用的时间,这个结论也可用于化学反应;即对于化学反应,也可用化学反应速率来描述化学反应快慢。③应注意到跑动的距离只论大小,没有负值只有正值,故上述抽象出的公式中变化量也同样一律只有正值。 活动2小结见图2以物质物质的量的浓度的变化为中心的思维导图 ①变化量被规定为反应物或生成物物质的量的浓度的变化(△C)的理由是什么?②△C为正值的理由是什么?对反应物或生成物该如何计算才能保证△C为正值?③写出化学反应速率的定义式。④所有的反应物或生成物都可用于反应速率计算吗?(请以锌与盐酸反应为例分析) ①考虑到大多数反应为溶液中反应(混合气体也视作溶液),变化量被规定为物质的量的浓度的变化。②为了使这个变化量为正值,对反应物采用了反应物物质的量的浓度的减少,对生成物采用了反应物物质的量的浓度的增加。③V=△C /△t④无论反应进行与否,对△C=0物质应用上述定义其V皆为零,这当然不合理,故这些物质都应被排除在化学反应速率计算之外,如锌与盐酸反应中的锌和氢气 例:根据下图求2min内A、B、C三者的反应速率是多少?
在追问“A、B、C三者的反应速率的值为何不同”和“它们表示的反应快慢是否相同”后进行了变式训练(变式训练内容为老师所熟悉,不再赘叙) 这些内容为老师所熟悉,不再赘叙 活动3. 探究调控化学反应速率的途径
从初中学习过的内容中寻找有反应速率变化的实例,分析实例中①相互对比的两种情形是什么?②对比的因素是什么?③你的结论是什么?④可否另举一例再作一次说明 学生讨论并分析的实例有:
①夏天化肥碳酸氢铵少掉了(大意)——对比的为夏天与春秋冬天的不同——影响因素为温度——升温加速;另举一例为碳酸(二氧化碳水溶液)分解——对比的是常温与加热。
②實验室用双氧水制备氧气中催化剂二氧化锰的使用——对比的为二氧化锰加入前后的不同——影响因素为催化剂——用催化剂加速;另举一例为氯酸钾制氧气
③氧气检验——对比的为余烬木条进入氧气前后的不同——影响因素为反应物浓度——浓大速快;另举例子均为在氧气中进行的燃烧, 采用与空气中现象对比。
④面粉的爆炸——对比的为面粉做的干面条可燃却不炸——影响因素为反应物的接触面积——接触面积大速度快;另举一例为加油站禁打手机。 总结对比分析方法的四步操作:①明确相互对比的两种情形;②明确对比的因素;③明确因素不同所导致的不同现象;④建立因素与现象的关系。
总结影响反应速率的外部因素及其与反应速率的关系(具体略) 之前我们的对比、讨论、分析影响反应速率的因素,都是针对单一因素,实际反应时并非完全如此。
对于两个因素共同影响反应速率的分析,有兴趣的同学可结合课本本节教材后面的习题中,有关制取CO2题目中的(2)进行思考。 因为是必修,所以对以后要选修化学的同学提更高的要求 ]
图2 以物质物质的量的浓度的变化为中心的思维导图
[参 考 文 献]
[1]王祖浩主编.普通高中课程标准实验教科书·化学,化学2[M].南京:江苏凤凰教育出版社,2015.
[2]余文森.核心素养的教学意义及其培育[J].今日教育,2016(3).
(责任编辑:张华伟)
