小鼠卵母细胞减数分裂过程中LIMK1参与调控Aurora-A在纺锤体的定位
2018-06-14姜秀颖王思敏
姜秀颖,王思敏,周 晴,翁 静,马 伟
(首都医科大学 基础医学院 组织学与胚胎学教研室, 北京 100069)
胚胎的非整倍体性(aneuploidy)是临床不育、自发性流产和先天性出生缺陷的最常见原因,这种染色体组成异常主要由母亲卵母细胞减数分裂进程中染色体分离错误所导致[1- 2]。染色体的运动和分离由纺锤体牵引,纺锤体结构的异常会影响染色体分离的精确性。在哺乳动物卵子发生早期,中心粒退化,缺乏中心体结构,减数分裂纺锤体的形成依赖于无中心粒的微管组织中心(microtubule organizing centers, MTOC)[3- 4]。MTOC结构由核心蛋白和调节蛋白组成,前者包括结构成分pericentrin和微管成核因子γ-tubulin;调节蛋白则主要指一些蛋白激酶,如Aurora-A激酶等,促进MTOC的结构和功能完全成熟[5- 7]。
LIM kinase 1 (LIMK1)是一种丝氨酸(Ser)/苏氨酸(Thr)蛋白激酶,其活化依赖于Thr508残基的磷酸化,活化的LIMK1通过调控F-actin的聚合而参与细胞运动、胞质分裂和囊泡运输等生理过程[8];同时也参与维持微管的稳定性,促进星状微管的形成和纺锤体的准确定位[9]。关于LIMK1在卵母细胞减数分裂过程中表达模式及其与MTOC蛋白之间的关系仍无研究报道。
1 材料与方法
1.1 材料
清洁级21日龄CB6F1雌性小鼠(雄性C57BL6与雌性BALB/C的杂交一代)[北京维通利华实验动物技术有限公司,许可证编号SCXK(京)2012- 0001];兔抗pLIMK1Thr508抗体(Millipore公司);小鼠抗acetylated-tubulin抗体、小鼠抗Aurora-A抗体和牛血清白蛋白(bovine serum albumin, BSA)(Sigma-Aldrich公司);小鼠抗pericentrin抗体(BD Biosci-ences公司);LIMKI抑制剂BMS- 3(Synkinase公司);孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)(宁波第二激素厂);胎牛血清(fetal bovine serum, FBS)(Gibco公司);防荧光淬灭封片剂(mounting medium with DAPI)(Vector Lab公司)。
1.2 方法
1.2.1 卵母细胞的收集和培养:给CB6F1代雌性小鼠腹腔注射10 IU PMSG,44~48 h后使用CO2窒息法对小鼠实行安乐死,随后收集卵丘-卵母细胞复合体(cumulus cell-oocyte complexes, COC)进行培养。基础培养液为Minimum Essential Medium(MEM),培养过程中添加10% FBS和3 mg/mL BSA。体外培养0、2、8、10和16 h,分别对应减数分裂前期(即生发泡期,germinal vesicle,GV)、生发泡破裂期(germinal vesicle breakdown, GVBD)、第1次减数分裂中期(metaphase Ⅰ, MⅠ)、第1次减数分裂后期(anaphase Ⅰ, AⅠ)和末期(telphase Ⅰ, Tel Ⅰ)以及第2次减数分裂中期(metaphase Ⅱ, MⅡ)。
1.2.2 免疫荧光染色(immunofluorecent staining):室温条件下,将脱去卵丘的卵母细胞在1%多聚甲醛(paraformaldehyde,PFA)/0.5% Triton X- 100中固定45 min,漂洗后在10%山羊血清中封闭1 h,随后在一抗溶液中孵育,4 ℃、过夜。细胞漂洗后继续在Alexa Flour- 488或Alexa Flour- 594标记的相应二抗溶液中避光孵育45 min,充分漂洗后移至干净的载玻片上并以含有DAPI的防淬灭封片剂封片。样品用Olympus荧光显微镜进行观察并分析减数分裂中pLIMK1Thr508和Aurora-A的时空分布相关性。试验中抗体主要包括:兔抗pLIMK1Thr508(1∶1 000),小鼠抗acetylated-tubulin(1∶10 000)和小鼠抗Aurora-A(1∶3 000)。
1.2.3 BMS- 3处理:1 mmol/L BMS- 3储存在二甲基亚砜(DMSO, Sigma-Aldrich公司)中,并在培养基(MEM/BSA/10% FBS)中稀释至实验浓度0.001 mmol/L。正常培养至MⅠ期的卵母细胞在0.001 mmol/L BMS- 3中处理1 h后固定染色,观察pLIMK1Thr508和Aurora-A的空间分布以及纺锤体结构的变化。
1.3 统计学分析
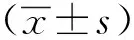
2 结果
2.1 pLIMK1Thr508在小鼠卵母细胞在减数分裂进程中的亚细胞定位及其与Aurora-A的相关性分析
免疫荧光染色分析表明在减数分裂前期,卵母细胞内Aurora-A没有任何特殊聚集(图1B),此时pLIMK1Thr508的荧光信号亦比较弱,主要分布在生发泡中(图1C: 箭)。在临近减数分裂重启时,pLIMK1Thr508离开生发泡并以一致密点状聚集在胞质中,Aurora-A信号出现并与pLIMK1Thr508高度重合(图1F, G: 箭)。在生发泡完全破裂后,染色质凝集成为单个的棒状染色体(图1I),pLIMK1Thr508和Aurora-A由单一点状裂解为多个片状信号并围绕在染色体周围,在此过程中两种信号保持重合(图1J, K, L:箭)。在第1次减数分裂中期(metaphase I, MI),所有的染色体整齐排列在赤道板中央(图1M),pLIMK1Thr508和Aurora-A同时高度聚集,呈“C”形或“O”形特异地定位于染色体阵列的两侧,即推测中纺锤体的两极部位(图1N, O, P:箭),两者在胞质中也有散在点状分布(图1N, O, P:箭头)。在第1次减数分裂后期(anaphase I, AI)到末期(telphase I, TelI)过程中,随着同源染色体相互分离(图1Q),pLIMK1Thr508离开纺锤体区域,聚集在收缩环部位(图1S:箭),提示pLIMK1Thr508可能与胞质分裂的完成相关;Aurora-A信号变弱,弥散地分布在微管所在部位(图1R:箭)。在卵母细胞成熟至第2次减数分裂中期(metaphase II, MII)时,第一极体(first polar body, 1st PBD)被排出(图1U:箭),在其附近的皮质区染色体重新排列整齐(图1U),此时pLIMK1Thr508和Aurora-A又同时聚集在染色体阵列两侧,即纺锤体两极部位(图1V,W,X:箭),在胞质中也有致密的点状分布(图1V,W,X:箭头)。pLIMK1Thr508和Aurora-A在纺锤体两极部位的共定位模式提示LIMK1可能通过调控Aurora-A的定位和表达而参与纺锤体组装过程,而pLIMK1Thr508在收缩环部位的聚集也提示LIMK1活性可能还与胞质分裂密切相关。
2.2 抑制LIMK1活性影响Aurora-A的空间分布和纺锤体形成
正常培养至MI期的卵母细胞在用1 μmol/L BMS- 3处理1 h后,pLIMK1Thr508和Aurora-A的空间分布发生了明显改变,失去了对称的双极定位格局,以类似于前中期的模式围绕在染色体周围(图2A. f, g:箭),此时,染色体非线性排列而是凌乱地聚集在一起(图2A. e; B. e),微管并没有组织形成双极对称的纺锤体结构,而是成球状围绕在染色体组周围(图2B. f:方框)。统计分析证实,在BMS- 3处理组内表现出pLIMK1Thr508和Aurora-A非双极定位的细胞数目显著高于对照组(P<0.01)(图2C, D),而具有非双极对称纺锤体的细胞数目亦在BMS- 3组显著高于对照组(P<0.01)(图2E)。上述数据说明LIMK1活性通过调控Aurora-A的空间分布而影响MTOC结构形成和纺锤体组装。
3 讨论
Aurora-A激酶参与调节体细胞有丝分裂进程中中心体的复制和分离、染色体的中板聚合以及双极纺锤体的形成等多个事件[5],并在卵母细胞内参与MTOC功能和双极纺锤体形成的调控,是一种MTOC调节蛋白,其活性异常或表达缺失会影响MTOC形成和纺锤体组装过程[6- 7]。在有丝分裂过程中LIMK1活性能够促进Aurora-A在Ser288位点磷酸化,使其全面活化[10],说明LIMK1与Aurora-A的功能相关。本项研究进一步发现pLIMK1Thr508与Aurora-A在小鼠卵母细胞减数分裂过程中共同定位于纺锤体两极,抑制LIMK1活性会导致Aurora-A定位和纺锤体结构异常,提示LIMK1活性可能通过调控Aurora-A的活化和极性定位而参与纺锤体的组装和维持。在卵母细胞减数分裂末期,胞质分裂的完成依赖于收缩环的有效活动,而收缩环结构的形成依赖于丝状肌动蛋白(filament actin, F-actin)聚合和解聚的动态平衡[11- 12],以往研究证实LIMK1能够磷酸化微丝切割蛋白cofilin,抑制其解聚F-actin的活性,诱导F-actin聚合[13- 14]。本项研究发现pLIMK1Thr508高度聚集在收缩环部位,提示卵母细胞内LIMK1-cofilin通路可能通过调节收缩环的功能而促进胞质分裂过程的有序完成。总之,本项研究初步证实卵母细胞内pLIMK1Thr508是一种MTOC相关蛋白,LIMK1活性可能通过参与MTOC形成和胞质分裂等环节而调控减数分裂进程,研究结果为进一步揭示卵母细胞内染色体分离的调控机制和认识非整倍体胚胎的形成提供了依据。

DNA was labeled in blue,whereas pLIMK1Thr508in red, Aurora-A in green; pLIMK1Thr508concentrated in the germinal vesicle (C, arrow)with no signal of Aurora-A(B) at GV stage; upon GVBD, pLIMK1Thr508aggregated as a single dense dot in the vicinity of nuclear, and co-localized with Aurora-A(G,F,arrow); at G,V,B,D, pLIMK1Thr508and Aurora-A (J,K,arrow)concentrated as multi foci around the chromosomes; at MI and MII, pLIMK1Thr508(O,W, arrow) was co-localized with Aurora-A(N,V, arrow) on spindle poles, pLIMK1Thr508(O,W, arrowhead) which scattered as dots in cytoplasm was co-localized with Aurora-A(N,V, arrowhead); during Tel I, pLIMK1Thr508(S, arrow) concentrated on the cleavage furrow, while Aurora-A (R) loosely congressed on spindle
图1pLIMK1Thr508和Aurora-A在卵母细胞减数分裂中的亚细胞定位模式
Fig1Sub-cellularlocalizationofpLIMK1Thr508andAurora-Ainoocytemeiosis(×400)

DNA was labeled in blue,whereas pLIMK1Thr508in red, Aurora-A and acetylated tubulin in green; A.abnormal pLIMK1Thr508(g) and abnormal Aurora-A (f) in oocytes cultured with BMS-3 for 8 hours(×400); B.in BMS-3-treated oocytes, microtubules were not organised into a bipolar structure (f) and pLIMK1Thr508(g) were not recruited to spindle poles, the number of oocytes with (×400); C.non-polar location of pLIMK1Thr508; D.non-polar location of Aurora-A; E.disrupted spindle; was significantly higher in BMS-3 treatment group;*P<0.01 compared with DMSO group
图2小鼠卵母细胞中抑制LIMK1活性破坏Aurora-A的空间分布和纺锤体形成

参考文献:
[1] Fragouli E, Alfarawati S, Goodall NN,etal. The cytogenetics of polar bodies: insights into female meiosis and the diagnosis of aneuploidy [J]. Mol Hum Reprod, 2011, 17:286- 295.
[2] Dai X, Zhang M, Lu Y,etal.Cullin9 protects mouse eggs from aneuploidy by controlling microtubule dynamics via Survivin [J]. Biochim Biophys Acta, 2016, 1863:2934- 2941.
[3] Balboula AZ, Nguyen AL, Gentilello AS,etal. Haspin kinase regulates microtubule-organizing center clustering and stability through Aurora kinase C in mouse oocytes [J]. J Cell Sci, 2016, 129:3648- 3660.
[4] Clift D, Schuh M. A three-step MTOC fragmentation mechanism facilitates bipolar spindle assembly in mouse oocytes [J]. Nat Commun, 2015, 6:7217- 7229.
[5] Barr AR, Gergely F. Aurora-A: the maker and breaker of spindle poles [J]. J Cell Sci, 2007, 120:2987- 2996.
[6] Saskova A, Solc P. Aurora kinase A controls meiosis I progression in mouse oocytes [J]. Cell Cycle, 2008, 7: 2368- 2376.
[7] Solc P, Baran V, Mayer A,etal. Aurora kinase A drives MTOC biogenesis but does not trigger resumption of meiosis in mouse oocytes matured in vivo [J]. Biol Reprod, 2012, 87:85: 1- 12.doi:10.1095/biolreprod.112.101014.
[8] Bernard O. Lim kinases, regulators of actin dynamics [J]. Int J Biochem Cell B, 2007, 39: 1071- 1076.
[9] Kaji N, Muramoto A, Mizuno K. LIM kinase-mediated cofilin phosphorylation during mitosis is required for precise Spindle positioning [J]. J Biol Chem, 2008, 283:4983- 4992.
[10] Ritchey L,Ottman R, Roumanos M,etal. A functional cooperativity between Aurora A kinase and LIM kinase1 [J]. Cell Cycle, 2012, 11: 296- 309.
[11] Azoury J, Verlhac MH, Dumont J. Actin filaments: key players in the control of asymmetric divisions in mouse oocytes [J]. Biol Cell, 2009, 101:69- 76.
[12] Mierzwa B, Gerlich DW. Cytokinetic abscission: mole-cular mechanisms and temporal control [J]. Dev Cell, 2014, 31:525- 538.
[13] Delorme V, Machacek M, DerMardirossian C,etal. Cofilin activity downstream of Pak1 regulates cell protrusion efficiency by organizing lamellipodium and lamella actin networks [J]. Dev Cell, 2007, 13:646- 662.
[14] Zhou Y, Su J, Shi L, Liao Q,etal. DADS downregulates the Rac1-ROCK1/PAK1-LIMK1-ADF/cofilin signaling pathway, inhibiting cell migration and invasion [J]. Oncol Rep, 2013, 29:605- 612.
