转染胃动蛋白2基因抑制人胃癌细胞系MKN28增殖、迁移和侵袭
2018-06-14蔡志宏曹怡静胡皓彬许雄峰
蔡志宏,曹怡静,刘 姣,胡皓彬,谢 鑫,许雄峰,凌 晖*
(南华大学 医学院 1.肿瘤研究所;2.2016级卓越医师班,湖南 衡阳 421001)
胃癌不仅在中国人群中的发病率很高,也是全球最常见的癌致死原因[1]。胃癌治疗新手段的研究,已成胃癌防治领域新兴的研究焦点。胃动蛋白- 2(gastrokine- 2,GKN2)属于分泌蛋白家族,其在正常胃黏膜组织中高表达,而在胃癌中表达下调或不表达,提示GKN2可能作为候选肿瘤抑制基因在胃癌发生中起作用[2- 3]。研究发现GKN2特异性表达于胃黏膜组织[4],GKN2表达缺失与胃癌发生密切相关,并提示将来临床上有望通过恢复GKN2表达的治疗策略来抑制胃癌发生发展[5]。
本研究首先观测GKN2在胃癌中的表达转变,接着经转染GKN2使其高表达,验证其对人胃癌MKN28细胞增殖、侵袭和迁移的抑制作用,为GKN2在胃癌变过程中作用的深入探寻提供实验证据。
1 材料与方法
1.1 材料
1.1.1 病例标本及MKN28细胞系:标本来自南华大学附属一医院,其中胃癌90例、癌旁组织48例、胃癌远端胃黏膜(从距肿瘤边缘>5 cm处取得)组织22例。90例胃癌标本中,高分化腺癌20例、中分化腺癌29例、低分化腺癌21例、黏液腺癌11例、印戒细胞癌9例。该实验已获南华大学伦理委员会的审查批准书及受试者签署的知情同意书。人胃癌MKN28细胞系来自本研究所保存。
1.1.2 试剂:免疫组化Ultrasensitive TM SP 试剂盒、DAB染色试剂盒(迈新生物技术有限公司);Xhol_GKN3SP-hGKN2-TEV-SBP_Xhol表达载体和pCAGGS-Neo vector空载体由本所构建;兔抗人GKN2单克隆抗体、兔抗人β-actin单克隆抗体、兔二抗等(Abcam公司);MTT细胞增殖检测试剂盒(碧云天生物技术公司)。
1.2 方法
1.2.1 免疫组织化学检测GKN2表达:采取LSAB法(又称链酶亲和素过氧化物酶法)进行实验,PBS(替代一抗)为阴性对照,依据Ultrasensitive TM SP 试剂盒说明书实施步骤。苏木精染色1 min, 自来水冲洗10 min,盐酸分化10 s,自来水返蓝5 min。脱水并中性树胶封片。显微镜下观察:阳性细胞的胞质中显示黄色或棕黄色者。结果判定:每一个高倍镜下阳性细胞数<5为阴性,≥5为阳性。
1.2.2 细胞培养及重组质粒转染细胞:用含10%胎牛血清的RPMI- 1640培养基(青霉素、链霉素各100 U/mL),37 ℃、5% CO2培养箱中常规培养细胞,待细胞增殖至80%左右汇合时传代。使用Lipofectamine 2000进行转染,G418筛选,获得稳定高表达GKN2的MKN28细胞株,实验分为GKN2转染组、未转染组和空载体组。
1.2.3 Western blot验证GKN2蛋白的表达:提取各组细胞总蛋白,用BCA法进行蛋白定量,以30 μg总蛋白/孔的量在10% SDS-PAGE进行电泳,转膜,封闭,加一抗(GKN2,1∶1 000;β-actin,1∶1 000)4 ℃孵育过夜,洗膜后,加二抗(1∶2 000)室温下孵育2 h,ECL发光剂显影,拍照,AlphaImager 2200软件对结果进行分析。
1.2.4 MTT法检测细胞增殖:取对数增殖期细胞,由胰蛋白酶消化制备单细胞悬液(1×104cells/mL),接种于96孔培养板,每孔注入200 μL细胞悬液(含2 000个细胞),设立空载体组、未转染组和调零组,贴壁后在孔中培养24、48和72 h后,每孔添加10 μL MTT液(5 g/L),在细胞培养箱内再温育4 h即停止培养,然后每孔添加100 μL DMSO以便溶解,经由10 min左右振荡,置酶联免疫检测仪测定A值(每孔取5个复孔)。
1.2.5 Transwell迁移实验检测细胞迁移:首先用胰蛋白酶消化各组MKN28细胞,加入无血清培养基制备细胞悬液;Transwel小室分为上下两室,在下室之中加入500 μL含血清的培养基(血清和培养基的加入比例为1∶9),在上室中加入细胞悬液200 μL,置培养箱中培养24 h,取出Transwell小室,PBS洗2次,4%多聚甲醛固定15 min,结晶紫染色15 min,在倒置显微镜下进行观察。随机选取5个高倍镜视野,照相并计数。
1.2.6 Transwell侵袭实验检测细胞侵袭:将液态的BD基质胶与无血清培养基(依照1∶5的比例)混匀,吸400 μL注入Transwell上室,置于细胞培养箱中2 h,导致薄层凝胶产生。其他步骤同迁移实验。
1.3 统计学分析
2 结果
2.1 GKN2蛋白在胃组织中的表达
GKN2蛋白在癌旁组织中表达明显弱于胃癌远端胃黏膜(P<0.05)。GKN2蛋白在胃癌组织中表达均显著低于胃癌远端胃黏膜(P<0.01)和癌旁组织(P<0.01)(表1)。

表1 GKN2蛋白在胃癌远端胃黏膜、癌旁和胃癌组织中的表达
DGM.distal gastric mucosa; AT.the adjacent tissues; GC.gastric cancinoma;*P<0.05 compared with DGM;#P<0.05 compared with AT.
2.2 Western blot验证转染前后GKN2蛋白表达的变化
与未转染组和空载体组相比,转染GKN2的MKN28细胞中GKN2蛋白表达明显增加(P<0.05)(图1)。
2.3 过表达GKN2对人胃癌MKN28细胞增殖的影响
与未转染的细胞和空载体组的细胞相比,转染GKN2的细胞在转染24 h后细胞存活率(A值)开始减低,48 和72 h后更显著,呈现时间依赖关系(P<0.05)(表2)。
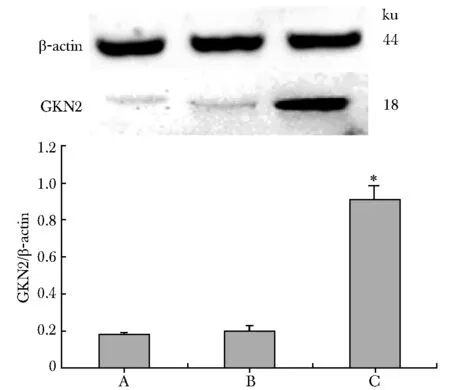
A.untransfected cells group; B.empty vector group;C.GKN2-transfected group; *P<0.05 compared with untransfected cells group and empty vector group图1 GKN2转染前后MKN28细胞中GKN2蛋白表达情况Fig 1 Expression of GKN2 protein in MKN28 cells with or without n=3)

24 hours48 hours72 hoursuntransfected cells0.24 ±0.030.44 ±0.020.63±0.03 empty vector0.25 ±0.040.49 ±0.060.65 ±0.21 GKN2-transfected0.15±0.02*0.22 ±0.06*0.25±0.05*
*P<0.05 compared with untransfected cells group and empty vector group.
2.4 过表达GKN2对人胃癌MKN28细胞迁移能力的影响
显微镜下(放大倍数×200)观察并计算迁移细胞数:从Transwell小室的上层(无血清培养基)经聚碳酸酯膜迁移到下层(血清培养基)的细胞数,细胞染成紫色,GKN2转染组迁移细胞数比未转染组和空载体组显著减少(P<0.05)(图2)。
2.5 过表达GKN2对人胃癌MKN28细胞侵袭能力的影响
GKN2转染组MKN28细胞中穿过基质胶的细胞数明显少于未转染组和空载体组(P<0.05)(图3)。
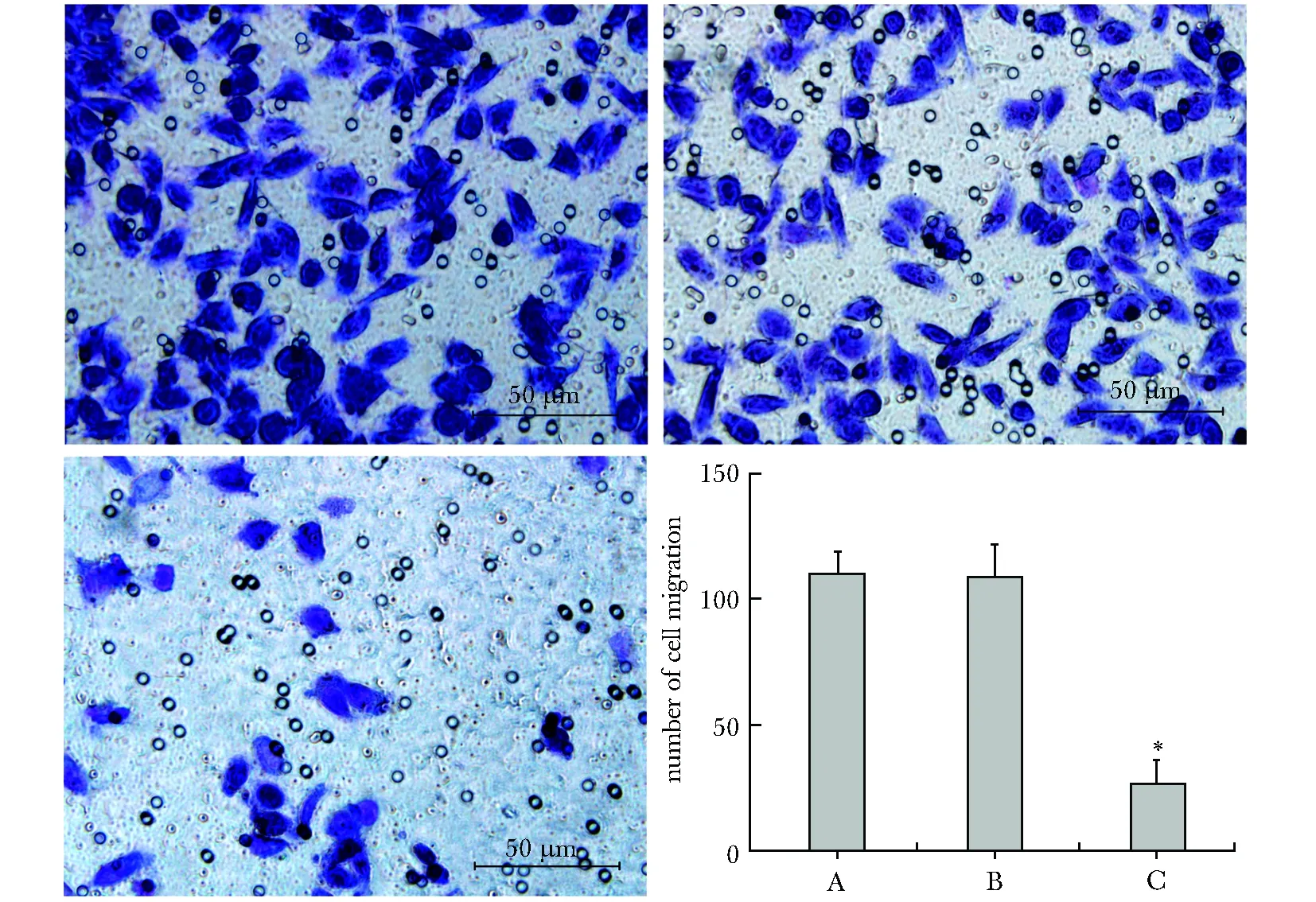
A.untransfected cells group; B.empty vector group;C.GKN2-transfected group;*P<0.05 compared with untransfected cells group and empty vector group
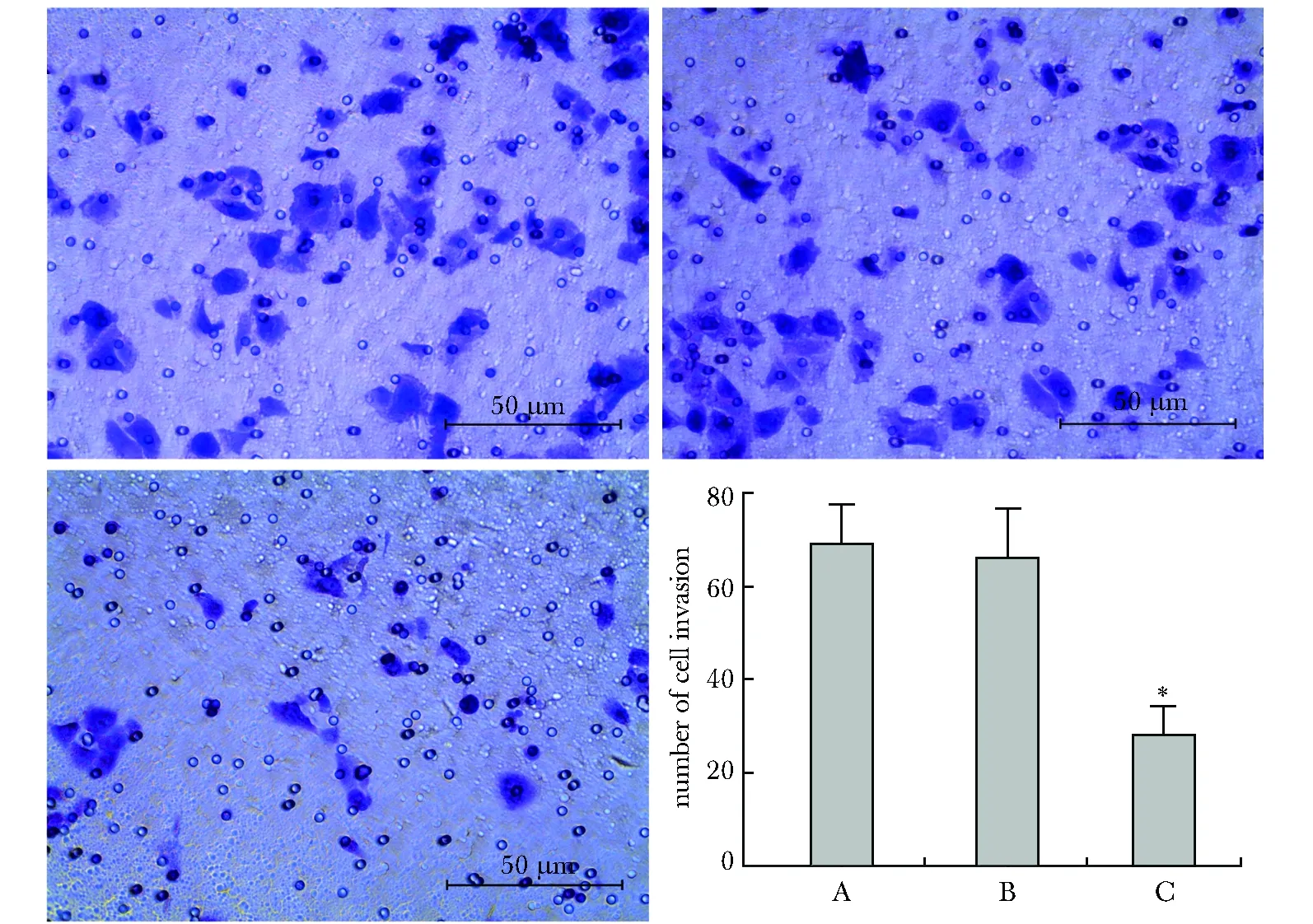
A.untransfected cells group; B.empty vector group;C.GKN2-transfected group;*P<0.05 compared with untransfected cells group and empty vector group
3 讨论
研究表明,在正常人胃黏膜中GKN2高表达,但在幽门螺杆菌(Helicobacter pylori, Hp)感染直到胃部肿瘤形成的过程中,GKN2呈现出表达逐渐下调,且根除Hp后,GKN2表达上调是最明显的[6]。本实验结果也发现,GKN2在胃癌远端胃黏膜中显著高表达,而在癌旁组织和胃癌组织中呈渐进性的表达下调,说明GKN2参与胃癌的发生过程,可能作为候选抑瘤基因发挥作用,因此在胃癌中表达明显下调。
GKN2在胃癌细胞系中均表达下调或不表达[7]。那么使GKN2恢复表达是否具有抑制胃癌细胞的增殖的作用?基于此,本实验将GKN2高表达载体转染到人胃癌MKN28细胞中,证实细胞增殖明显受到抑制。有研究者发现STAT3信号通路是调节GKN2转录的关键点之一[5],由此推测GKN2抑制胃癌细胞增殖的作用是否与STAT3有关?在哺乳动物体内GKN2是否也具有抑制癌细胞增殖的作用呢?GKN2是通过哪些信号途径来抑制胃癌细胞增殖的呢?这些都有待于进一步的研究证实。
目前研究已经证实,GKN1可以抑制胃癌细胞的迁移和侵袭[8],那么GKN2是否也有相同的作用呢?本实验结果发现,GKN2过表达对胃癌细胞迁移和侵袭有显著阻滞作用,说明GKN2与GKN1一样具有抑制胃癌细胞迁移与侵袭作用。迁移和侵袭的活化是癌转移起始的标志之一。侵袭和转移过程极其复杂,包括癌细胞分泌多种蛋白酶对抗细胞外基质(ECM)的降解。最近有报道发现GKN2可抑制胃癌细胞EMT(上皮间质转换),其机制可能是通过PI3K/AKT/GSK3β信号通路下调snail的表达[9]。GKN2也可能通过与TFF1相互作用协同起到抗胃癌细胞增殖和促凋亡的作用[10]。GKN2抑制胃癌细胞迁移与侵袭的机制还未完全阐明,将进一步进行探究。根据以上研究结果,认为GKN2在胃癌中是一个有潜力的肿瘤抑制基因,恢复GKN2表达也许是治疗胃癌的新策略。诠释GKN 2的作用机制将有助于进一步阐明胃癌的发病机制,为发现胃癌防治的分子靶点提供依据,因此值得进一步深入开展研究。
参考文献:
[1] Chen W, Zheng R, Baade PD,etal. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66:115- 132
[2] Lordick F, Allum W, Carneiro F,etal. Unmet needs and challenges in gastric cancer: the way forward[J]. Cancer Treat Rev, 2014, 40: 692- 700.
[3] Menheniott TR, Kurklu B, Giraud AS. Gastrokines: stomach-specific proteins with putative homeostatic and tumor suppressor roles[J].Am J Physiol Gastrointest Liver Physiol, 2013, 304: G109-G121.
[4] May FE, Griffin SM, Westley BR. The trefoil factor interacting protein TFIZ1 binds the trefoil protein TFF1 preferentially in normal gastric mucosal cells but the co-expression of these proteins is deregulated in gastric cancer[J]. Int J Biochem Cell Biol, 2009,41: 632- 640.
[5] Menheniott TR, O’Connor L, Chionh YT,etal. Giraud AS. Loss of gastrokine- 2 drives premalignant gastric inflammation and tumor progression[J]. J Clin Invest, 2016, 126:1383- 1400.
[6] Resnick MB, Sabo E, Meitner PA,etal. Global analysis of the human gastric epithelial transcriptome altered in Helicobacter pylori eradicationinvivo[J].Gut, 2006, 55:1717- 1724.
[7] Dai J, Zhang N,Wang JH,etal. Gastrokine- 2 is downregulated in gastric cancer and its restoration suppresses gastric tumorigenesis and cancer metastasis[J].Tumour Biol, 2014, 35: 4199- 4207.
[8] Yoon JH, Choi WS, Kim O,etal. Gastrokine 1 inhibits gastric cancer cell migration and invasion by downregulating RhoA expression[J]. Gastric Cancer, 2017, 20:274- 285.
[9] Dai J, Qian C, Su M,etal. Gastrokine- 2 suppresses epithelial mesenchymal transition through PI3K/AKT/GSK3β signaling in gastric cancer[J].Tumour Biol, 2016, 37:12403- 12410.
[10] Kim O, Yoon JH, Choi WS,etal. Heterodimeric interaction between GKN2 and TFF1 entails synergistic antiproliferative and pro-apoptotic effects on gastric cancer cells[J]. Gastric Cancer,2017. doi: 10.1007/s10120- 017- 0692-y.
