表皮生长因子对Hela细胞紧密连接蛋白3表达的影响及其可能机制*
2018-06-14刘芳桂定清张力忆
刘芳,桂定清,张力忆
(四川省达州市中心医院 妇产科,四川 达州 635000)
宫颈癌为常见妇科恶性肿瘤,肿瘤细胞侵袭转移是影响患者预后的重要原因[1],探明其侵袭转移机制有助于开展靶向性治疗以提升预后。目前研究证实,细胞黏附能力的丧失可能导致细胞连接的破坏,进而促进肿瘤的浸润和转移[2],上皮细胞的黏附主要依靠黏附连接和紧密连接,Claudin蛋白是紧密连接的重要密闭蛋白[3]。已有报道[4-5]证实,多种Claudin蛋白在包括宫颈癌在内的多种癌症组织中表达量增加,且有研究[6]证实表皮生长因子(epidermal growth factor,EGF)能够促进宫颈癌细胞转移。本文研究EGF对宫颈癌细胞紧密连接蛋白3(Claudin-3)表达的影响及该影响的形成机制,现报道如下。
1 材料与方法
1.1 材料、试剂及仪器
主要材料:人宫颈癌Hela细胞株[购自中国科学院细胞库(上海)]。主要试剂:EGF(购自美国Peprotech),总RNA提取试剂盒(购自美国Invitrogen),总蛋白提取试剂盒(购自上海伟进),PCR试剂盒(购自日本TaKaRa),磷酸酶抑制剂、EGF受体(EGF receptor,EGFR)阻断剂(ZD1839)、磷脂酰肌醇3-激酶(phosphatidylinositol-3 kinase,PI3-K)阻断剂(LY294002及Wortmannin)、促分裂素原活化蛋白激酶(mitogen-activated protein kinase,MAPK)阻断剂(PD98059及 U0126)、p38阻断剂(SB203580)、c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK)阻断剂(SP600125)(均购自美国Sigma),Western blot试剂盒(购自北京中山金桥),PCR引物由生工生物工程(上海)股份有限公司提供。
1.2 方法
1.2.1 前期细胞培养 Hela细胞株接种于含有10%小牛血清的DMEM培养基,在37℃、5%二氧化碳CO2、饱和湿度条件下培养。细胞生长至70%~80%融合后,消化并将细胞以2×106个/孔的密度接种于6孔板,同样条件下培养24 h,达到贴壁生长状态。去除培养基,以无血清DMEM培养基继续培养16~18 h,开展后续处理。
1.2.2 实验路径 所培养的Hela细胞分别用于开展3项实验,且各项研究均设3个复组:①分别加入含 有 EGF终 浓 度 0.0、0.5、5.0、10.0、100.0 ng/ml的DMEM培养基,培养8 h,搜集细胞,检测Claudin-3蛋白及信使RNA(messenger RNA, mRNA)的表达情况;②加入含有EGF终浓度10 ng/ml的DMEM培养基,分别在培养0 min、10 min、30 min、1 h、2 h、4 h、8 h、24 h,搜集细胞,检测不同时间Claudin-3蛋白及mRNA的表达情况和EGFR、蛋白激酶B(protein kinase B, AKT)、细胞外调节蛋白激酶1/2(extracellular regulated protein kinases 1/2, ERK1/2)、p38、JNK磷酸化情况;③分别加入不含任何阻断剂、含ZD1839终浓度10 nmol/L、含LY294002终浓度20 nmol/L、含Wortmannin终浓度5 nmol/L、含PD98059终浓度20 nmol/L、含U0126终浓度10 nmol/L、含SB203580终浓度10 nmol/L、含SP600125终浓度10 nmol/L的DMEM中培养1 h,再加入终浓度为10 ng/ml的EGF培养后,搜集细胞,测评各阻断剂特异性阻断效果和Claudin-3蛋白及其mRNA的表达情况。
1.2.3 mRNA检测 采用实时荧光定量聚合酶链反 应(quantitative real-time polymerase chain reaction,qRT-PCR)技术检测Claudin-3 mRNA表达情况。引物设计见表1。反应条件:55℃水浴40 min;94℃变性40 s,55℃退火45 s,72℃延伸40 s,30个循环;72℃延伸 5 min。反应体系 :PCR Mater Mix 10 μl、cDNA模板5 μl,正向及反向引物20 nmol/L,无菌水定容至20 μl。检测结果采用2-△△Ct表示。
1.2.4 蛋白水平检测 采用Western bolt法检测各蛋白水平。搜集细胞总蛋白,采用Bradford法测定蛋白浓度,取各样本总蛋白50 μg,将体系混匀后,加热煮沸5~10 min,立即置于冰上,完全冷却后瞬间离心,上样,加入一抗,4℃孵育过夜,洗膜后加入二抗,加入DAB底物显色液,获得并分析凝胶图像。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,两组比较采用t检验;多组间比较采用单因素方差分析和SNK-q检验,P<0.05为差异有统计学意义。

表1 Claudin-3 mRNA检测引物设计
2 结果
2.1 细胞培养结果
接种至6孔板后,培养至24 h,细胞贴壁良好,可基本覆盖孔壁,且细胞存活率高,经显微镜观察,其细胞形态呈多边形或不规则状,且细胞有聚集生长特性,连接紧密。见图1。
2.2 不同终浓度EGF对Claudin-3蛋白及mRNA表达的影响
总体分析显示,不同终浓度处理后,Hela细胞中Claudin-3蛋白及mRNA表达水平比较,差异有统计学意义(均P=0.000)。经两两比较,显示且以10 ng/ml终浓度EGF处理,上调幅度最大。见表2和图2。
2.3 10 ng/ml EGF处理后Claudin-3蛋白及mRNA不同时间表达情况
处理24 h后,Claudin-3蛋白表达增加(t=75.685,P=0.000);随着处理时间的延长,Claudin-3 mRNA表达呈上升趋势(F时间=157.114,P=0.000)。见图3。
2.4 EGF对EGFR、AKT、ERK1/2、p38和JNK磷酸化的影响
验证显示,EGF处理后,Hela细胞内EGFR、AKT、ERK1/2、p38和JNK均出现磷酸化现象,且AKT、JNK磷酸化在处理30 min最明显,EGFR、ERK1/2、p38磷酸化在处理10 min最明显。见表3。
2.5 信号阻断剂对EGFR、AKT、ERK1/2、p38及JNK磷酸化的影响
验证显示,ZD1839能够特异性阻断EGFR磷酸化;LY294002、wortmannin能够特异性阻断AKT磷酸化;PU98059、U0126能够特异性阻断ERK1/2磷酸化;SB203580能够特异性阻断p38磷酸化;SP600125能够特异性阻断JNK磷酸化。
2.6 各信号通路阻断对Claudin-3蛋白表达的影响
阻断EGFR、AKT、ERK1/2、p38及JNK磷酸化后,经10 ng/ml EGF干预24 h后,Claudin-3蛋白表达均受到抑制(P<0.05),见图4。

图1 细胞培养结果
表2 不同终浓度EGF处理后Claudin-3蛋白及mRNA相对表达量比较 (±s)

表2 不同终浓度EGF处理后Claudin-3蛋白及mRNA相对表达量比较 (±s)
注:†与其他浓度比较,P <0.05
EGF终浓度F值 P值0 ng/ml 0.5 ng/ml 5.0 ng/ml 10.0 ng/ml 100.0 ng/ml Claudin-3蛋白 0.452±0.056 0.782±0.067 0.978±0.056 1.429±0.073† 1.051±0.103 72.516 0.000 Claudin-3 mRNA 0.113±0.036 0.403±0.016 1.198±0.054 3.174±0.165† 2.707±0.098 676.418 0.000指标
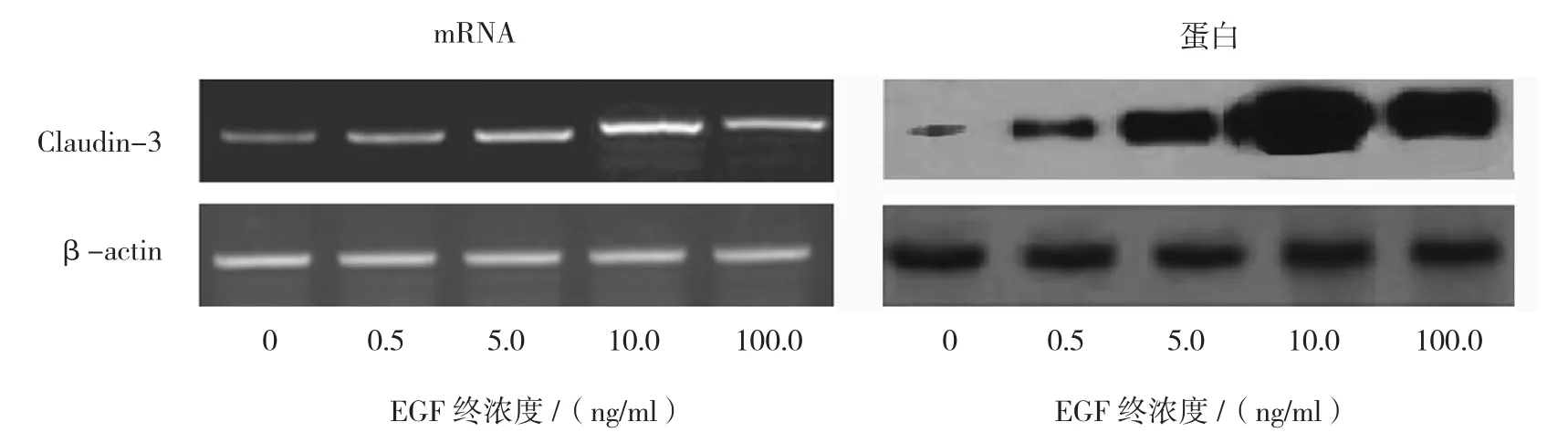
图2 不同终浓度EGF处理后Claudin-3蛋白及mRNA表达情况
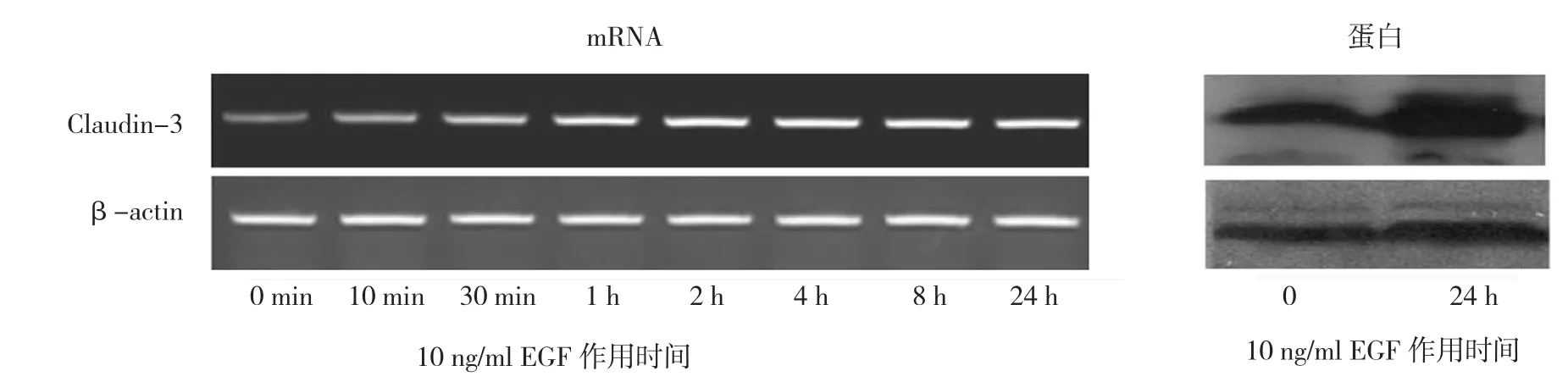
图3 10 ng/ml EGF处理后Claudin-3蛋白及mRNA不同时间表达情况
表3 EGF处理后EGFR、AKT、ERK1/2、p38及JNK磷酸化情况 (±s)

表3 EGF处理后EGFR、AKT、ERK1/2、p38及JNK磷酸化情况 (±s)
注:†与其他时间比较,P <0.05
?

图4 各信号通路阻断对Claudin-3蛋白表达的影响
3 讨论
侵袭和转移是影响宫颈癌患者预后的重要因素,目前研究显示细胞间黏附力的丧失可导致细胞连接破坏,为肿瘤细胞侵袭和转移创造条件[7],Claudins是形成紧密连接的主要骨架[8],其表达的上调或下降均可导致紧密连接的重组,CUNNIFFE等[9]报道指出Claudin-1、Claudin-7单一过表达不增加宫颈癌发生率,但均过表达可能预示宫颈恶性病变,同时两者过表达有助于抑制Hela细胞的侵袭和转移能力,针对性研究Claudin-3与宫颈癌相关性的报道较少,但针对乳腺癌[10]、胃癌等[11]恶性肿瘤的报道提示其过表达可能与肿瘤恶性程度正相关,本研究则发现Cluadin-3在宫颈癌Hela细胞系中也存在高表达现象,这与Claudin-3生物学作用有关,其能促进细胞受体二聚化,并使细胞质位点磷酸化而与多种不同信号序列蛋白结合而促使信号传导。大量研究证实EGFR在宫颈癌等恶性肿瘤细胞中存在过表达,其活化后能够促进肿瘤细胞的浸润、增殖及肿瘤血管的形成[12-13],但该过程是否有Claudin-3的参与,及EGFR对Claudin-3的调节机制,目前尚未完全明确,本研究则有助于解决该问题。
本研究发现,EGF在转录和翻译水平,均诱导Hela细胞上调Claudin-3的表达,且该作用存在时间和浓度依赖型,说明EGFR信号通路能够影响Claudin-3的表达,可能是EGFR过表达导致肿瘤恶性化程度升高的机制之一,ZHANG等[14]针对肺癌的病例研究有类似结论。EGFR的主要下游信号涉及MAPK和PI3-K通路,其中前者又包括ERK1/2、p38和JNKs等不同类型[15],本研究应用相应阻断剂阻断EGFR下游信号通路,EGF处理后,Hela细胞内EGFR、AKT、ERK1/2、p38及JNK均出现磷酸化现象,提示Hela细胞中EGFR信号通路激活后,各下游通路均被激活,经阻断剂预处理则能够特异性阻断对应下游通路的激活,说明研究方案是可行的。本研究发现EGFR对Claudin-3的调节作用与AKT、ERK1/2、p38及JNK信号通路均有关,这说明在Hela细胞中,EGFR能够通过多种信号通路调节Claudin-3的表达,de SOUZA WF等[16]针对结直肠癌的报道也提示ERK1/2、PI3-K/AKT信号通路能够影响Claudin-3的表达,进而影响结直肠癌的侵袭与转移能力;LI等[17]报道则显示p38通路也可影响Claudins蛋白的表达;其他亦有研究[18]提示,JNK信号通路与Claudin-3表达有关。可见,由于EGFR多个下游信号通路均可影响Claudin-3的表达,可能难以通过对单一下游信号通路的阻断抑制Claudin-3的表达,进而提升患者预后,直接干预上游信号通路可能是更好的解决方案。
综上所述,本研究显示EGF能够增加Hela细胞Claudin-3的表达,其机制可能涉及EGFR、PI3-K、MAPK、p38及JNK信号通路。
[1]OBEL J, SOUARES Y, HOY D, et al. A systematic review of cervical cancer incidence and mortality in the Pacific Region[J].Asian Pac J Cancer Prev, 2014, 15(21): 9433-9437.
[2]RUNKLE E A, MU D. Tight junction proteins: from barrier to tumorigenesis[J]. Cancer Lett, 2013, 337(1): 41-48.
[3]GÜNZEL D, YU A S. Claudins and the modulation of tight junction permeability[J]. Physiol Rev, 2013, 93(2): 525-569.
[4]李波, 肖凤仪, 李小洲, 等. 生长抑素对Hela细胞中Claudin-3和Claudin-4基因表达的调节作用[J]. 现代生物医学进展,2015, 15(7): 1249-1252.
[5]LI X, IIDA M, TADA M, et al. Development of an anti-claudin-3 and -4 bispecific monoclonal antibody for cancer diagnosis and therapy[J]. J Pharmacol Exp Ther, 2014, 351(1): 206-213.
[6]MUTHUSAMI S, PRABAKARAN D S, YU J R, et al. EGF-induced expression of fused toes homolog (FTS) facilitates epithelial-mesenchymal transition and promotes cell migration in ME180 cervical cancer cells[J]. Cancer Lett, 2014, 351(2): 252-259.
[7]KWON M J. Emerging roles of claudins in human cancer [J]. Int J Mol Sci, 2013, 14(9): 18148-18180.
[8]ZHANG X, RUAN Y, LI Y, et al. Tight junction protein claudin-6 inhibits growth and induces the apoptosis of cervical carcinoma cells in vitro and in vivo[J]. Med Oncol, 2015, 32(5): 148.
[9]CUNNIFFE C, BRANKIN B, LAMBKIN H, et al. The role of claudin-1 and claudin-7 in cervical tumorigenesis[J]. Anticancer Res, 2014, 34(6): 2851-2857.
[10]KOLOKYTHA P, YIANNOU P, KERAMOPOULOS D, et al.Claudin-3 and claudin-4: distinct prognostic significance in triplenegative and luminal breast cancer[J]. Appl Immunohistochem Mol Morphol, 2014, 22(2): 125-131.
[11]WANG H, YANG X. The expression patterns of tight junction protein claudin-1, -3, and -4 in human gastric neoplasms and adjacent non-neoplastic tissues[J]. Int J Clin Exp Pathol, 2015,8(1): 881-887.
[12]SHOSTAK K, CHARIOT A. EGFR and NF-κB: partners in cancer[J]. Trends Mol Med, 2015, 21(6): 385-393.
[13]SONG X, SHI B, HUANG K, et al. miR-133a inhibits cervical cancer growth by targeting EGFR[J]. Oncol Rep, 2015, 34(3):1573-1580.
[14]ZHANG L, WANG Y, ZHANG B, et al. Claudin-3 expression increases the malignant potential of lung adenocarcinoma cells:role of epidermal growth factor receptor activation[J]. Oncotarget,2017, 8(14): 23033-23047.
[15]TOMAS A, FUTTER C E, EDEN E R. EGF receptor trafficking:consequences for signaling and cancer[J]. Trends Cell Biol, 2014,24(1): 26-34.
[16]de SOUZA W F, FORTUNATO-MIRANDA N, ROBBS B K, et al. Claudin-3 overexpression increases the malignant potential of colorectal cancer cells: roles of ERK1/2 and PI3K-Akt as modulators of EGFR signaling[J]. PLoS One, 2013, 8(9): e74994.
[17]LI H J, GUO L M, YANG L L, et al. Electromagnetic-pulseinduced activation of p38 MAPK pathway and disruption of blood-retinal barrier[J]. Toxicol Lett, 2013, 220(1): 35-43.
[18]WANG Y, SUN T, SUN H, et al. SCF/C-Kit/JNK/AP-1 signaling pathway promotes claudin-3 expression in colonic epithelium and colorectal carcinoma[J]. Int J Mol Sci, 2017, 18(4): 765.
