塞来昔布联合FOLFOX4方案治疗晚期胃癌的疗效及机制研究*
2018-06-14任晓晓张小茜张红梅冯玉光董秀红史立宏邵翠
任晓晓,张小茜,张红梅,冯玉光,董秀红,史立宏,邵翠
(1.潍坊医学院研究生院,山东 潍坊 261053;2.潍坊医学院附属医院 消化内科,山东 潍坊 261031;3.潍坊医学院 药理学教研室,山东 潍坊 261053)
胃癌是全球常见的消化道恶性肿瘤之一,发病率和死亡率均位居前列[1],临床诊断时多已进入晚期,发生多脏器转移,为延缓患者生存时间,大多以放化疗替代手术治疗。塞来昔布是新型环氧合酶2(cyclooxyegenase-2, COX-2)选择性抑制剂,是非甾体抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)一种,可抑制肿瘤的生长及新生血管生成,诱导细胞凋亡,逆转多药耐药(multi-drug resistance,MDR),并加强化疗药的放射敏感性和细胞毒性作用,与化、放疗产生协同作用,进而影响肿瘤的发生、发展[2-4]。笔者之前的动物实验发现,在裸鼠体内塞来昔布能联合氟尿嘧啶(5-Fu)协同抗肿瘤,并可降低肿瘤干细胞标记物低氧诱导因子2α(hypoxia inducible factor-2α, HIF-2α)、ATP 结合盒基因 2(ATP-binding cassette gene 2, ABCG2)、八聚体转录因子4(Octamerbinding Transcription Factor 4, OCT-4)的表达,从而改善和逆转5-Fu的化疗抵抗[5]。本研究的目的是探讨塞来昔布与FOLFOX4方案联合在治疗晚期胃癌中的疗效,进一步研究ABCG2、OCT-4、HIF-2α与胃癌化疗抵抗、多药耐药的关系,为晚期胃癌的治疗提供新的思路。
1 资料与方法
1.1 一般资料
选取2015年9月-2017年5月于潍坊医学院附属医院消化内科就诊经病理和电子胃镜证实的80例晚期胃癌患者。纳入标准:①晚期胃癌患者TNM分期为ⅢB期、ⅢC期或Ⅳ期;②因年龄大、心肺功能差或其他原因不能手术或拒绝手术的晚期胃癌患者。随机分成实验组和对照组各40例。其中,男性49例,女性31例;年龄48~90岁,平均64.3岁。
1.2 实验试剂
兔抗人HIF-2α多克隆抗体、鼠抗人ABCG2单克隆抗体及OCT-4单克隆抗体(购于Abcam公司),PV-9000试剂盒、DAB试剂(购于北京中杉金桥有限公司),DNA Marker(购于Thermo公司),二抗(抗兔)(购于Proteintech公司),二抗(抗鼠)(购于Biosharp公司),β-actin(购于Santa公司),RIPA裂解液(购于Solarbio公司),Trizon、HiFi Script Gdna Removal cDNA Synthesis Kit、DNA marker、Taq Master Mix(购于康为世纪生物科技有限公司),上海生工生物工程股份有限公司合成PCR所需引物。
1.3 化疗方案
在征得患者家属知情同意的基础上,实验组应用塞来昔布联合FOLFOX4化疗方案:奥沙利铂(OXA)85 mg/m2,静脉滴注2 h,第1天;塞来昔布0.2 g,1次/d,口服,第1~5天;亚叶酸钙(CF)200 mg/m2,静脉滴注2 h,第1~2天;5-氟尿嘧啶(5-Fu)400 mg/m2,快速静脉滴注 0.5 h,5-Fu 600 mg/m2,持续静脉滴注22 h,第1~2天。对照组用FOLFOX4方案,化疗剂量及时间同治疗组。每3周重复,21 d为1个周期,共用4个周期。
1.4 疗效评价
每2个周期评价疗效1次,若出现可能为病情进展的临床表现可提前评价疗效。所有患者进行随访。疗程结束4周后再行电子胃镜和上腹CT检查。参考WHO实体瘤疗效评价标准[6]:完全缓解(complete remission, CR):病灶完全消失,维持4周以上。部分缓解(partial remission, PR):病灶减少50%以上并维持4周以上。稳定(stable disease, SD):病灶缩小<25%,或增大<25%,无新病灶出现。进展(progressive disease, PD):肿瘤增大超过25%,或出现新病灶。按照治疗效果分为有效(包括CR和PR)与无效(包括SD和PD),疾病有效率(RR)=(CR+PR)/总例数×100%。分别检测实验组和对照组治疗后ABCG2、OCT-4、HIF-2α的mRNA和蛋白表达。
1.5 ABCG2、OCT-4及HIF-2αmRNA表达的检测
采用逆转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)检测mRNA的表达。用Trizol法提取胃癌中的RNA,以35 μl DEPC水溶解,测得各组中mRNA的浓度和纯度,并将各组稀释成相同浓度。引物序列如下:GAPDH正向5'-GCACCACCAACTGCTTAGCAC-3',反向:5'-GCAGC GCCAGTAGAGGCAGG-3',产物片段 143 bp;OCT-4正向:5'-CCCGAAAGAGAAAGCGAACC-3',反向:5'-CA GAACCACACTCGGACCAC-3',产物片段151 bp;ABCG2 正 向 :5'-CCCTTATGATGGTGGCTTATTC-3',反向:5'-GTGAGATTGACCAACAGACCAT-3',产物片段132 bp;HIF-2α 正向:5'-CTTGGAGGGTTTCATTGCTG TGGT-3',反向:5'-GTGAAGTCAAAGATGCTGTGTCCT-3',产物片段123 bp。反应条件:94℃预变性2 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,35个循环;72℃ 2 min终延伸。2%琼脂糖凝胶电泳。应用Image J图像分析软件计算条带灰度值,以ABCG2、OCT-4及HIF-2α mRNA灰度值与GAPDH灰度值的比值表示mRNA的相对表达量。
1.6 胃癌组织中ABCG2、OCT-4及HIF-2α蛋白表达的检测
采用免疫组织化学(简称免疫组化)法。将收集到的部分胃癌组织标本用4%多聚甲醛固定,包埋切片,脱蜡入水,按照PV-9000试剂盒说明书进行操作。阴性对照用PBS代替一抗。结果判定:ABCG2和OCT-4阳性结果为细胞质内出现棕黄色颗粒,HIF-2α阳性结果为胞质内出现棕黄色颗粒,部分胞核也有少量表达。
1.7 Western blot检测胃癌组织中HIF-2α、ABCG2及OCT-4蛋白的表达
用RIPA裂解液提取组织中的蛋白,BCA法测定蛋白浓度,并将其调节成统一浓度。取6 μl蛋白样品进行SDS-PAGE电泳,转膜,封闭,孵育(4℃过夜),37℃孵育1 h,TBST洗涤,X射线曝光、显影、定影后观察结果。应用Image J图像分析软件,分析HIF-2α、ABCG2、OCT-4的表达,以HIF-2α、ABCG2、OCT-4灰度值与β-actin灰度值的比值表示蛋白的相对表达量。
1.8 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验,计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 治疗效果
实验组中有效率为77.5%(31/40),对照组有效率为42.5%(17/40),两组比较差异有统计学意义(χ2=10.208,P=0.001)。
2.2 ABCG2、OCT-4及HIF-2α mRNA的表达
两组间ABCG2、OCT-4及HIF-2α mRNA表达差异有统计学意义(HIF-2α:t=21.517,P=0.000;ABCG2:t=27.348,P=0.000;OCT-4:t=62.470,P=0.000)。实验组低于对照组。见图1和表1。
2.3 ABCG2、OCT-4、HIF-2α蛋白的表达
实验组ABCG2、OCT-4及HIF-2α蛋白的较对照组降低,ABCG2和OCT-4胞质内出现棕黄色颗粒,HIF-2α胞质内出现棕黄色颗粒,部分胞核也有少量表达。见图2~4。
2.4 胃癌组织中HIF-2α、ABCG2、OCT-4蛋白的表达

图1 HIF-2α、ABCG2及OCT-4 mRNA在胃癌组织中的表达 (RT-PCR)
表1 两组HIF-2α、ABCG2及OCT-4 mRNA相对表达量 (±s)
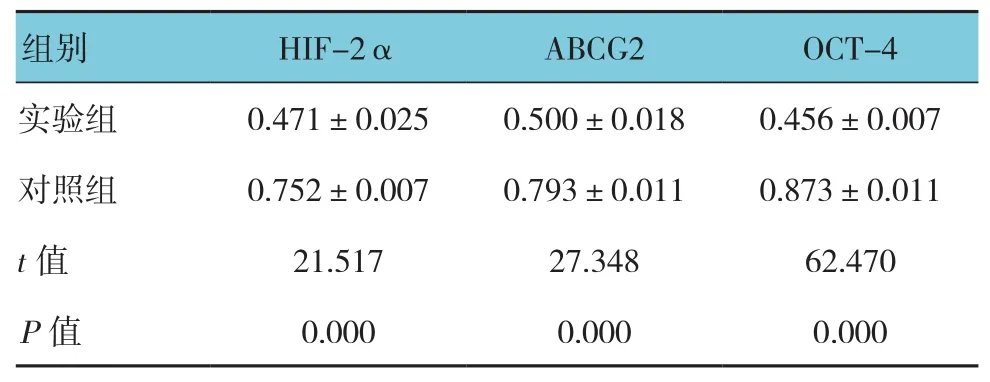
表1 两组HIF-2α、ABCG2及OCT-4 mRNA相对表达量 (±s)
组别 HIF-2α ABCG2 OCT-4实验组 0.471±0.025 0.500±0.018 0.456±0.007对照组 0.752±0.007 0.793±0.011 0.873±0.011 t值 21.517 27.348 62.470 P值 0.000 0.000 0.000
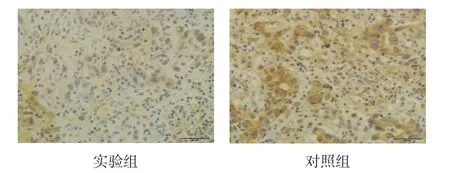
图2 ABCG2蛋白在胃癌组织中的表达
两组间HIF-2α、ABCG2及OCT-4蛋白的表达比较,差异有统计学意义(HIF-2α:t=41.306,P=0.000;ABCG2:t=56.607,P=0.000;OCT-4:t=31.048,P=0.000)。实验组低于对照组。见图5和表2。

图3 OCT-4蛋白在胃癌组织中的表达

图4 HIF-2α蛋白在胃癌组织中的表达
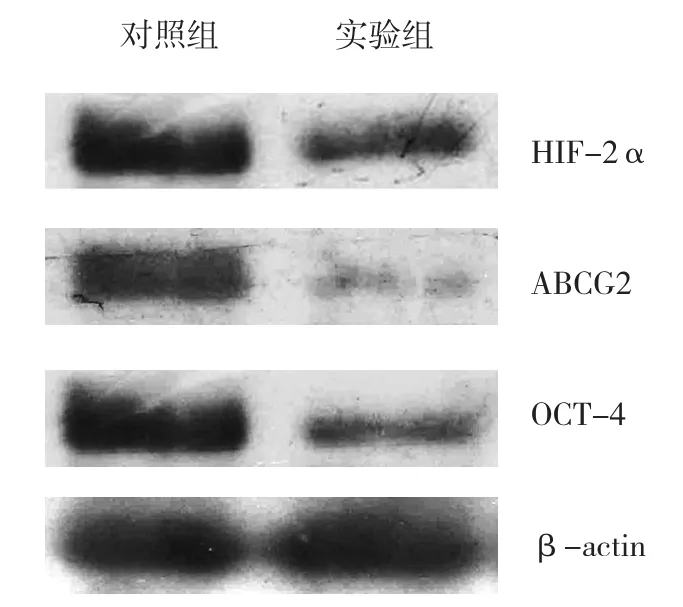
图5 胃癌组织中HIF-2α、ABCG2及OCT-4 蛋白的表达 (Western blot)
表2 两组HIF-2α、ABCG2及OCT-4蛋白相对表达量(±s)

表2 两组HIF-2α、ABCG2及OCT-4蛋白相对表达量(±s)
组别 HIF-2α ABCG2 OCT-4实验组 0.273±0.014 0.320±0.013 0.388±0.006对照组 0.678±0.009 0.818±0.008 0.538±0.006 t值 41.306 56.607 31.048 P值 0.000 0.000 0.000
3 讨论
FOLFOX方案治疗晚期胃癌的总体有效率不超过50%,中位生存期仅8.0~11.9个月[7-8],转移、复发率高达80%以上。许多研究表明,低氧微环境和肿瘤干细胞的存在是影响肿瘤放化疗敏感性及发生、发展、转移的重要原因[9-10]。因此研究胃癌患者的化疗是目前消化道肿瘤领域研究的一大重点。有研究证明,塞来昔布能抑制COX-2通路的表达,逆转多药耐药,改善肿瘤微环境,抑制细胞增殖,诱导细胞凋亡[11-13]。塞来昔布与化疗药物的联合应用具有协同抗肿瘤作用,可能通过抑制肿瘤细胞的增殖促进细胞凋亡[14]。本研究显示,治疗晚期胃癌时实验组有效率高于对照组。塞来昔布联合FOLFOX4化疗影响胃癌的发展和转移,提高患者的化疗敏感性,其疗效优于单独的FOLFOX4化疗方案。
慢性缺氧通常又是实体瘤广泛生长的原因[15]。微环境变化与缺氧诱导因子(hypoxia-inducible factors,HIF)有关[16]。HIF-1α、HIF-2α、HIF-3α 是 HIF的3个亚型,其中HIF-2α与CSCs的关系最密切,研究表明,HIF-2α通过减少OCT-4、Notch等多种干细胞通路的表达适应微环境的变化[17]。ABCG2是一种在肿瘤组织中高表达与化疗耐药相关的膜转运蛋白超家族成员。OCT-4是一种与肿瘤耐药相关的POU转录因子,其表达水平直接影响干细胞的分化方向[18-19]。多种CSCs高表达ABCG2、OCT-4和HIF-2α,CSCs的化疗耐药与HIF-2α-ABCG2和HIF-2α-OCT-4通路高表达有关[20-21]。此外研究显示,HIF-2α可调节ABCG-2、OCT-4的产生,缺氧HIF-2α/ABCG2/MDR途径可促进乳腺癌细胞多药耐药[5,22]。
本研究发现,在治疗晚期胃癌时,实验组中ABCG-2、OCT-4、HIF-2α的mRNA及蛋白表达较对照组降低,其机制可能通过降低HIF-2α-ABCG2和HIF-2α-OCT-4通路的表达,改善FOLFOX4化疗方案的化疗抵抗、多药耐药。本研究还发现,塞来昔布联合FOLFOX4化疗方案有协同抗肿瘤作用,能协同抑制肿瘤的发展和转移,逆转多药耐药,提高治疗效果。本研究为晚期胃癌的联合靶向治疗提供新的思路和方法,具有良好的临床应用前景,但仍需要进一步探索。
[1]TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics,2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[2]KUO C H, HU H M, TSAI P Y, et al. Short-term celecoxib intervention is a safe and effective chemopreventive for gastric carcinogenesis based on a Mongolian gerbil model[J]. World J Gastroenterol, 2009, 15(39): 4907-4914.
[3]ROCHA F T, LOURENÇO L G, JUCÁ M J, et al. Chemoprevention by celecoxib in reflux-induced gastric adenocarcinoma in Wistar rats that underwent gastrojejunostomy[J]. Acta Cir Bras, 2009,24(3): 189-194.
[4]ZHOU H C, LIU H B. The mechanism and prospect of celecoxib treatment of gastric cancer[J]. Chinese Journal of Digestive Surgery, 2013, 12(4): 317-320.
[5]ZHANG X Q, ZHANG H M, SUN X E, et al. Inhibitory effects and mechanism of 5-fluorouracil combined with celecoxib on human gastric cancer xenografts in nude mice[J]. Exp Ther Med, 2015,9(1): 105-111.
[6]WHO handbook for reporting results of cancertreatment[M].London: WHO Publication, 1979: 45.
[7]HAGHIGHI S, KASBKAR H, ESMAEILPOUR K, et al.Oxaliplatin, 5 fl uorouracil and leucovorin (FOLFOX4) as fi rst line chemotherapy in elderly patients with advanced gastric cancer[J].Asian Pac J Cancer Prev, 2016, 17(7): 3277-3280.
[8]JIN M L. New progress in advanced gastric cancer systemic chemotherapy[J]. Theory Pract Surg, 2003, 8(1): 18-20.
[9]GAO X M, ZHANG R, DONG Q Z, et al. Properties and feasibility of using cancer stem cells in clinical cancer treatment[J]. Cancer Biol Med, 2016, 13(4): 489-495.
[10]DAUER P, NOMURA A, SALUJA A, et al. Microenvironment in determining chemo-resistance in pancreatic cancer: Neighborhood matters[J]. Pancreatology, 2017, 17(1): 7-12.
[11]RUI LIU, HONGGANG ZHENG, WEIDONG LI, et al. Antitumor enhancement of Fei-Liu-Ping ointment in combination with celecoxib via cyclooxygenase-2-mediated lung metastatic inlammatory microenvironment in Lewis lung carcinoma xenograft mouse model[J]. J Transl Med, 2015, 13(1): 366-380.
[12]BING LIU, SHIGUI YAN, LIYAN QU, et al. Celecoxib enhances anticancer efect of cisplatin and induces anoikis in osteosarcoma via PI3K/Akt pathway[J]. Cancer Cell Int, 2017, 17(1): 1-8.
[13]XU H B, SHEN F M, LV Q Z. Celecoxib enhanced the cytotoxic effect of cisplatin in chemo-resistant gastric cancer xenograft mouse models through a cyclooxygenase-2-dependent manner[J].Eur J Pharmacol, 2016, 776(1): 1-8.
[14]MENG C, LU Z, FANG M, et al. Effect of celecoxib combined with chemotherapy drug on malignant biological behaviors of gastric cancer[J]. Int J Clin Exp Pathol, 2014, 7(11): 7622-7632.
[15]JUSTIN E. SWARTZ, AJIT J. POTHEN1, INGE STEGEMAN,et al. Clinical implications of hypoxia biomarker expression inhead and neck squamous cell carcinoma: a systematic review[J].Cancer Medicine, 2015, 4(7): 1101-1116.
[16]HU Y. Research progress of hypoxia inducible factor -1 alpha and 2 alpha in malignant tumors[J]. Oncology Progress, 2014, 12(2):122-125.
[17]ZHANG J, LI L. Stem cell niche: microenvironment and beyond[J]. J Biol Chem, 2008, 283(15): 9499-9503.
[18]ZHOU Y Y, ZENG F Y. Maintenance of pluripotent and selfrenewal transcription factors oct-4/Nanog of embryonic stem cells and associated control networks[J]. Genetics, 2008, 30(5): 529-536.
[19]BUITRAGO W, ROOP D R. Oct-4: the almighty POU ripotent regulator[J]. J Invest Dermatol, 2007, 127(2): 260-262.
[20]ZHANG H M, LIU X J, WANG J Y, et al. Correlation of HIF-2α, ABCG2 and OCT-4 with chemotherapy resistance in hu-man gastric cancer[J]. Medical Journal of Chinese People’s Liberation Army, 2015, 40(10): 816-820.
[21]CHEN F, FENG Y G, REN P P. The Correlation of helicobacter pylori infection and expres-sion of HIF-2α, Oct-4 in gastric carcinoma tissues[J]. Journal of Chinese Oncology, 2016, 22(10):789-793.
[22]LEI XIANG, ZHI-HENG LIU, QIN HUAN, et al. Hypoxiainducible factor-2a is associated with ABCG2 expression,histology-grade and Ki67expression in breast invasive ductal carcinoma[J]. Diagnostic Pathology, 2012, 7(1): 32-38.
