乳腺癌组织中Dab1蛋白表达及其临床相关性研究
2018-06-14王同玫张一奇文普帅毕竟李锦成
王同玫,张一奇,文普帅,毕竟,李锦成
(1.锦州医科大学附属第一医院 乳腺外科,辽宁 锦州 121001;2.锦州医科大学病理生理教研室,辽宁 锦州 121001;3.锦州医科大学 神经生物学实验室,辽宁 锦州 121001)
目前,乳腺癌已成为女性最常见的恶性肿瘤之一,也是引起女性死亡的重要病因。最新数据显示,每年全世界女性乳腺癌发病率为167万,其中发展中国家占52.9%[1];在我国,乳腺癌发病率也逐年增多,且呈年轻化趋势[2]。因乳腺癌的早期临床症状不明显,故多数患者首次诊断即已至中晚期。雌激素受体(ER)、孕激素受体(PR)、抗细胞增殖核抗原(Ki-67)、抑癌基因p53、癌基因Her2/neu等分子标志物的相继发现,在一定程度上阐释了乳腺癌的发病机制,也为其精准治疗提供候选靶点。但由于肿瘤的异质性,仍需进一步探究在乳腺癌发生发展中发挥关键作用的相关分子。
Disabled-1(Dab1)是细胞内重要的衔接蛋白,由555个氨基酸组成,N端有蛋白相互作用/磷酸酪氨酸结合的结构域P(I/PTB domain),可结合多个含NPxY的跨膜蛋白[3],其基因位于染色体1p32.2的不稳定区域,也就是基因修饰活跃和缺失区域;研究表明,在人类的肿瘤中Dab1低表达的情况并不少见,其异常表达于子宫内膜癌,脑胶质瘤中[4]。最近国内学者发现[5],该基因在乳腺癌细胞中表达降低,故推测该基因可能与乳腺癌发生、发展有关,但有关该基因是如何在乳腺癌的发生、发展中起作用及其与乳腺癌患者的临床病理特征的关系,尚未见相关报道。本研究通过免疫组织化学(简称免疫组化)检测乳腺癌组织中Dab1的表达水平,并分析其与患者临床病理特征的关系,从而为后续探究Dab1及其相关信号通路在乳腺癌中的生物学作用奠定基础。
1 资料与方法
1.1 一般资料
选取2015年10月-2017年5月本院手术切除后经病理诊断确诊为乳腺癌的50例石蜡包埋癌组织标本。其中导管原位癌19例,浸润性导管癌15例,黏液性癌4例,浸润性小叶癌3例,混合性(导管内癌及小叶癌)9例;均为女性;年龄35~65岁。同时取50例距其癌组织3 cm的癌旁组织作对照。以上所用标本均经10%的中性甲醛固定石蜡包埋,所有患者在术前均未进行放疗、化疗及免疫治疗。
1.2 试剂与设备
一抗兔抗人Dab1抗体购自Millipore公司,用于免疫组化的浓度为1∶100~1∶2 000,本实验选择的浓度为1∶200;免疫组化试剂盒以及DAB显色试剂盒购自北京中杉金桥生物技术有限公司。正置显微镜(德国Leica公司,4000b),超纯水机(美国Millipore公司,Milli-Q Integral 3),高压灭菌器(日本SANYO 公司,MLS-3780),温箱(Thermo Scientific),不锈钢高压锅。
1.3 方法
1.3.1 免疫组化染色 采用免疫组化SP法,严格按照说明书进行操作。主要步骤:每例标本取3张切片常规二甲苯脱蜡,梯度乙醇水化;3%过氧化氢室温孵育10 min消除内源性过氧化物酶的干扰,双蒸水洗3次;柠檬酸缓冲液(pH 6.0)高压抗原修复,待切片自然冷却至室温,PBS洗3次;滴加山羊血清室温封闭15 min;去除血清滴加Dab1一抗(用PBS稀释比例为1∶200),湿盒中4℃冰箱过夜;取出过夜的切片恢复室温,用PBS洗3次,滴加生物素标记二抗,37℃孵育15 min,PBS洗3次;滴加辣根酶标记的链霉卵白素工作液,37℃孵育15 min,PBS洗3次;DAB显色,显微镜下观察显色反应,若切片中发现棕黄色显色立即自来水冲洗终止反应;显色后的切片苏木精复染5 min,1%浓盐酸无水乙醇分化返蓝,梯度酒精脱水、二甲苯透明后中性树胶封片,在显微镜下观察并判断结果。
1.3.2 免疫组化染色阳性结果判定标准 Dab1表达主要为细胞核内黄褐色沉淀,根据免疫组化反应结果判断标准进行评分[6]。首先将染色强度进行评分:无色0分、淡黄色1分、棕黄色2分、黄褐色3分;再对阳性细胞所占百分比进行评分:显微镜下选5个视野先低倍后高倍进行观察,每个视野计数100个细胞,算出5个视野阳性细胞所占百分比,然后进行评分:阴性0分,阳性细胞≤10%为1分,11%~50%为2分,51%~75%为3分,>75%为4分。最后将每张切片两种评分相乘为其染色分数:0分为阴性,1~3分为弱阳性,4~6分为阳性,>8分为强阳性。为方便统计,阳性和强阳性判定为阳性表达;其他的均定义为阴性表达。
1.3.3 相关数据库乳腺癌样本中Dab1表达水平及生存分析 在Oncomine数据库中查询Dab1表达谱,先限定(Analysis type:Breast cancer vs Normal analysis),再输入基因名称,即可检索获得各乳腺癌相关的数据集,P<0.05的过滤选项;从GEO公共数据库(https://www.ncbi.nlm.nih.gov/geo/)寻找并下载乳腺癌基因芯片GSE45255和GSE26971数据。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计数资料以率(%)表示,采用χ2检验,Kaplan-Meier法绘制生存曲线,用Log-rank χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 Dab1蛋白在乳腺组织中的表达
Dab1蛋白阳性表达的棕黄色颗粒主要定位于细胞核中;Dab1蛋白在乳腺癌癌旁组织中的阳性表达率84.0%(42/50)高于其在相应的乳腺癌组织的阳性表达率 48.0%(24/50)(χ2=100.00,P =0.000)。见图1。
2.2 乳腺癌组织中Dab1蛋白表达与临床病理特征的关系
Dab1蛋白在乳腺癌组织的阳性表达率随着肿瘤分化程度的降低和肿瘤TNM分期的增高而增高(P<0.05),无淋巴结转移者高于有淋巴结转移者(P<0.05);而与患者的年龄、是否绝经、肿瘤的病理类型及肿瘤大小无关(P>0.05)。见附表。
2.3 乳腺癌组织中Dab1蛋白表达与患者生存的关系
在Oncomine数据库中检索乳腺癌中Dab1的表达情况,结果发现:明显下调(P<0.05,见图2A),进一步证实本研究结果。另外,下载GEO数据库中乳腺癌基因表达数据,并进行Kaplan-Meier法分析,结果显示:Dab1高表达的乳腺癌患者比低表达的患者生存时间长,提示Dab1可作为判断乳腺癌预后的分子指标(见图2B)。
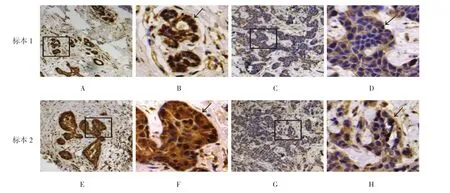
图1 Dab1在乳腺癌组织及癌旁组织中的表达
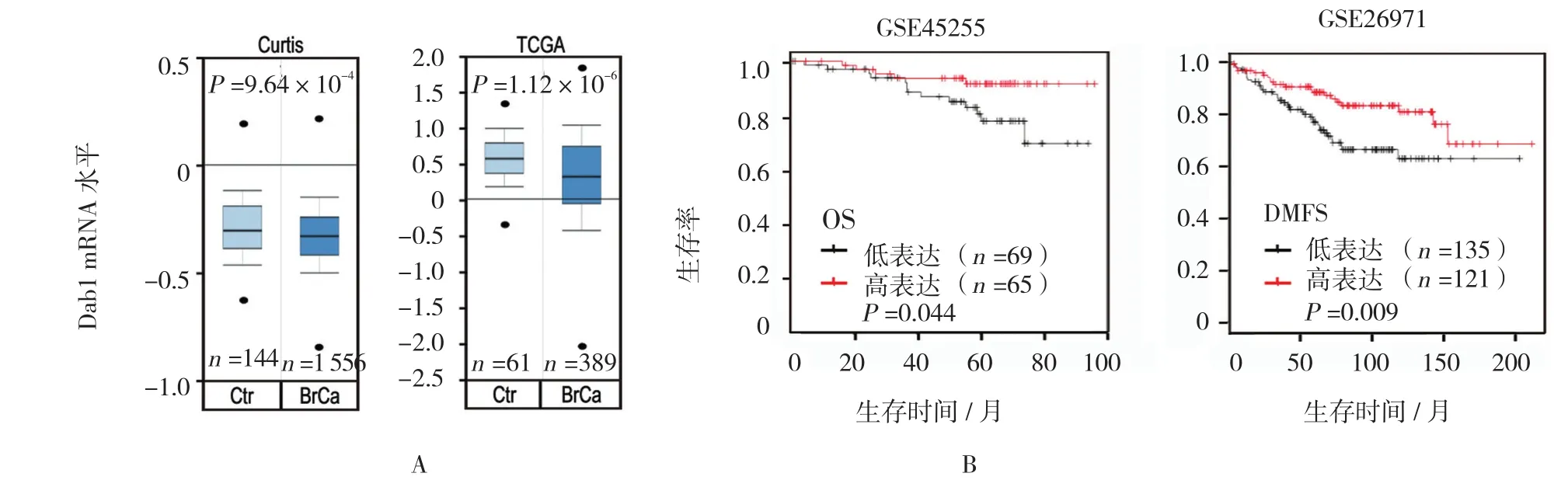
图2 乳腺癌组织中Dab1蛋白表达与患者生存的关系
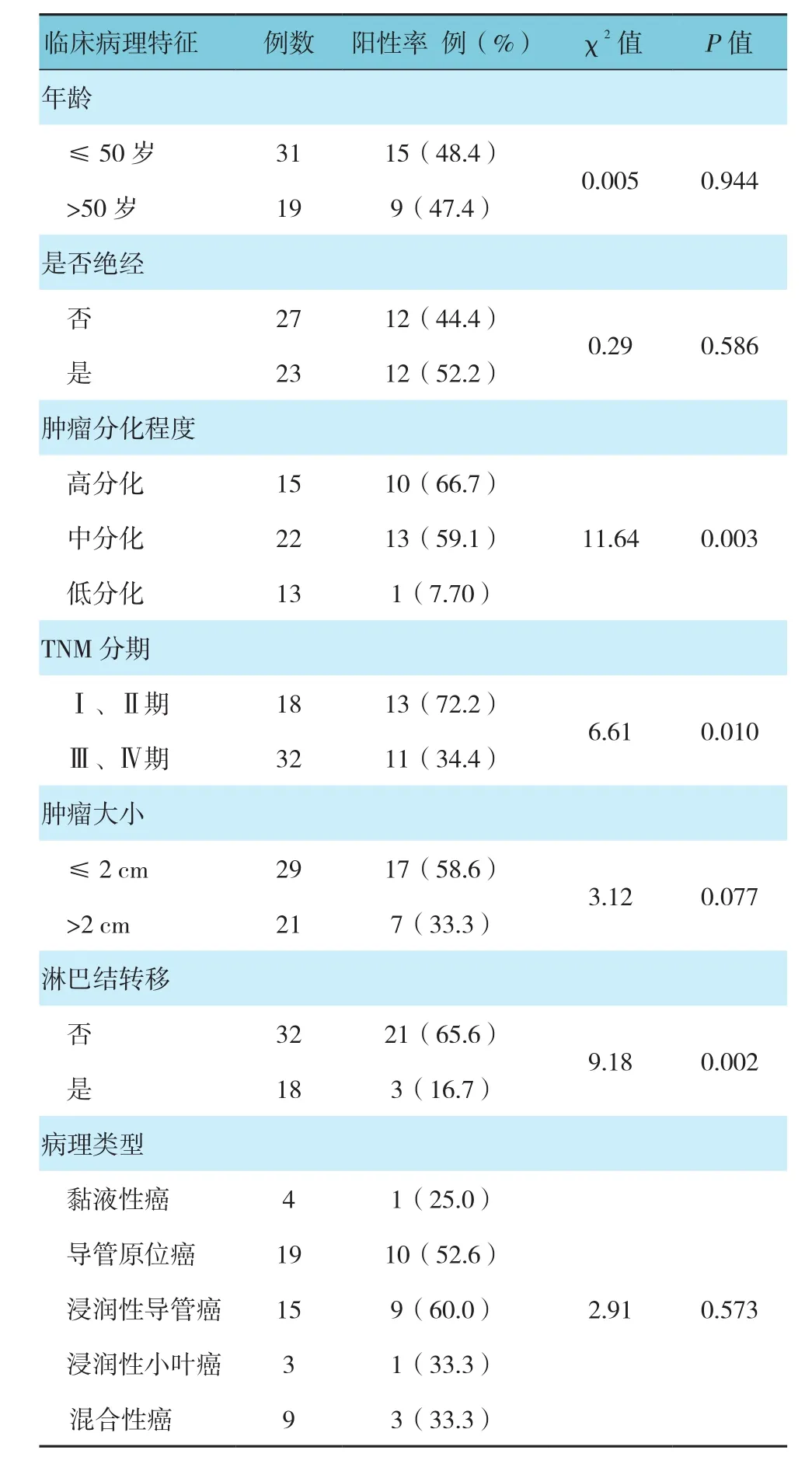
附表 临床病理特征与Dab1蛋白表达的关系
3 讨论
我国乳腺癌的发病率呈逐年上升的趋势,严重危害着女性的健康。乳腺癌的发生、发展是一个涉及多基因、多途径的复杂过程,相关分子标志物的相继出现虽然在一定程度上为乳腺癌的精准治疗提供靶点,但由于肿瘤的异质性,仍需进一步去探究在乳腺癌的发生、发展中起关键作用的相关分子。Dab1基因是近年发现的一种基因,其在发育脑组织中高表达[7],可介导Reelin信号参与调控细胞骨架,进而影响神经元的迁移和定位[8]。还有文献报道[9]:该基因位于1个大的基因组不稳定区域,即普通型脆性位点(common fragile sites,CFS),该区域的基因易发生缺失。因此,许多CFS基因,如PARK2、FHIT及WWOX等,在肿瘤中呈抑制的状态,其中WWOX和FHIT已被证实为抑癌基因,其表达水平的下调与肿瘤患者不良预后呈正相关[10-12]。因此,定位于该区域的Dab1基因是否也有抑癌基因的作用值得深入探究。已有研究表明该蛋白在子宫内膜癌和脑胶质瘤中表达异常,但其在乳腺癌组织中表达情况及其对乳腺癌发生发展的作用并不清楚。
本研究结果发现,Dab1蛋白在乳腺癌组织中表达降低,其在乳腺癌组织的阳性表达率低于其在癌旁组织的表达(P<0.05);同时,肿瘤数据库结果提示,与癌旁组织比较,Dab1 mRNA的表达水平在乳腺癌组织中是降低的,这也从侧面提示Dab1表达的减低可能与乳腺癌的发生与发展有关。为进一步了解Dab1在哪些类型的乳腺癌中低表达,笔者分析该蛋白在乳腺癌组织中的表达与其临床病理特征的关系,结果发现,随着肿瘤分化程度的降低,Dab1蛋白表达随之减少,随着肿瘤TNM分期越晚,Dab1蛋白表达就越低,在有淋巴结转移的乳腺癌组织中Dab1的阳性表达率低于其在癌旁组织中的表达,而Dab1的经典作用为介导Reelin信号,调控细胞骨架而影响神经元的迁移和定位,众所周知,众多异常表达的细胞骨架调控分子,如EZRIN[13]、IQGAP1[14]在肿瘤转移中发挥关键作用,故在有淋巴结转移的乳腺癌组织中Dab1的阳性率降低更多可能与Dab1参与细胞迁移,从而负调节肿瘤细胞的迁移有关。此外,Dab1蛋白表达与乳腺癌患者的年龄、是否绝经、肿瘤的病理类型及大小无关。由此可见,肿瘤的分化程度越低,TNM分期越晚、恶性程度越高的乳腺癌,Dab1的表达越低,故推测乳腺癌的发病中该基因的低表达可能发生在疾病的晚期阶段。曹让娟等[5]的研究表明,Dab1对正常细胞周期发挥调控作用,故认为其可能是1个潜在的抑癌组织,有望成为乳腺癌治疗的1个新靶点。而且Kaplan-Meier生存分析提示,Dab1高表达的患者总生存率高于低表达者(P=0.044),说明Dab1的表达与乳腺癌患者的预后有关,提示其可能成为乳腺癌患者预后评估的生物学指标。
综上所述,Dab1在乳腺癌组织中低表达,与患者的肿瘤分化程度、TNM分期、淋巴结转移及预后有关。因此,Dab1有可能成为乳腺癌恶性程度判断、预后评估和治疗的有效生物标志物,但是由于临床研究样本数太少,还需要大量临床研究进一步验证。
[1]REBECCA L S, KIMBERLY D M, AHMEDIN J, et al. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1): 5-29.
[2]易琳, 刘兴明, 林丁, 等. 血清CA153,CA125,CEA联合检测在乳腺癌诊断中的价值[J]. 重庆医科大学学报, 2012, 37(9): 802-805.
[3]TISSIR F, GOFFINET A M. Reelin and brain development[J]. Nat Rev Neurosci, 2003, 4(6): 496-505.
[4]MCAVOY S, ZHU Y, PEREZ D S, et al. Disabled-1 is a large common fragile site gene, inactivated in multiple cancers[J]. Genes Chromosomes Cancer 2008, 47(2): 165-174.
[5]曹让娟, 李凯, 邢琬莹, 等. Disabed-1在人乳腺癌细胞中的表达及其对细胞周期的影响[J]. 吉林大学学报(医学版), 2016,42(5): 932-936.
[6]许良中. 免疫组织化学反应结果判断标准[J]. 中国癌症杂志,1996, 6(4): 230-231.
[7]TROTTER J, LEE G H, KAZDOBA T M, et al. Dab1 is required for synaptic plasticity and associative learning[J]. Neurosci, 2013,33(39): 15652-15668.
[8]CHAI X, FORSTER E, ZHAO S, et al. Reelin stabilizes the actin cytoskeleton of neuronal processes by inducing n-cofilin phosphorylation at serine[J]. Neurosci, 2009, 29(1): 288-299.
[9]MCAVOY S, ZHU Y, PEREZ D S, et al. Disabled-1 is a large common fragile site gene, inactivated in multiple cancers[J]. Gene Chromosome Cancer, 2008, 47(2): 165-174.
[10]GARDENSWARTZ A, AQEILAN R I. WW domain-containing oxidoreductase’s role in myriad cancers: clinical significance and future implications[J]. Exp Biol Med (Maywood), 2014, 239: 253-263.
[11]GAO G, KASPERBAUER J L, TOMBERS N M, et al. A selected group of large common fragile site genes have decreased expression in oropharyngeal squamous cell carcinomas[J]. Genes Chromosome Cancer, 2014, 53(5): 392-401.
[12]GAO G, SMITH D I, WWOX, large common fragile site genes,and cancer[J]. Exp Biol Med (Maywood), 2015, 240(3): 285-295.
[13]刘洋, 王军, 李爱东, 等. Ezrin蛋白的生物学作用及其与肿瘤转移的关系[J]. 现代生物医学进展, 2015, 15(13): 2551-2580.
[14]王夏炜, 曹永倩, 张芮. 支架蛋白IQGAP1与肿瘤研究现状[J].中华肿瘤防治杂志, 2014, 21(20): 1657-1661.
