二甲双胍联合非诺贝特对非酒精性脂肪性肝炎患者胰岛素抵抗指数和氧化应激反应的影响*
2018-06-14劳雪莲韦良宏陈海东沈丽丽
劳雪莲,韦良宏,陈海东,沈丽丽
(广西壮族自治区钦州市第一人民医院消化内科,广西 钦州 535000)
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)是指无过量饮酒史的患者伴有肝小叶内混合性炎性细胞浸润和肝实质细胞发生脂肪性病变的一种慢性肝病,我国NASH的发病率仅次于病毒性肝炎,是影响国民健康较常见的疾病之一,严重者可进展成隐匿性肝硬化甚至肝癌[1]。NASH的发病机制较复杂且尚不明确,目前普遍认为胰岛素抵抗(insulin resistance,IR)和氧化应激反应形成的“二次打击”学说是造成NASH最主要的病理机制[2]。因此,改善IR和抑制炎性反应是治疗NASH的首要目标[3]。目前,临床特异性治疗NASH的药物较少,积极探索发病机制及有效的治疗手段成为NASH领域的重要课题[4]。二甲双胍作为强效降血糖药和胰岛素增敏剂,可降低患者肝脏游离脂肪酸(free fat acids,FFA)和炎性因子的水平,从而延缓肝细胞脂肪性病变[5]。非诺贝特属于氯贝丁酸衍生物,可降低三酰甘油(TG)的水平及机体氧化应激反应[6]。目前,临床关于二甲双胍联合非诺贝特治疗NASH的疗效尚存在较大争议,本研究中对比二甲双胍联合非诺贝特和单药治疗NASH的疗效及对IR和氧化应激指标的影响,为治疗NASH提供新的方案。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合《非酒精性脂肪性肝病诊疗指南(2010年修订版)》关于 NASH的诊断标准[7];经血常规、尿常规、肝功能检查及肝脏影像学检查,符合诊断标准;临床资料完整;本研究经医院医学伦理委员会批准,患者签署知情同意书。
排除标准:酒精性、药源性、肝病毒感染性、自身免疫性肝疾病;急性感染、创伤或各种应激情况;糖尿病、心肌梗死、冠心病、高血压、甲状腺功能亢进、系统性红斑狼疮等疾病;肝硬化、肝癌、肝性脑病;长期酗酒;近1个月规律应用调脂药物、抗氧化维生素、糖皮质激素、雌激素类等;精神障碍,智力异常;对受试药物过敏及不能耐受。
病例选择与分组:选择医院消化内科2017年1月至7月确诊并收治的NASH患者112例,按随机数字表法分为A组31例,B组34例,C组47例。另选择同时期在我院体检中心进行健康体检的健康受试者25例,作为对照组(D组)。4组受试者一般资料比较,差异无统计学意义(P >0.05),具有可比性。详见表 1。

表1 4组受试者一般资料比较
1.2 方法
所有患者均进行基础治疗,包括饮食干预、适当运动等,调整患者心态,消除负面情绪和心理负担,保证正常休息,给予甘草酸二铵肠溶胶囊(正大天晴药业集团股份有限公司,国药准字H20040628,规格为每粒50 mg),每次150 mg,每日3次,进行肝降酶治疗。A组患者口服二甲双胍缓释片(商品名倍顺,成都恒瑞制药有限公司,国药准字H20030952,规格为每片0.5 g),每次 0.5 g,每日 1次。B组患者口服非诺贝特胶囊(商品名力平之,法国利博福尼制药公司,国药准字H20140369,规格为每粒 0.2 g),每次 0.2 g,每日 1次。C组患者每日晨服二甲双胍,晚餐时随餐服用非诺贝特,剂量同A组和B组。3组疗程均为3个月。D组受试者不作任何治疗。
1.3 观察指标
安全性指标:于治疗前和治疗结束后5 d,抽取受试者空腹静脉血,过夜禁食12 h后,次日晨取坐位,取肘静脉血,加入枸橼酸钠抗凝,4℃ 3 000 r/min离心10 min,分离血浆,于-80℃冰箱保存,血标本采集完毕后测量身高、体质量及血压。
实验室指标:采用Beckman全自动生化分析仪检测血常规生化指标,包括丙氨酸氨基转移酶(ALT)、天门冬酸氨基转移酶(AST)、谷氨酰转移酶(GGT)。
肝脏B超检查[8]:采用Phillip HD7型超声诊断仪观察肝脏形态、轮廓、肝实质回声、远场回声、出肝表面回声线、肝内管状结构、肝内强回声结节共7项指标,并进行量化评分。分数越高,肝脏脂肪变性越严重。
胰岛素抵抗指数(HOMA-IR)[9]:根据 1985年由Matthew提出并简化后的应用稳态模式评估,HOMA-IR=空腹血糖(FBG)× 空腹胰岛素浓度(FIns,U /mL) /22.5,≥2.69时考虑存在胰岛素抵抗。
氧化应激指标:采用酶联免疫吸附检测(ELISA)试剂盒检测患者血清中超氧化物歧化酶(SOD)和丙二醛(MDA)水平,试剂盒购自上海基免实业有限公司。
1.4 统计学处理
2 结果
结果见表2至表6。
表2 3组患者肝脏B超检查结果评分比较(,分)

表2 3组患者肝脏B超检查结果评分比较(,分)
注:与 A 组治疗后比较,aP <0.05;与 B 组治疗后比较,bP<0.05。下表同。
组别A组(n=31)B组(n=34)C组(n=47)F值P值治疗前9.41 ± 1.26 9.35 ± 1.18 9.24 ± 0.96 1.364 0.151治疗后6.98 ± 0.91 7.02 ± 1.05 4.93 ± 0.87ab 5.471 0.029 t值4.763 6.128 6.965 P值0.023 0.019 0.014
表3 4组受试者HOMA-IR比较()

表3 4组受试者HOMA-IR比较()
注:与 C 组治疗后比较,cP <0.05。
组别A组(n=31)B组(n=34)C组(n=47)D组(n=25)F值P值治疗前3.49 ± 0.46 3.41 ± 0.53 3.46 ± 0.47-1.676 0.127治疗后2.79 ± 0.57 2.98 ± 0.38 2.31 ± 0.34ab 2.01 ± 0.40abc 5.197 0.036 t值4.738 1.224 6.315 P值0.032 0.050 0.018
表4 4组受试者肝功能指标比较(,U/L)

表4 4组受试者肝功能指标比较(,U/L)
组别 ALT AST GGT A 组(n=31)B组(n=34)C组(n=47)D 组(n=25)F值P值治疗前116.74 ± 33.86 114.49 ± 30.22 112.98 ± 29.35-1.117 0.162治疗后55.77 ± 22.31 54.68 ± 23.74 39.68 ± 14.76ab 36.07 ±3.51ab 6.983 0.027 t值5.011 5.124 8.437 P值0.031 0.030 0.004治疗前58.77 ± 15.31 57.68 ± 14.74 57.13 ± 14.29-1.194 0.156治疗后48.19 ± 12.65 46.73 ± 13.52 33.25 ± 9.84ab 29.54 ± 6.92ab 7.968 0.013 t值2.975 4.203 5.678 P值0.041 0.032 0.014治疗前81.64 ± 27.15 83.52 ±29.24 80.49 ± 30.22-1.818 0.077治疗后64.08 ± 19.27 63.47 ± 24.35 41.29 ± 15.62ab 35.31 ± 11.46ab 8.983 0.011 t值5.437 5.302 7.469 P值0.026 0.027 0.006
表5 4组受试者血清SOD和MDA水平比较()

表5 4组受试者血清SOD和MDA水平比较()
组别 SOD(U /g)A组(n=31)B组(n=34)C组(n=47)D组(n=25)F值P值治疗前69.75 ± 36.34 72.81 ± 21.46 71.26 ± 23.49-1.397 0.214治疗后87.18 ± 37.42 91.73 ± 31.84 106.38 ± 40.62ab 115.74 ± 28.75ab 6.759 0.029 t值5.638 6.725 9.371 MDA(nmol/L)P值0.024 0.011 0.001治疗前6.54 ± 1.31 6.71 ± 1.29 6.62 ± 1.42-0.986 0.325治疗后5.24 ± 0.99 5.15 ± 1.07 4.08 ± 0.73ab 3.96 ± 0.84ab 7.613 0.017 t值3.869 3.417 5.221 P值0.039 0.040 0.028
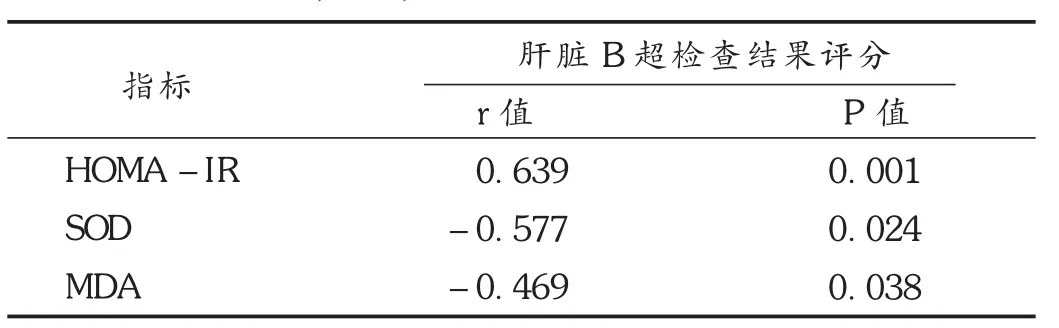
表6 HOMA-IR,SOD,MDA与肝脏B超评分结果相关性分析
3 讨论
肥胖、血脂升高、2型糖尿病均属NASH的重要危险因素,因此,NASH也逐渐成为威胁人类健康的主要原因之一[10]。NASH是指除了酒精因素和其他明确的肝损伤因素以外肝细胞发生大泡性脂肪性病变。关于NASH的发病机制尚不明确,但“二次打击”学说是目前接受程度最高的发病机制假说。胰岛素抵抗导致脂肪酸和TG在肝脏内大量蓄积,易引发单纯脂肪肝,这是“第一次打击”;脂肪大量蓄积继而引起过度氧化应激反应,损伤线粒体功能,促使炎性因子大量分泌,导致肝细胞进一步发生炎性反应,严重者可导致肝细胞纤维化坏死[11]。
目前,临床治疗NASH的药物主要包括胰岛素增敏剂、调脂药、血管紧张素Ⅱ受体拮抗剂、保肝降酶药等[12]。其中,二甲双胍是主要的胰岛素增敏剂,可通过抑制葡萄糖经肠道吸收,同时增加周围组织对胰岛素的敏感性,促进葡萄糖的吸收和利用,降低肝脏内脂质的聚集[13]。非诺贝特属强效调脂药,具有抗炎、抗氧化作用,可促进肝脏脂质代谢。目前,对于贝特类药物用于NASH存有明显争议,有学者认为,调脂类药物可促使脂质在肝脏中代谢,增加肝脏负担[14]。本研究中探讨二甲双胍联合非诺贝特对NASH患者肝功能、胰岛素抵抗及氧化应激反应的影响,为胰岛素增敏剂联合调脂药的临床应用提供参考。结果显示,联合用药组患者肝功能改善情况及胰岛素抵抗和氧化应激水平均较治疗前有明显改善,且临床疗效优于单药治疗组。提示其主要作用机制可能为二甲双胍联合非诺贝特可降低胰岛素抵抗和氧化应激反应有关。
正常情况下,机体肝脏脂肪合成和代谢处于动态平衡中,若发生IR则会抑制脂肪合成,促使脂肪分解,大量产生游离脂肪酸,导致TG在肝内大量蓄积,损伤肝脏细胞;肝细胞受损后,胰岛素受体表达受到明显影响,增加胰岛素抵抗性[15]。肝脏内吸收大量脂肪酸后,易生成活性氧自由基,损伤线粒体膜,同时促使巨噬细胞释放炎性因子,诱发炎性反应;炎性因子可刺激肝星形细胞分化,促使细胞外基质合成,引发肝细胞纤维化病变。二甲双胍和非诺贝特可通过刺激细胞内胰岛素受体酪氨酸激酶的活性,增加胰岛素敏感性,改善肝脏内脂质代谢紊乱,减少游离脂肪酸和炎性因子对干细胞的损伤,降低血清TC和TG水平,发挥调血脂和抗炎作用[16]。
综上所述,二甲双胍联合非诺贝特通过降低患者胰岛素抵抗及氧化应激反应,可有效改善NASH患者的血脂代谢情况和肾功能损伤,具有良好的临床推广价值。
[1]黄婷婷,周玉荣,张向君,等.非酒精性脂肪肝治疗进展[J].医学综述,2015,21(8):1406-1409.
[2]Mikolasevic I,Milic S,Wensveen TT,et al.Nonalcoholic fatty liver disease - A multisystem disease[J].World J Gastroenterol,2016,22(43):9488-9505.
[3]Lonardo A,Nascimbeni F,Maurantonio M,et al.Nonalcoholic fatty liver disease:Evolving paradigms[J].World J Gastroenterol,2017,23(36):6571-6592.
[4]Temple JL,Cordero P,Li JW,et al.A Guide to Non - Alcoholic Fatty Liver Disease in Childhood and Adolescence[J].Int J Mol Sci,2016,17(6):E947.
[5]Zwolak A,Sãabczyńska O,Semeniuk J,et al.Metformin Changes the Relationship between Blood Monocyte Toll-Like Receptor 4 Levels and Nonalcoholic Fatty Liver Disease—Ex Vivo Studies[J].PLoS One,2016,11(3):e0150233.
[6]Abd El- Haleim EA,Bahgat AK,Saleh S.Resveratrol and fenofibrate ameliorate fructose-induced nonalcoholic steatohepatitis by modulation of genes expression[J].World J Gastroenterol,2016,22(10):2931-2948.
[7]中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南[J].中华肝脏病杂志(电子版),2010,2(4):43-48.
[8]黄一茜,张月娥,孟惠茹,等.大黄联合阿托伐他汀对非酒精性脂肪肝血脂及氧化应激指标的影响[J].中国药业,2015,24(13):10-11.
[9]中华医学会糖尿病学分会微血管并发症学组.糖尿病肾病防治专家共识(2014版)[J].中华糖尿病杂志,2014,6(11):792-801.
[10]Ballestri S,Lonardo A,Bonapace S,et al.Risk of cardiovascular,cardiac and arrhythmic complications in patients with non-alcoholic fatty liver disease[J].World J Gastroenterol,2014,20(7):1724-1745.
[11]Pappachan JM,Babu S,Krishnan B,et al.Non - alcoholic Fatty Liver Disease:A Clinical Update[J].J Clin Transl Hepatol,2017,5(4):384 - 393.
[12]Arab JP,Candia R,Zapata R,et al.Management of nonalcoholic fattyliverdisease:Anevidence-basedclinicalpracticereview[J].World J Gastroenterol,2014,20(34):12182 - 12201.
[13]Abd El-Kader SM,El-Den Ashmawy EM.Non-alcoholic fatty liver disease:The diagnosis and management[J].World J Hepatol,2015,7(6):846 - 858.
[14]van der Veen JN,Lingrell S,Gao X,et al.Fenofibrate,but not ezetimibe,prevents fatty liver disease in mice lacking phosphatidylethanolamineN - methyltransferase[J].JLipid Res,2017,58(4):656 - 667.
[15]Stojsavljevi S, GomeriPM, ViroviJL, et al.Adipokines and proinflammatory cytokines,the key mediators in the pathogenesis of nonalcoholic fatty liver disease[J] .World J Gastroenterol,2014,20(48):18070 - 18091.
[16]Linden MA,Lopez KT,Fletcher JA,et al.Combining metformin therapy with caloric restriction for the management of type 2 diabetes andnonalcoholic fatty liver disease in obese rats[J].Appl Physiol Nutr Metab,2015,40(10):1038 - 1047.
