人血小板衍生生长因子BB亚型包涵体复性与纯化
2018-06-13孙卫国郑本献熊志红杨秉芬刘艳华张灵霞
孙卫国,郑本献,熊志红,杨秉芬,刘艳华,张灵霞
1.解放军第309医院 结核病研究所,全军结核病防治重点实验室,结核病诊疗新技术北京市重点实验室,北京 100091;2.军事科学院 第61研究所门诊部,北京 100141
血小板衍生生长因子(platelet-derived growth⁃factor,PDGF)是由细胞产生的肽类生长因子,与受体结合后,通过Ras/GTP激活丝裂原活化蛋白激酶信号通路,促进细胞的有丝分裂[1]。PDGF参与机体组织的生长发育、创伤愈合,肿瘤的发生、发展及动脉粥样硬化等[2]。在PDGF所有亚型中,PDGF-BB行使PDGF的主要功能,在创伤愈合的各个阶段发挥重要作用[3]。PDGF-BB能加速成骨细胞内的DNA合成与修复,刺激成骨细胞的复制和胶原降解,从而促进骨折造成的创伤愈合[4]。目前利用原核表达系统规模化生产PDGF-BB细胞因子的主要困难是表达量非常低,复性率不高,纯化条件不稳定,生物活性也不高。本实验室根据原核表达特点,参照生物信息学和软件Vector NTI suitor7.0分析结果,提高了PDGF-BB的表达量,占菌体总蛋白的25%[5]。在此,我们对基因工程下游技术进行探索,对PDGF-BB包涵体的变性、复性方法和条件,以及纯化工艺的优化进行多次尝试,提高了PDGF-BB包涵体的复性率达40%以上,同时稳定了重组蛋白的纯化工艺,获得了纯度大于95%且具有良好生物活性的重组PDGF-BB蛋白。
1 材料与方法
1.1 材料
NIH3T3细胞株、宿主菌株大肠杆菌BL21(DE3)、表达载体pET-PGDF-BB由本室保存。酵母提取物、胰蛋白胨购自Oxoid公司;PDGF-BB标准品购自中国药品生物制品检定所;PDGF-BB抗体、辣根过氧化物酶(HRP)标羊抗兔IgG购自Ab⁃cam公司;层析用填料SP SepharoseFF、分子筛填料Sephacryl S300购自GE公司;FPLC蛋白纯化分离系统购自Bio-Rad公司;其他生化试剂均为国产分析纯产品。
1.2 PGDF-BB重组蛋白的原核高表达
通过生物信息学分析,参照生物软件对PGDF-BB编码序列按照同义密码子原则进行置换优化,设计合成了PDGF-BB全长序列,3′端终止密码为TAA,构建了原核表达载体pET-PGDFBB,工程菌接种含卡那霉素的LB培养基,37℃振摇培养,当菌液D600nm值达0.5时,加入IPTG至终浓度为0.2mmol/L,37℃诱导表达7h,离心收集沉淀菌体,加入 50mmolTris-HCl(pH8.0)缓冲液,4℃条件下超声波破碎,SDS-PAGE分析蛋白的表达量。
1.3 重组PGDF-BB蛋白包涵体洗涤溶解与初步纯化
包涵体的初步洗涤对包涵体的复性极其重要,可将菌体的外膜蛋白、核酸、质粒DNA等杂质除去,避免影响随后的复性过程。为了增加去垢剂洗涤能力,可在洗涤缓冲液(50mmol/LNaCl,50mmol/LTris,1mmol/LEDTA,0.5% Triton-X100+梯度尿素)内加入一定浓度的盐离子。洗涤后的包涵体用8mol/L尿素加2%巯基乙醇缓冲液充分溶解后,上样分子筛层析柱Sephacryl S300,收集紫外检测下各分离蛋白峰进行SDSPAGE,分析初步纯化后包涵体溶液的纯度。
1.4 PGDF-BB包涵体复性与再纯化
PDGF-BB成熟肽是由2个相同的单体蛋白PDGF-B通过二硫键形成的同型二聚体。相对单体蛋白而言,多聚体蛋白因为分子间与分子内二硫键容易错配导致复性比较困难,针对不同蛋白需要摸索不同的复性方法。稀释复性是将变性蛋白质溶液直接加入复性缓冲液中,降低单位体积内的变性蛋白浓度,减少错配几率,适合多聚体蛋白的复性,因而是一种更简单和快速的方法。收集经初步分子筛纯化的包涵体上清液,以1∶100的比例和4mL/h的速度滴加稀释到pH6.0的复性液(25mmol/LTris-Cl,0.1mmol/LNaCl,0.5mmol/L EDTA,4mol/L尿 素 ,0.1mmol/L GSSG,0.2mmol/LGSH,1%甘油)中,4℃放置24 h左右,取复性液按1∶10的比例置入pH6.0的透析 液(25mmol/L Tris-Cl,0.1mmolNaCl,0.5 mmol/LEDTA,2mol/L尿素,0.1mmol/LGSSG,0.2mmol/LGSH)中透析,10h换透析液一次,依次降低尿素浓度至1、0.5、0mol/L,高速离心除去沉淀。取上清液上样SPSepharoseFF阳离子交换 柱 ,用 0.2 mol/L NaCl、20 mmol/L Tris-Cl(pH6.0)的缓冲液冲洗杂蛋白,用0.5mol/L NaCl、20mmol/LTris-Cl(pH7.4)的缓冲液洗脱目的蛋白;收集目的蛋白,SDS-PAGE分析经复性纯化后重组PGDF-BB蛋白的纯度。
1.5 重组PDGF-BB蛋白的Western印迹鉴定与活性测定
取纯化的PDGF-BB蛋白进行14%的SDSPAGE,半干法转移至硝酸纤维素膜上,用5%脱脂奶粉于37℃封闭1h,兔抗人PDGF-BB抗体于4℃孵育过夜,PBST缓冲液洗涤3次后,室温条件下与HRP标记的羊抗兔IgG结合2h,PBST缓冲液洗涤4次,每次5min,ECL暗室自动曝光显影验证重组蛋白的抗原性。
将培养的对数期NIH3T3细胞以含10%小牛血清的DMEM调成细胞悬液,按1×104/孔传入96孔板,37℃孵箱中培养48h,更换成含0.5%胎牛血清的DMEM培养基继续培养24h,依次加入用维持培养液稀释的重组蛋白和对照标准品PDGF-BB,每浓度梯度做3个平行孔,37℃、5%CO2条件下培养72h,MTT法检测各孔的D490nm值,绘制对应的D490nm值与PDGF-BB浓度曲线。
2 结果
2.1 PGDF-BB重组蛋白的原核高表达
参照生物信息学和生物软件分析,合成PGDF-BB编码序列,克隆构建原核表达载体pET-PGDF-BB,重组菌经IPTG诱导表达7h,收集菌体超声波破碎,SDS-PAGE分析结果,图1箭头示重组蛋白,编码核酸经过优化后,重组蛋白表达水平明显提高,表达量从优化前的10%(4泳道)上升到25%左右(1、2泳道)。超声波破碎后,重组蛋白以包涵体的形式存在于菌体沉淀中。
2.2 PGDF-BB包涵体洗涤溶解与分子筛层析纯化
包涵体用 50mmol/LNaCl、50mmol/LTris、1mmol/LEDTA、0.5%Triton-X100洗涤2次,离心收集上清进行电泳分析,洗涤后的包涵体分别用2、4、8mol/L尿素加2%巯基乙醇缓冲液充分溶解,离心收集上清进行包涵体溶解度检测,实验结果如图2,经过3次0.5%Triton-X100洗涤后,上清中没有目的蛋白出现,大多数杂蛋白被除去,包涵体得到富集。梯度尿素溶解后发现包涵体只能溶解在8mol/L尿素中,这为后续大规模纯化带来方便。
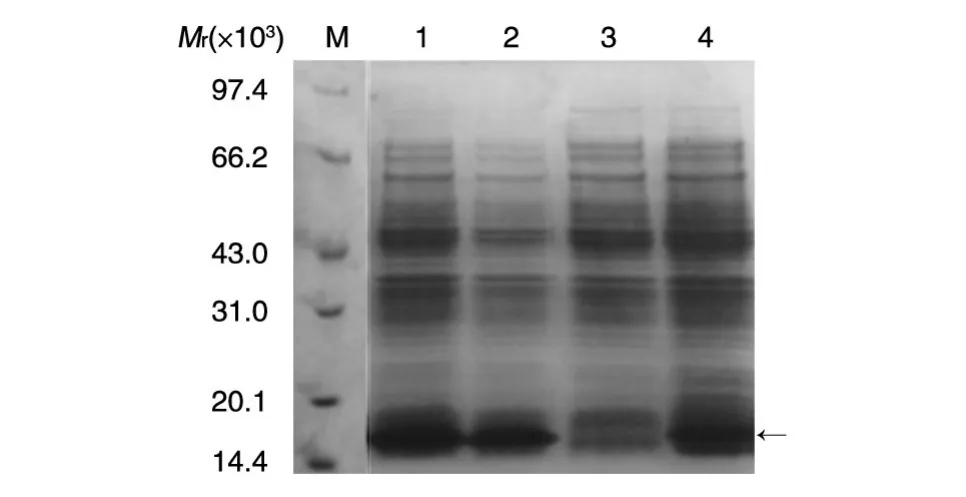
图1 PGDF-BB优化序列诱导后的全菌体蛋白SDS-PAGE分析
包涵体用8mol/L尿素加2%巯基乙醇充分溶解,高速离心收集上清上样过分子筛层析柱Sep⁃hacrylS300,FPLC检测各分离蛋白峰,SDS-PAGE分析经初步纯化后包涵体溶液的纯度,结果见图3、4,包涵体溶液得到部分富集。
2.3 PGDF-BB包涵体复性与离子交换层析
分别采用透析、稀释和滴加复性的方法对PGDF-BB包涵体复性,比较实验结果发现滴加复性相对其他方法而言可以获得更高的复性率。滴加复性的方法更适合含有较多分子间或分子内二硫键的多聚体蛋白,滴加样品的速度和复性液的组成都会影响最终的复性率。为了便于后续阳离子交换层析,将复性液的pH值设置为6.0左右,复性液的组成为25mmol/LTris-Cl、0.1 mmol/LNaCl、0.5mmol/LEDTA、4mol/L 尿 素(pH6.0)、0.1mmol/LGSSG、0.2mmol/LGSH,1%甘油。滴加复性后PDGF-BB的复性率在40%以上,复性后溶液高速离心,取上清进行SDS-PAGE分析,结果见图5。
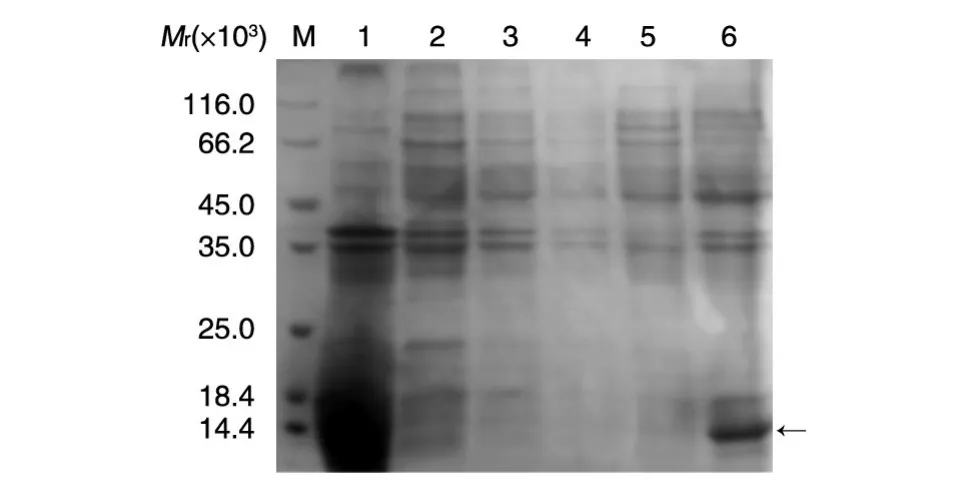
图2 PDGF-BB包涵体洗涤、尿素溶解的SDS-PAGE分析

图3 PDGF-BB包涵体溶液SephacrylS300层析液的UV检测

图4 PDGF-BB包涵体溶液SephacrylS300层析液的SDS-PAGE 1:上样前;M:蛋白marker;2:出峰前收集液;
参照PDGF-BB的理化特性,采用阳离子交换层析对复性后的溶液进行二次纯化,用0.2mol/LNaCl洗去杂蛋白,0.5mol/LNaCl、20mmol/L Tris-Cl(pH7.4)缓冲液洗脱目的蛋白峰,收集目的蛋白进行SDS-PAGE,分析纯化后重组PGDF-BB蛋白的纯度。结果如图6、7,经分子筛和离子交换层析后,重组蛋白的纯度可达95%以上。
2.4 重组PDGF-BB蛋白的Western印迹与活性测定结果
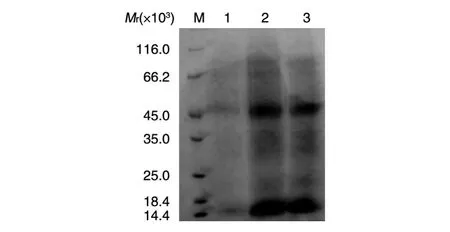
图5 PDGF-BB包涵体复性后的SDS-PAGE

图6 PDGF-BB包涵体复性液SPSepharoseFF层析UV检测
以PDGF-BB标准品为阳性对照、PBS为阴性对照,纯化的PDGF-BB蛋白分别与兔抗人PDGFBB一抗和羊抗兔IgG-HRP二抗进行孵育、洗涤和暗室曝光,Western印迹结果表明纯化的重组蛋白能与hPDGF-BB抗体结合,具有强的抗原性。
MTT方法验证重组蛋白的生物活性,以PDGF-BB标准品为阳性对照,制作D490nm值与PDGF-BB浓度曲线,发现获得的重组蛋白具有良好的生物活性,对NIH3T3细胞具有明显的促增殖作用,与标准品表现出一致性,两者在统计学分析上无差异。
3 讨论
PDGF-BB具有多种生物学功能,含0.01%重组人PDGF-BB的羧甲基纤维素钠胶(NaCMC)已在美国获准用于远端神经性糖尿病溃疡的治疗。在PDGF所有亚型中,PDGF-BB的功能如促进创伤愈合、骨组织修复和重建作用已得到肯定。目前利用原核系统生产重组人PDGF-BB蛋白受制于表达量低、复性困难而无法大规模生产。本研究参照生物软件分析,从生物信息学角度对其mRNA序列进行同义密码子置换,获得了PDGF-BB在原核系统内的高表达,明显优于优化前的水平。同时,对PDGF-BB包涵体洗涤、溶解与复性尝试了不同条件,大大提高了包涵体的复性效率可达40%。依据蛋白的理化特性,经过不同纯化方法的结合,最终获得具有良好生物活性和高纯度的重组蛋白。本实验建立了高表达、易纯化的工艺,为大规模制备原核重组人PDGF-BB蛋白奠定了基础。

图7 PDGF-BB复性液SPSepharoseFF纯化的SDS-PAGE M:蛋白marker;1:SP纯化后的PDGF-BB重组蛋白

图8 重组PGDF-BB的Western印迹
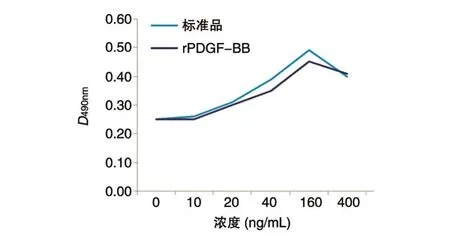
图9 重组PDGF-BB对NIH3T3细胞的促增殖作用
