TAT介导多肽药物过表达纯化和穿膜活性检测
2018-06-13王中山张梦张美娴陈淑漫朱焘方佳炜杨静戴毅
王中山,张梦,张美娴,陈淑漫,朱焘,方佳炜,杨静,戴毅
1.徐州医科大学 a.江苏省麻醉学重点实验室;b.麻醉学院;c.临床学院;江苏 徐州 221004;2.徐州市中心医院,东南大学附属医院 妇产科,江苏 徐州 221009
疼痛是一种复杂的主观感觉,包含疼痛感觉、疼痛情绪和认知功能障碍等,作为临床上最常见的疾病症状之一,疼痛严重影响患者的生活质量。为了缓解和治疗疼痛,研究人员对疼痛和镇痛的机制做了深入的探索。
实验室和临床脑成像研究证实,前扣带皮层是疼痛感觉和调制的关键脑区,是调控生理、病理疼痛状态的基础[1-2]。神经元兴奋性持续改变伴随可塑性改变是前扣带皮层参与调节慢性疼痛的主要机制[3-5],这种改变依赖于NMDA受体及其下游信号通路的调控[6]。很多证据显示NMDA受体2B亚基(NMDAreceptor2Bsubunit,NR2B)介导的前扣带皮层神经元可塑性在炎症相关或神经损伤相关持久痛中发挥重要作用[7-8],而前扣带皮层脑区NR2B参与慢性疼痛的机制研究显示微囊蛋白1(caveolin-1)可能参与这一过程。微囊蛋白1在大脑皮层[9]、海马[10]、下丘脑[11]等脑区神经元细胞中均有表达。微囊蛋白1存在于兴奋性突触中,在突触后密集区浓度较高,并参与调控Ⅰ类代谢型谷氨酸受体的转移和信号传导[12]。
本实验室研究发现,微囊蛋白1能够通过和NR2B之间的相互作用,介导后者的细胞膜表达水平,参与突触的形成和可塑性变化进而参与调节疼痛,而NR2B羧基端来源的多肽(NR2Pep)则能够阻断这种相互作用[13],起到很好的镇痛效果,为慢性神经病理性疼痛机制研究和临床治疗提供了重要参考。作为一种需要在细胞内发挥作用的多肽,其能否穿过血脑屏障和细胞膜进入细胞,是药物能否起作用的关键。为了帮助多肽等分子较大的药物穿过血脑屏障和细胞膜,在多肽分子上连接穿膜肽是较便捷和安全的方法。
TAT穿膜肽是人类免疫缺陷病毒1(HIV-1)来源的参与病毒复制的反式转录激活蛋白,可作为载体携带多肽或蛋白质片段[14-15],以非受体依赖的方式穿过细胞膜进入细胞。研究证实,TAT蛋白的穿膜特性主要由其中一段富含精氨酸的蛋白质转导结构域(YGRKKRRQRRR)介导。TAT短肽能够介导核酸、蛋白质、胶束、脂质体、纳米颗粒等多种物质进入细胞或活体组织,成为目前研究最热的药物跨膜转运载体之一。绿色荧光蛋白(GFP)是一种常用的融合蛋白质标签,因其在激发光下能够散发耀眼的绿色荧光,作为报告标签能够很好地定位和追踪目标蛋白质,被广泛应用于生命科学和医学研究中。
为了获得有活性的多肽药物,我们通过基因工程方法,采用pWaldoGFPe载体构建NR2Pep的大肠杆菌表达质粒[16],并在NR2Pep的氨基端插入TAT穿膜肽,羧基端连接GFP报告蛋白,同时为方便后续纯化,在TAT-NR2Pep和GFP之间插入TEV蛋白酶的酶切位点。GFP可为NR2Pep的表达纯化和功能研究提供便利,而TAT将赋予NR2Pep穿过血脑屏障和细胞膜的功能,有利于后期动物实验研究和临床应用。
我们优化了NR2Pep的原核表达条件和纯化方法,验证了TAT-NR2Pep-GFP穿过CHO和C2C12细胞膜的活性,为进一步阐明NR2Pep多肽参与镇痛的分子机制奠定了基础。
1 材料与方法
1.1 NR2Pep多肽表达载体的构建
通过引物重叠PCR方法克隆TAT-NR2Pep序列,上游引物为 5′-CCATCTCGAGATGTACGGTCG TAAAAAACGTCGTCAGCGTCGTCGTCGTCGCGAAT TTGATGAGATTG-3′,下 游 引 物 为 5′-CGTCGGAT CCCGGACGGCGACGATATGCCAGTTCAATCTCATC AAATTCGCGACG-3′,并于上下游引物两端分别插入XhoⅠ和BamHⅠ酶切位点。应用酶切连接法将PCR产物插入原核表达载体pWaldo-GFPe,得到重组质粒pWaldo-TAT-pep。重组子质粒经双酶切鉴定后,送金唯智公司测序。
1.2 NR2Pep多肽的诱导表达
接种重组子于200mLLB培养基中,37℃过夜培养,转种50mL培养物至1LLB培养基中,37℃培养至D600nm为 0.5~0.6,加入终浓度为 0.1 mmo/L的IPTG,22℃继续诱导培养20h,6000r/min离心15min收集细胞,用于后续蛋白纯化。
1.3 NR2Pep多肽的纯化
将细胞悬浮于80mL裂解缓冲液[20mmol/LTris-HCl(pH8),300mmol/LNaCl]中,加入 50 μg/mL溶菌酶、200UDnaseⅠ和1mmol/L苯甲基磺酰氟(PMSF),采用励途(上海)细胞破碎仪800MPa破碎细胞一次,4℃、8000r/min离心30 min去除细胞碎片,取上清液自然流过镍柱,用100mL缓冲液[20mmol/LTris-HCl(pH8),300 mmol/LNaCl,10%甘油和30mmol/L咪唑]冲洗柱子,用高浓度咪唑[20mmol/LTris-HCl(pH7.5),300mmol/LNaCl,10%甘油和300mmol/L咪唑]洗脱目标蛋白质,收集蛋白质样品,过分子筛柱子[缓冲液含 20mmol/LTris-HCl(pH7.5),300 mmol/LNaCl,10%甘油],收集有吸收峰的蛋白质样品,SDS-PAGE检测样品的纯度。
1.4 荧光显微镜观察NR2Pep进入细胞的能力
CHO和C2C12细胞分别用含10%和20%胎牛血清的F12K和DMEM高糖培养基在37oC、5%CO2细胞培养箱内培养。用倒置显微镜观察细胞贴壁情况,细胞贴壁达80%~90%时加入纯化的TAT-NR2Pep-GFP蛋白1mmol/L,并于细胞培养箱中继续培养孵育6h,利用融合蛋白中的GFP,通过荧光显微镜观察TAT-NR2Pep-GFP能否穿过细胞膜进入细胞。
1.5 Western印迹检测
采用Western印迹确认NR2Pep的表达。纯化后的蛋白经SDS-PAGE后,通过半干转/湿转的方法转移到PVDF膜上,以含5%脱脂奶粉的PBS室温封闭2h,加入6×His一抗室温孵育1h,PBST洗膜3次,加入二抗室温孵育1h,PBST再次洗膜后加入发光液,X线胶片曝光、显影、定影,图像扫描后,条带用ImageJ软件进行分析。
1.6 TEV蛋白酶酶切获得TAT-NR2Pep多肽
确认TAT-NR2Pep蛋白表达后,须将融合蛋白质的GFP去除。于2mg蛋白样品中加入3 mg/mL的TEV(烟草花叶病毒)蛋白酶约200μL,4℃冷室中旋转酶切过夜;酶切后的蛋白质样品再次通过镍柱去除没有酶切完全的蛋白和带有8×His标签的GFP组分,获得高纯度的TAT-NR2Pep多肽;收集通过Ni柱的蛋白质样品,用浓缩管(截留相对分子质量1000)浓缩至1mg/mL左右(采用Nanodrop2000检测蛋白质浓度)。
2 结果
2.1 TAT-NR2Pep基因的克隆
PCR克隆得到TAT-NR2Pep基因,通过酶切连接的方法将TAT-NR2Pep片段插入大肠杆菌表达载体pWaldo-GFPe,得到重组质粒pWaldo-TAT-pep,限制性内切酶XhoⅠ和BamHⅠ双酶切验证表明基因片段大小符合预期(图1),随后送金唯智公司测序,TAT-NR2Pep序列正确,长78 bp,编码26个氨基酸残基构成的蛋白(相对分子质量 3600),和 GFP(相对分子质量 26000)、TEV酶切位点融合后其相对分子质量约为30600。
2.2 TAT-NR2Pep的诱导表达
诱导表达使用LB培养基,为了给蛋白质更多的时间折叠以获得正确的构象,研究采用降低诱导剂IPTG浓度与表达温度的方法,以更温和的表达条件获得较高表达量的活性蛋白质。18℃和22℃恒定温度下IPTG浓度0.1~1.0mmo/L变化对蛋白表达量没有明显影响(图2D、E),0.1mmo/L IPTG条件下温度升高(30℃)会降低荧光蛋白的含量(图2E)。优化后的表达条件为:终浓度0.1 mmo/L的IPTG,22℃诱导培养20h(4L培养基约收集细胞18g)(图2A),经SDS-PAGE分析和Ingel检测,发现重组蛋白表达量较高,且绿色荧光明显(图2),证实构建的重组子和表达条件可用于后续蛋白纯化。
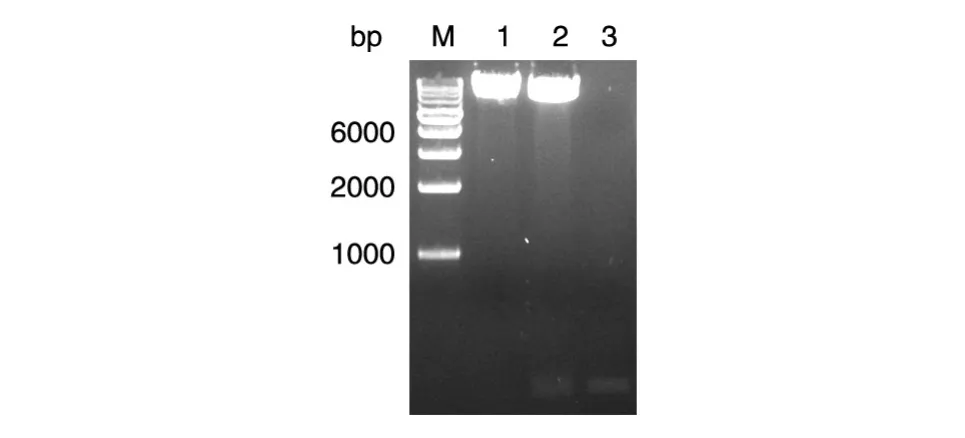
图1 TAT-NR2Pep穿膜肽过表达质粒的双酶切验证
2.3 TAT-NR2Pep的纯化
将细胞悬浮于裂解液中,经细胞破碎仪破碎,4℃、8000r/min离心30min后,绿色荧光蛋白位于上清液中,绿色明显(图2B)。将上清液中的蛋白质经镍柱亲和纯化后上分子筛柱子,柱子中可见明显绿色组分(图2C)。绿色荧光蛋白的存在可以帮助随时定位目标蛋白。
2.4 荧光显微镜观察TAT-NR2Pep的穿膜活性
细胞培养基中加入1mmol/L纯化的TATNR2Pep并孵育6h,通过荧光显微镜能够观察到细胞内存在大量绿色荧光,说明TAT-NR2Pep能够穿过细胞膜进入细胞(图3)。
2.5 Western印迹检测TAT-NR2Pep的表达
纯化得到的TAT-NR2Pep样品经SDS-PAGE分离,转膜,加入6×His特异性抗体检测目标蛋白的表达情况,经X线胶片曝光、显影、定影,扫描得到图4,发现6×His抗体特异性较高,在相应位置有清晰的蛋白条带,无明显的杂带。图4结果一方面证实所构建载体和优化方法能够表达和纯化得到TAT-NR2Pep,另一方面表明TATNR2Pep能够被TEV蛋白酶切割,最终获得高质量的TAT-NR2Pep多肽。
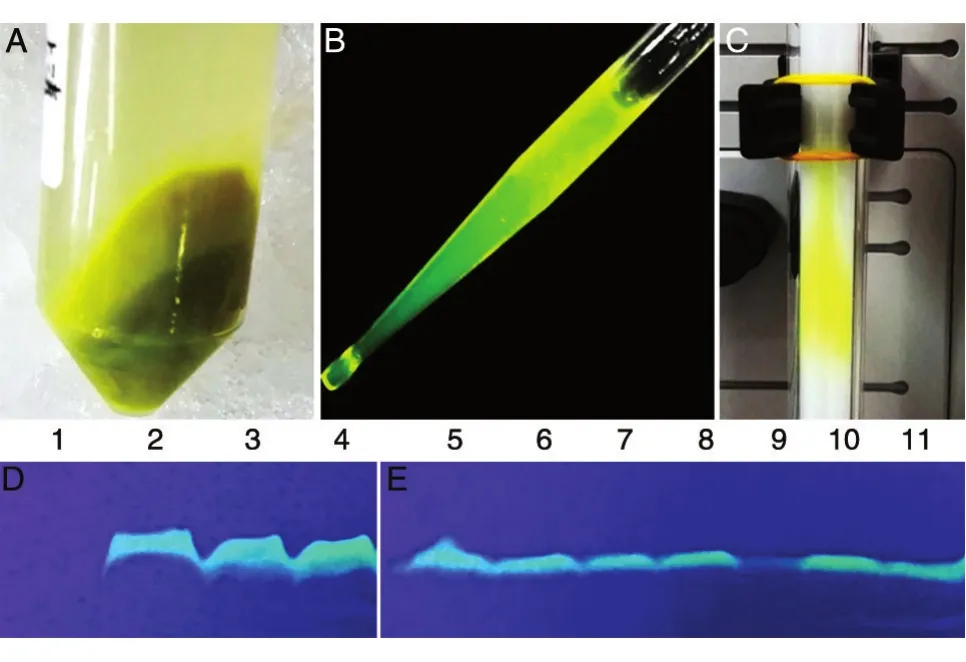
图2 TAT-NR2Pep的表达纯化与In-gel检测
2.6 TEV蛋白酶酶切获得TAT-NR2Pep多肽
纯化得到的TAT-NR2Pep样品带有GFP标签,可用TEV蛋白酶酶切,将多肽和GFP组分分开(图5A)。随后经镍柱二次纯化,得到较纯(>80%)的目标多肽(图5B)。
3 讨论
疼痛是一种复杂的与组织损伤或潜在损伤相关的不愉悦的主观感觉和情感体验,是多种疾病的共同特征,其发生机制和镇痛治疗一直是研究的热点。随着对疼痛发生机制和药物镇痛机制研究的深入,发现多种受体和离子通道与疼痛有关,其中包含电胝依赖性钠离子通道和钙离子通道、Ach能受体和阿片肽受体等。作用于这些离子通道和受体的药物在临床已得到广泛应用。
临床镇痛药物多为阿片类和非甾体类,这些药物对慢性神经源性等疼痛症状疗效不理想,而且阿片类镇痛药往往伴随成瘾性、依赖性等毒副作用。所以,近年来筛选特异性高、安全、副作用小的天然镇痛药物成为新药研究热点,而多肽类药物因其自身优势,成为药物研发的重要方向。
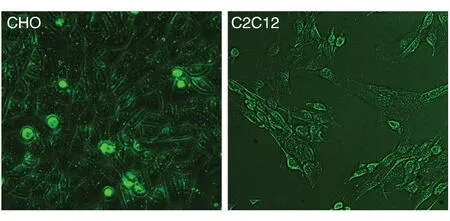
图3 荧光显微镜下观察TAT-NR2Pep的穿膜活性(10×)
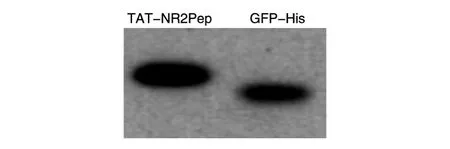
图4 Western印迹确认TAT-NR2Pep的表达
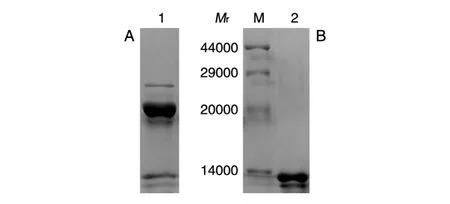
图5 TAT-NR2Pep的TEV酶切与纯化
本实验室研究疼痛机制时发现前扣带皮层中微囊蛋白1可直接和NR2B结合,从而提高NR2B在细胞膜表面的表达水平,进而参与慢性神经病理性疼痛的调节,而NR2Pep小肽则能够通过阻断这种相互作用而起到良好的镇痛效果。为了大量生产这种多肽药物,本研究构建了小肽的细菌表达和纯化系统,通过生物发酵的方法进行了大量表达。并且为了方便获得的多肽能够作为药物使用,我们在其N端加入了穿膜肽TAT,帮助多肽获得穿过细胞膜的特性。
当然,目前多肽药物的纯度仍不够高,我们后期将进一步增加纯化步骤,争取将多肽纯度提高到98%以上,并作为药物在小鼠体内检测其活性,确认NR2Pep能否通过血脑屏障,是否能够和合成肽一样具有镇痛效果,作为镇痛药物是否有耐药性等。并对NR2Pep做进一步的改造或修饰,以提高其镇痛活性或延长其在体内的半衰期,同时将探讨NR2Pep在脑中的代谢,为NR2Pep的临床应用奠定基础。
总之,我们构建了NR2Pep的原核表达系统,纯化得到较高纯度的NR2Pep,体外证实NR2Pep具有穿过不同细胞的细胞膜的活性,为下一步阐明NR2Pep参与镇痛的机制奠定了基础,同时也为其他多肽药物的生物发酵研究提供了参考。
