新型肝脏肿瘤介入治疗后复发与转移预测方法的建立
2018-06-13孙慧伟谢辉李瑞生李晓娟柴燕涛姜棋予王志杰杨锐创冯帆侯俊
孙慧伟,谢辉,李瑞生,李晓娟,柴燕涛,姜棋予,王志杰,杨锐创,冯帆,侯俊
解放军第三〇二医院 a.临床研究管理中心;b.介入科;北京 100039
原发性肝脏肿瘤主要包括肝细胞癌(hepato⁃cellularcar cinoma,HCC)和肝内胆管细胞癌(intra⁃hepatic cholangiocarcinoma,IHC)2个病理分型[1-2],其中HCC是主要的病理类型。绝大多数HCC患者初诊即为进展期(advancedHCC),失去外科手术等根治性治疗机会[3-4]。HCC细胞对放射治疗不敏感[5],同时具有对各种细胞毒性化疗药物的多药耐受(multi-drug resistance,MDR)特性[6],而惟一的肝细胞癌一线治疗药物——口服多靶标蛋白激酶抑制剂索拉菲尼(sorafenib)的临床获益个体差异极大,只有25%~40%的HCC患者对其有应答,随着治疗的进展,大多数对索拉非尼初始敏感的患者也会出现耐药[7]。目前,以经导管动脉化学栓塞TACE(transcatheter arterial chemoem⁃bolization,TACE)为代表的介入治疗策略在肝脏肿瘤诊疗中具有重要意义,能够起到延缓疾病进展,降低患者肿瘤负荷,提高生存质量的作用[8-10]。但另一方面,介入治疗也有可能作为强有力的杀伤因素,破坏肿瘤组织的构架或微环境,造成肿瘤细胞逃逸或散逸[11];或作为胁迫因素,诱导和活化肝脏肿瘤细胞中各种胁迫应答机制,发挥对治疗的耐受或最终导致复发[11]。
我们在临床诊疗中已观察到,相当比例的肝脏肿瘤患者经介入治疗后,无论是否接受手术切除,都会出现多发性甚至弥散性复发或转移[12]。这一现象严重危害患者健康,影响临床诊疗效果,但相关机制尚不清楚,也没有对接受物理性局部治疗的肝脏肿瘤患者复发、转移与侵袭等预后进行检测、判别或预测的方法。为解决这一问题,我们采用经TACE治疗的肝脏肿瘤患者手术切除或内窥镜引导下的手术切除标本,建立免疫缺陷动物(SICD小鼠)的肝脏原位肿瘤模型,通过B超探测和H&E、Masson染色等病理学分析方法对原位HCC病灶进行肿瘤的侵润性生长,肿瘤侵袭与肿瘤血道转移分析,最终判别和预测HCC的预后风险。
1 材料与方法
1.1 材料
对肝脏肿瘤患者进行行为评分,选取接受物理性局部策略进行降阶梯治疗的患者,若治疗后其行为评分好转,则接受开腹手术切除或腹腔内窥镜引导的肝脏肿瘤切除手术,使用含20%胎牛血清的DMEM培养基保存标本外层性状较好的部分。
SCID小鼠(C.B-17/lcr)由北京市斯贝福生物科技有限公司提供;吸入麻醉剂异氟烷为深圳沃瑞德公司产品;小动物实验相关全套设备与手术器械由本实验室保存;病理实验H&E染色试剂盒与Masson染色试剂盒购自北京中杉金桥公司。
1.2 免疫缺陷小鼠肝脏原位模型的建立[13]
免疫缺陷(T、B细胞双重缺失)雌性5~6周龄C.B-17/lcr品系SCID小鼠,在洁净空间(SPE饲养条件)用60Co-γ照射除菌的垫料和饲料饲养。以异氟烷为麻醉剂,用麻醉机持续麻醉(首次麻醉时异氟烷浓度为3.5%,持续麻醉时异氟烷浓度为1.5%~2.0%)。将小鼠固定于粘鼠板上,在其腹部剑突下方剪开一个约1cm的开口,轻轻挤出肝右叶,用眼科镊在肝叶表面制造孔洞后用灭菌棉签按压止血。剥取肿瘤标本外层生发层活性较好的组织,切成小块(直径1~1.5mm)后将肿瘤组织接种进肝叶的孔洞内,确定借种成功后按压止血。将肝叶推回腹腔内,缝合创口,注意缝合的层次,缝合3~4针即可。如有少量出血则进行按压止血。
1.3 原位肿瘤的B超探查[13]
前述免疫缺陷动物经过4周左右生长后,用深圳开立生物医疗有限责任公司的S40型B超设备,使用配套的L742型小器官超声探头进行常规B超探查,在右肝叶探查得到1~1.5mm的低回声病灶时即可进行病理检测。
1.4 H&E染色检测
染液配制:①伊红酒精溶液(1%):称取伊红Y染料1g,加入少量蒸馏水溶解后,逐滴加入冰醋酸直至染料为糊状,用滤纸过滤,将滤渣在烘箱中烤干后,用100mL95%酒精溶解;②苏木素染液:称取苏木精6g,溶于100mL无水乙醇,再将150g硫酸铝钾溶于蒸馏水,溶液再与900mL甘油混合,最后加入120mL冰醋酸和1.2g碘酸钠3即可;③分化液:将1mL浓盐酸加入99mL 70%酒精中即可。
剥离前述免疫缺陷小鼠的肝右叶,用4%多聚甲醛固定24h后进行包埋、切片等常规操作。获得的石蜡切片分别用二甲苯Ⅰ(15min)、二甲苯Ⅱ(15min)、1∶1二甲苯/无水乙醇(2min)、无水乙醇Ⅰ(5min)、无水乙醇Ⅱ(5min)、80%乙醇(5min)及蒸馏水(5min)依次处理脱蜡复水后,用苏木精液染色(5min),水洗10min或流水冲洗5min,再用1%盐酸乙醇分化30s后水洗30s、蒸馏水过洗5s,用伊红液染色 1~3min,再分别用蒸馏水(30s)、80%乙醇(30s)、95%乙醇(1min)、95%乙醇(1min)、无水乙醇Ⅰ(3 min)、无水乙醇Ⅱ(3min)、二甲苯Ⅰ(3min)、二甲苯Ⅱ(3min)脱水后,用中性树胶封片。将经H&E染色的病理切片在显微镜下检测并拍照,识别肿瘤组织的特性。
1.5 Masson染色检测
染液配制:①苏木素染液:称取苏木精6g,溶于100mL无水乙醇,再将150g硫酸铝钾溶于蒸馏水,溶液再与900mL甘油混合,最后加入120mL冰醋酸和1.2g碘酸钠3即可;②Masson立春红酸性复红液:称取丽春红0.7g、酸性复红0.3g,量取冰醋酸1mL、蒸馏水99mL,充分混合后过滤即可;③0.2%冰醋酸水溶液:量取冰醋酸0.2mL溶于100mL蒸馏水;④1%磷钼酸水溶液:称取磷钼酸1g溶于100mL蒸馏水;⑤苯胺蓝水溶液:称取苯胺蓝2g、量取冰醋酸2mL,溶于98mL蒸馏水。
剥离前述免疫缺陷小鼠的肝右叶,用4%多聚甲醛固定24h后进行包埋、切片等常规操作。获得的石蜡切片分别用二甲苯Ⅰ(15min)、二甲苯Ⅱ(15min)、1∶1二甲苯/无水乙醇(2min)、无水乙醇Ⅰ(5min)、无水乙醇Ⅱ(5min)、80%乙醇(5min)及蒸馏水(5min)依次处理脱蜡复水后,用苏木精液染色(5~10min),充分水洗(10min以上)或流水冲洗5min以上,用Masson立春红酸性复红液染色5~10min,再以2%冰醋酸水溶液洗片刻,1%磷钼酸水溶液分化3~5 min,不经水洗,直接用苯胺蓝水溶液染5min后以2%冰醋酸水溶液洗片刻,最后分别用蒸馏水(30s)、80%乙醇(30s)、95%乙醇(1min)、95%乙醇(1min)、无水乙醇Ⅰ(3min)、无水乙醇Ⅱ(3min)、二甲苯Ⅰ(3min)、二甲苯Ⅱ(3min)等脱水后,以中性树胶封片。将经Masson染色的病理切片在显微镜下检测并拍照,识别肿瘤组织的特性。
2 结果
2.1 H&E染色的病理学分析
我们对不同标本在SCID小鼠肝脏形成的肿瘤组织进行了H&E染色。由图1可以看出,患者HCC手术切除标本接种于免疫缺陷小鼠肝脏,经过4周生长后形成的病灶(癌巢,nodules)能够为H&E染色所确认,可清晰地看到病灶和周围正常组织。在此基础上对其性状进行区分:图1A为复发风险小、预后程度好的患者,其手术切除标本所形成的原位肿瘤界限清晰,癌巢(病灶)与其周围组织有完整而清楚的界限或包膜;图1B为复发风险大、预后程度差的患者,其手术切除标本所形成的原位肿瘤界限模糊,与周围组织没有清楚或明显的界限。
2.2 Masson染色的病理学分析
我们用Masson染色对复发风险大、预后程度差的患者临床标本在动物肝脏中形成的原位肿瘤进行了检测,结果如图2,Masson染色能够清晰直观地显示肿瘤的弥散性侵袭、迁移或侵润性生长,对肿瘤组织的恶变程度进行区分。图2A示肿瘤呈侵润性生长,可清晰辨识侵袭的肿瘤细胞,此时肿瘤组织恶变程度较轻;在此基础上,用Masson染色能够观察到明显的肿瘤细胞对正常组织构架或微环境的破坏,诱导相应组织重构后产生并形成的肿瘤血管,肿瘤血管的管腔较大,且血管壁缺乏纤维甚至是正常上皮细胞(图2B),侵袭和侵润性生长的肿瘤细胞诱导和参与形成内皮不完整、纤维不发达的肿瘤血管,进一步提示和反映了肿瘤的恶性程度;最后,部分标本的Masson染色能够观察到明显的血道转移现象(图2C),肝脏主要血管的管腔较大,纤维丰富,且具备完整的管壁结构,肿瘤细胞通过主要血管的转移显示了其恶性强的转移、侵袭能力。可以看出,肝脏的血管内有经由血管侵袭与侵润性生长的肿瘤细胞,进一步反映出患者很高的复发风险和较差的预后。
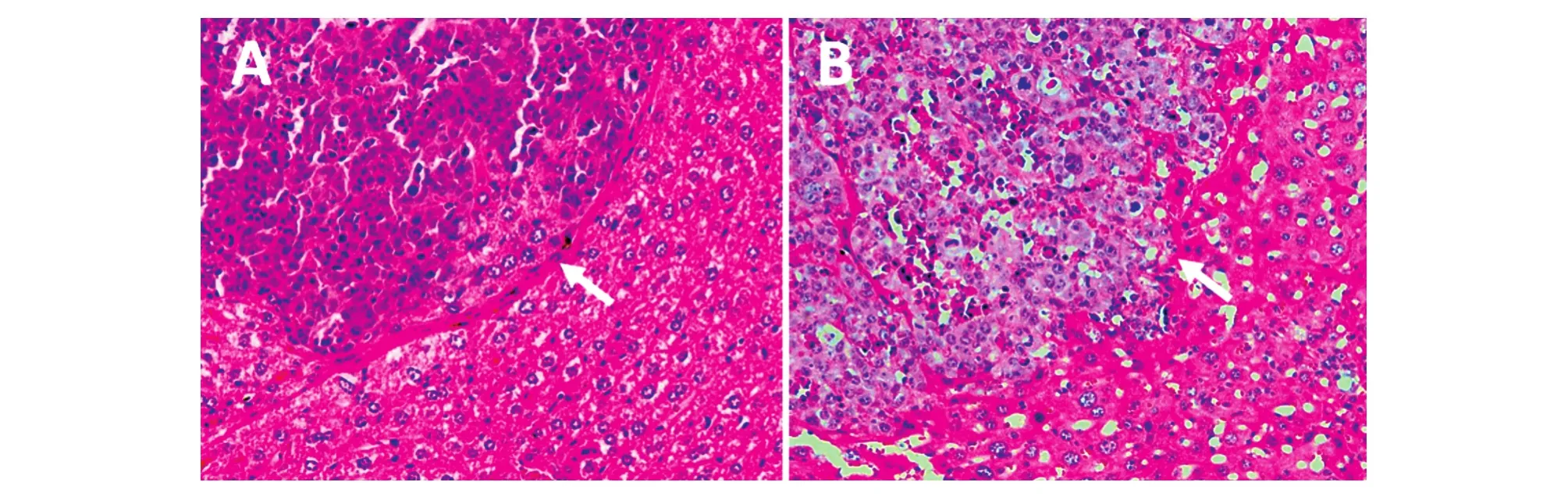
图1 肿瘤组织标本在SCID小鼠肝脏形成病灶的H&E病理学检测
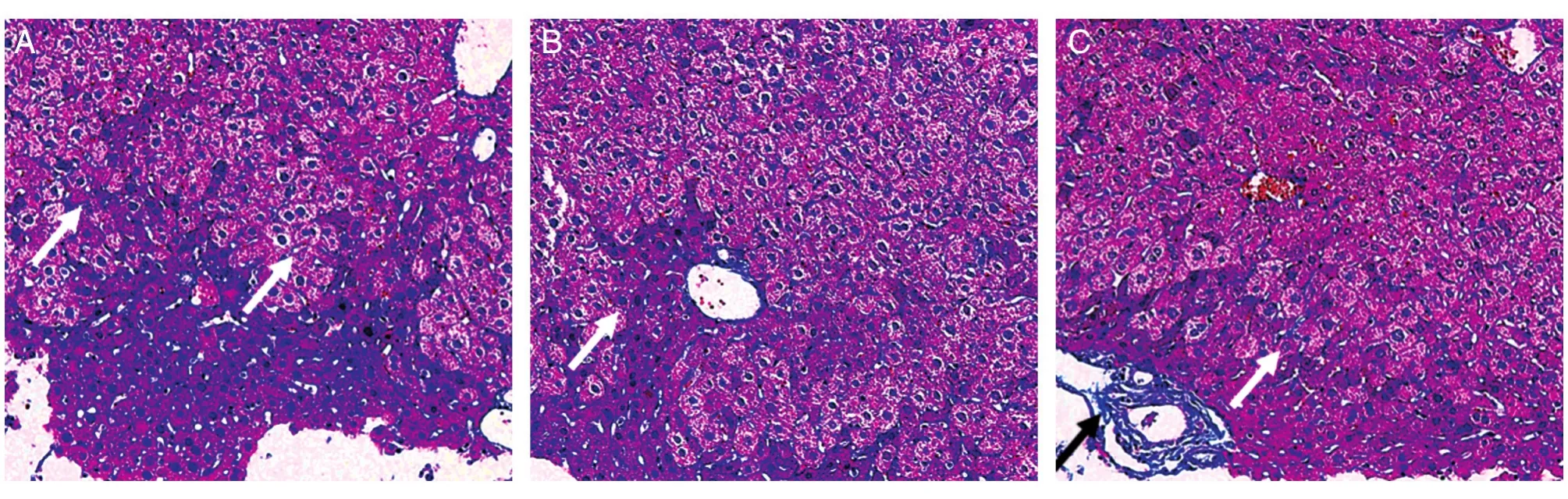
图2 肿瘤组织标本在SCID小鼠肝脏形成病灶的Masson病理学检测
3 讨论
以TACE为代表的各种介入治疗已成为进展期肝细胞癌诊疗的重要选择,不仅能够实现对肿瘤细胞的直接杀伤、缩小肿瘤,还可作为“降阶梯”治疗策略,减低患者肿瘤负荷并提高患者行为评分后进行手术切除或接受肝脏移植[11]。随着TACE等的广泛应用,其治疗后的严重复发或转移报道日益增多。最近的报道显示,以HCC为代表的人类恶性肿瘤细胞一般通过3种机制逃逸抗肿瘤治疗进而复发或转移:①TACE等抗肿瘤治疗策略能够作为胁迫因素诱导Survivin、cIAP1、cIAP2及BCL-2等抗凋亡、促存活蛋白表达,以此增加HCC细胞的抗性,促进HCC细胞存活或治疗耐受[14];②如未能完全杀灭病变部位的全部HCC细胞,则有可能诱导残存肿瘤细胞的上皮/间质转化作用(epithelial-mesenchymaltransition,EMT),HCC细胞从偏向上皮特性转向间质特性,在这一过程(EMT)中其抗性和侵袭性显著上调[14-15];③实体肿瘤具有异质性,TACE等抗肿瘤治疗也有可能通过发挥克隆选择的作用,促使病灶中相对静止和极具抗性的一群细胞(即肿瘤干细胞相对富集,最终引起肿瘤的复发或转移[11]。这提示我们,检测TACE治疗后肿瘤组织生物学行为、性状的变化具有重要意义,有可能作为预测TACE治疗后复发与转移的有效策略。
本研究选取SCID小鼠(C.B-17/lcr)品系进行实验。作为近年得到广泛应用的新型肿瘤动物模型,SCID小鼠的T细胞与B细胞均缺失,比裸鼠(T细胞缺失)具有更大的优势。TACE治疗后的手术切除标本或肝脏穿刺标本,受手术或穿刺周期影响,HCC细胞的活性可能偏弱,SCID小鼠的应用极大地改善了这一限制。
在研究中,H&E、Masson染色的观测指标明晰,图像直观且方法新颖。选取手术切除标本外层性状较好的部分接种免疫缺陷小鼠肝脏,B超探测原位癌巢直径达到1~1.5mm时可进行病理检测。首先用H&E染色对肿瘤的性状进行初步判断,再利用Masson染色进行深入分析,检测血管和纤维等结构,依据病理分析结果对预后风险等进行分级:①H&E染色结果显示肿瘤界限清晰且包膜完整的记为Ⅰ级,患者复发风险小;②H&E染色结果显示肿瘤界限不清晰无完整包膜的,Masson染色复检显示有肿瘤细胞侵润或侵袭性生长的记为Ⅱ级,患者有复发风险,应定期进行影像学检查和接受随访;③H&E染色结果显示肿瘤界限不清晰无完整包膜的,Masson染色复检显示有肿瘤细胞侵润、侵袭性生长与肿瘤血管生成的记为Ⅲ级,患者有较高复发风险,应考虑辅助化疗后定期影像学检查和接受随访;④H&E染色结果显示肿瘤界限不清晰无完整包膜的,Mas⁃son染色复检显示有肿瘤细胞侵润、侵袭性生长与肿瘤血道转移情况的记为Ⅳ级,患者的复发风险极高,应考虑辅助化疗后密切关注、定期影像学检查和接受随访。
除TACE外,射频消融(radiofrequencyablation,RFA)也是重要的介入治疗策略,能够较有选择性地消融与杀伤肿瘤组织而非周围组织[16]。RFA不仅有助于保护肝组织与正常肝脏功能,尤其适用于伴随严重肝硬化的HCC患者[16]。与TACE治疗类似,RFA治疗也存在术后复发与转移的问题[17-18]。本研究建立的方法,不仅有助于对TACE治疗后患者HCC复发风险进行预测研究,也可用于RFA治疗后患者HCC复发风险预测研究。
