东坡肘子挥发性成分萃取方法的选择及优化
2018-06-13刘阳吴华昌邓静易宇文乔明锋彭毅秦
刘阳,吴华昌,邓静,易宇文,乔明锋,彭毅秦
(1.四川旅游学院 食品学院,成都 610100;2.四川旅游学院 烹饪科学 四川省高等学校重点实验室,成都 610100)
东坡肘子是传统的经典川菜代表之一,其以其色、香、味、形俱全著名于国内外,且富含大量胶原蛋白,是保持皮肤丰满润泽、强体增肥的食疗佳品,有人称其为“美容食品”,外宾赞颂它可列入世界名菜[1]。
东坡肘子的风味物质是由很多复杂混合物交织在一起形成的,其主要是由东坡肘子加工过程中添加的食盐、糖类、老抽等调味品以及肉中的风味前体物质,包括瘦肉组织和脂肪组织之间的脂肪酸、氨基酸和硫胺素的热分解以及糖类和氨基酸之间的美拉德反应产生的风味物质决定的[2,3]。随着科研工作者对肉制品不断深入研究,已发现肉制品的风味物质涵盖了大多数的有机化合物,包括碳烃化合物、醇、醛、酯、酮、羧酸、醚、呋喃、吡啶、吡咯、噻唑、噻吩以及其他的含硫含氮化合物。其中最重要的呈香物质是呋喃、噻唑、吡嗪、吡咯、吡喃酮等含氮、氧、硫的杂环化合物以及含有羧基的挥发性物质[4-8]。东坡肘子作为传统川菜,其以猪肘为原料,采用特殊的烹饪工艺会形成非常丰富的风味成分。一般来说,这些风味物质的形成途径有脂质的热降解[9]、氨基酸和多肽的热降解[10]、硫胺素的热降解[11]、糖类与氨基酸之间的美拉德反应等[12,13]。食品的挥发性化合物决定了食品的香气特征并对其特征风味有着巨大的贡献,在食品消费时,香气通常影响消费者对食物的评价。如何快速、准确地萃取出食品中的挥发性风味成分,是食品香气进一步研究的重点。
顶空固相微萃取法是在固相萃取的基础上发展起来的新型萃取分离技术,该技术与其他萃取方式相比,具有不使用溶剂、操作简单、检测快速等优点,可以更好地分析食品中的挥发性成分。顶空固相微萃取受萃取头类型、萃取时间、萃取温度、样品质量浓度、顶空体积、搅拌、pH值等因素的影响。本实验主要采用正交设计法对顶空固相微萃取的诸多影响因素,如萃取头、萃取时间、萃取温度等进行优化,为东坡肘子挥发性成分的快速检测及进一步分析研究提供一定的技术保证。
1 材料与方法
1.1 实验材料
东坡肘子:四川王家渡食品有限公司。
1.2 主要仪器
手动SPME进样器,50/30 μm DVB/CAR/PDMS,65 μm PDMS/DVB,75 μm CAR/PDMS,100 μm PDMS萃取头,Agilent 7890A气相色谱-质谱联用仪 美国安捷伦公司;SHP0201147047电子天平 奥豪斯仪器有限公司。
1.3 实验方法
1.3.1 GC-MS检测条件
色谱条件:毛细管色谱柱Agilent HP-INNOWax(60 m×250 μm,0.25 μm);手动无分流进样,进样口温度230 ℃;程序升温:初始温度45 ℃,保留3 min,以10 ℃/min升至200 ℃,保留5 min;检测器温度230 ℃;载气He,流速1 mL/min。
质谱条件:EI电离源,电子能量70 eV,扫描范围10~550 u,离子源温度230 ℃,接口温度230 ℃。
1.3.2 东坡肘子样品处理方式的选择
将东坡肘子切碎至1 cm3大小,称取2.5 g加入到15 mL样品瓶中,同时量取2.5 mL东坡肘子的汤汁于样品瓶中,密封备用。
将东坡肘子切碎至1 cm3大小,称取5 g加入到15 mL样品瓶中,密封备用。
将东坡肘子切碎至1 cm3大小,称取2.5 g加入到15 mL样品瓶中,同时量取2.5 g 20%氯化钠溶液,密封备用。
称取5 g东坡肘子汤汁,加入到15 mL样品瓶中,密封备用。
将准备好的样品瓶放入75 ℃水浴加热,然后将SPME萃取头插入样品瓶中,在一定条件下进行萃取,然后在气相色谱进样口250 ℃解吸2 min,采用GC-MS分析挥发性风味成分。
1.3.3 顶空固相微萃取单因素条件优化
1.3.3.1 萃取头的选择
取2.5 g处理好的东坡肘子、2.5 g汤汁加入至15 mL样品瓶中。采用4种不同涂层厚度的萃取头50/30 μm DVB/CAR/PDMS,65 μm PDMS/DVB,75 μm CAR/PDMS和100 μm PDMS,在60 ℃水浴中平衡5 min后保温萃取45 min,萃取结束后将萃取头移入GC-MS进样口解吸5 min。
1.3.3.2 萃取温度的选择
控制其他条件不变,分别在40,50,60,70,80 ℃的条件下,用75 μm CAR/PDMS萃取头萃取45 min。
1.3.3.3 萃取时间的选择
控制其他条件不变,用75 μm CAR/PDMS萃取头在60 ℃下分别萃取30,40,50,60,70 min。
1.3.4 正交试验设计
正交设计是利用正交表来安排与分析多因素试验的一种设计方法,其选择全部试验水平组合中部分具有代表性的水平组合进行试验,通过分析这部分试验结果数据从而解析全部试验组合的整体情况,然后找出最佳试验组合。根据单因素试验结果及国内外文献得到影响东坡肘子挥发性化合物萃取效率的主要因素为萃取头涂层厚度(A)、萃取时间(B)、萃取温度(C)。各因素选择3个水平分别为:A1(50),A2(65),A3(75);B1(45),B2(60),B3(75);C1(55),C2(65),C3(75)。本次正交试验设计根据萃取物种类和色谱总峰面积的变化考察东坡肘子挥发性化合物的萃取效率。
1.3.5 验证试验
以正交试验得到的最优条件作为萃取条件重复试验。
1.3.6 数据分析方法
试验数据处理由GC-MS数据分析软件系统完成,未知化合物经计算机检索同时与NIST、RTLPEST 2个谱库相匹配,仅当匹配度大于800(最大值为1000)的鉴定结果才予以报道。采用峰面积归一化法定量计算出各挥发性成分在东坡肘子中的相对含量[14]。
利用Origin 8.5进行单因素试验数据的作图分析;IBM SPSS Statistics 19.0用于正交试验设计与数据分析。
2 结果与分析
2.1 东坡肘子样品处理方式的选择
本试验采用4种不同取样方式对东坡肘子挥发性成分进行萃取分析比较,选取最佳取样方式。4种取样方式萃取得东坡肘子挥发性成分的GC-MS总离子流色谱图,见图1~图4。萃取的挥发性物质成分见表1。
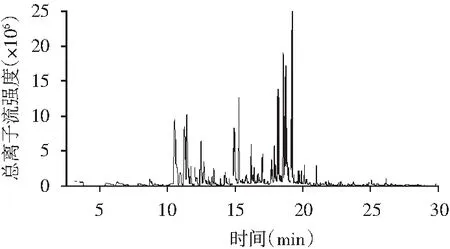
图1 2.5 g汁、肉萃取的总离子流色谱图Fig.1 The total ion current chromatogram of 2.5 g juice and 2.5 g meat
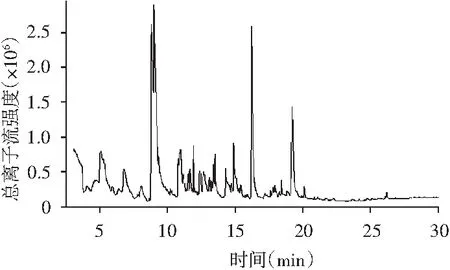
图2 5 g肉萃取的总离子流色谱图Fig.2 The total ion current chromatogram of 5 g meat

图3 2.5 g肉和氯化钠溶液萃取的总离子流色谱图Fig.3 The chromatogram of 2.5 g meat and sodium chloride solution

图4 5 g肘子汤汁萃取的总离子流色谱图Fig.4 The total ion current chromatogram of 5 g juice

序号种类保留时间(min)匹配项名称中文名称相对百分含量(%)12341酯类5.421Ethyl Acetate乙酸乙酯0.278.39-1.00212.849Butanoicacid,3-methyl-,1-ethenyl-1,5-dimethyl-4-hexenyl ester3-甲基-丁酸-1-乙基-1,5-二甲基-4-己烯酯0.27---316.3451,5-Dimethyl-1-vinyl-4-hexenylbutyrate丁酸-1-乙烯基-1,5-二甲基-4-己烯基酯---0.67417.603Butyrolactone gamma-丁内酯-0.15--518.7842,6-Octadien-1-ol, 3,7-dimethyl-, acetate, (E)-乙酸香叶酯4.42--3.226醇类6.239Ethyl alcohol乙醇0.470.59-0.28711.8991-Pentanol1-戊醇-1.973.02-812.9882-Heptanol2-庚醇0.30---913.5111-Hexanol正己醇-1.905.49-1014.8621-Octen-3-nol1-辛烯-3-醇-2.433.43-1114.9651-Heptanol庚醇--0.84-1215.4041-Hexanol, 2-ethyl-2-乙基己醇-0.70--1316.1461,6-Octadien-3-ol, 3,7-dimethyl-芳樟醇1.20-0.081.471417.1144-methyl-1-(1-methylethyl)-4-萜烯醇0.22--0.221517.6062-Cyclohexen-1-ol2-环己烯-1-醇0.69---1618.352Isoborneol异龙脑0.44--0.331719.8552,6-Octadien-1-ol, 3,7-dimethyl-香叶醇0.60--0.731820.965Phenylethyl Alcohol苯乙醇0.87--0.881922.6121,6,10-Dodecatrien-3-ol,3,7,11-trimethyl-橙花叔醇0.10--0.1320烃类6.398Cyclooctene环辛烯-0.87--217.727α-Pineneα-蒎烯0.62--1.30228.025Toluene甲苯-1.69--238.661Camphene莰烯0.660--0.252410.204p-Xylene对二甲苯-0.50--2510.9074-Carene4-蒈烯1.519--1.272610.479.beta.-Myrcene月桂烯9.92--9.812711.215D-Limonene右旋萜二烯5.90--5.402811.359Bicyclo[3.1.0]hex-2-ene,4-methyl-1-(1-methylethyl)-崖柏烯---6.692911.3973-methylene-6-(1-methylethyl)-Cyclohexene3-亚甲基-6-(1-甲基乙基)环己烯6.57---3011.9841,3,6-Octatriene, 3,7-dimethyl-罗勒烯1.71--1.253112.393Benzene, 1-methyl-2-(1-methylethyl)-邻异丙基甲苯-1.552.232.083212.426Benzene, 1-methyl-4-(1-methylethyl)-4-异丙基甲苯2.89---3313.096Benzene, butyl-丁苯0.18--0.153414.2442,4,6-Octatriene,2,6-dimethyl-, (4E,6E)-(E,E)-2,6-二甲基-2,4,6-辛三烯0.95---3514.907Benzene, 1-methyl-4-(1-methylethenyl)-2,4-二甲基苯乙烯4.261.221.422.143615.803a-Copaeneα-胡椒烯0.62---3717.6742,6-Octadiene, 2,6-dimethyl-2,6-二甲基-2,6-辛二烯1.15---3817.911Benzene, 2-ethyl-1,4-dimethyl-2-乙基对二甲苯--1.21-3917.9441H-3a,7-Methanoazulene,octahydro-3,8,8-trimethyl-6-methylene-, (3R,3aS,7S,8aS)-柏木烯1.08---4017.951Benzene, 1-ethyl-3,5-dimethyl-5-乙基-3,5-二甲基苯---0.954118.6121-methyl-4-(5-methyl-1-methylene-4-hexenyl)-红没药烯1.916---4219.0681-(1,5-dimethyl-4-hexenyl)-4-methyl-Α-姜黄烯11.64--9.214320.067l-Calamenene去氢白菖烯0.62---4420.476Benzene, 1-methyl-3-(1-methylethyl)-间异丙基甲苯---0.18

续 表
注:“-”表示未检测到该种物质。
由表1可知,东坡肘子样品选择不同的处理方式,其检测到的化合物种类及含量存在较大差异。采用东坡肘子汤汁与肉混合取样方式检测到的挥发性化合物最多,共检测到45种挥发性化合物,其中酯类3种、醇类9种、烯类16种、醛类6种、酮类4种、醚类1种、酚类3种、呋喃类及含N、S类物质各3种;取东坡肘子汤汁进行GC-MS检测,共检测到44种化合物,同时其检测到挥发性化合物与东坡肘子肉、汁混合取样无明显差异,由图1~图4可知,其总离子流图差异很小;取东坡肘子肉进行GC-MS检测,共检测到25种物质,在相同条件下,加入氯化钠溶液增加其离子浓度,检测得到的物质种类只有23种,造成该结果的原因可能是东坡肘子在加工过程中经历长时间蒸煮过程,部分香气物质逸散至汤汁中,同时,东坡肘子的香气物质还有很大一部分是来自于东坡肘子的调味料所致。由表1可知,东坡肘子汤汁、肉混合取样方式检测到的挥发性化合物主要组分有:乙酸香叶酯、芳樟醇、糠醛、(E,E)-2,4-庚二烯醛、5-甲基呋喃醛、反式-2,4-癸二烯醛、柠檬醛、3-羟基-2-丁酮、l-甲基庚烯酮、2-壬酮、甲基壬基甲酮、2-正戊基呋喃、2,3,5,6-四甲基吡嗪、2-乙酰基吡咯,这些物质大多数对东坡肘子的风味有着一定贡献。综合考虑,本次研究选取东坡肘子肉、汁混合取样方式进行后续研究。
2.2 顶空固相微萃取单因素条件优化
2.2.1 萃取头的选择
不同涂层厚度的萃取头,其合成材料不同,导致萃取头的极性不同[15],从而对不同物质的吸附能力不同。100 μm聚二甲基硅氧烷(PDMS)固相微萃取头对非极性半挥发性化合物有较强的吸附能力[16];50/30 μm二乙烯基苯/碳分子筛/聚二甲基硅氧烷(DVB/CAR/PDMS)固相微萃取头对于挥发性和半挥发性C3-C20的香味物质吸附力较强;65 μm聚二甲基硅氧烷/二乙烯基苯(PDMS/DVB)固相微萃取头可以用于挥发性物质、胺类、硝基芳香类化合物的吸附;75 μm碳分子筛/聚二甲基硅氧烷(CAR/PDMS)固相微萃取头主要用于吸附气体和小分子量化合物[17,18]。由于东坡肘子挥发性风味成分种类繁多,性质各异,因此有必要比较以上4种萃取头对东坡肘子挥发性风味成分萃取效果的影响。为此,以50/30 μm DVB/CAR/PDMS(吸附条件:萃取温度65 ℃、萃取时间75 min、萃取质量5 g)、65 μm PDMS/DVB(吸附条件:同上)、75 μm CAR/PDMS(吸附条件:同上)、100 μm PDMS(吸附条件:同上)为萃取头,初步测定了东坡肘子中的挥发性物质,结果见表2。

表2 4种萃取头的萃取结果Table 2 The extraction results of four extraction fibers

续 表
注:“-”表示未检测到该种物质。
由表2可知,4种萃取头共萃取出53种挥发性化合物,其中75 μm CAR/PDMS萃取头检测到的挥发性风味成分的种类和色谱总峰面积最大,其次是65 μm PDMS/DVB萃取头,最后是100 μm PDMS萃取头。75 μm CAR/PDMS萃取头分别检测出烃类11种、醛类5种、醇类10种、酮类2种、醚类2种、呋喃及含N、S类物质6种,多于其他3种萃取头萃取的物质,因此,本次研究选用75 μm碳分子筛/聚二甲基硅氧烷(CAR/PDMS)固相萃取头进行后续研究。
2.2.2 萃取温度的选择
萃取温度对东坡肘子挥发性化合物的萃取效率受两方面因素影响,随着温度升高,样品分子运动加速,气相中挥发性成分含量会逐渐增加,吸附效率随之提高,同时可缩短萃取平衡时间;另一方面,温度升高会降低萃取头涂层中分析物的分配系数[19]。因此,最佳萃取温度的选择需要考虑这两方面的因素。
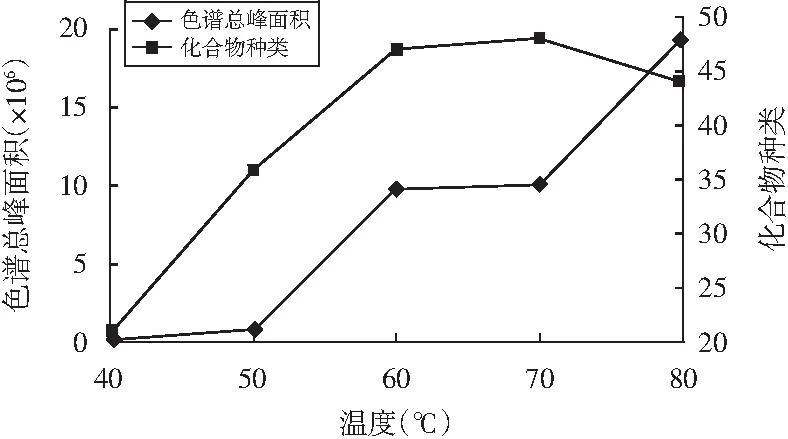
图5 萃取温度对萃取效果的影响Fig.5 Effect of extraction temperature on extraction effect
由图5可知,在60 ℃之前,随萃取温度的升高,萃取物的种类及色谱总峰面积均快速增加;在60~70 ℃之间时,萃取物种类及色谱总峰面积均变化不大;当温度超过80 ℃时,色谱总峰面积虽有所增加,但萃取物种类减少,这可能是由于东坡肘子中的部分不稳定挥发性物质在高温下被分解以及萃取头涂层中分析物的分配系数降低这两个原因造成的,故本次研究选取60 ℃作为最佳萃取温度。
2.2.3 萃取时间的选择
萃取时间对东坡肘子萃取效率的影响主要指达到或接近平衡时所需要的时间,其主要由萃取头、分配系数、样品扩散系数、顶空体积及萃取温度等因素综合作用决定[20]。萃取开始时萃取头吸附量迅速增加,接近或达到平衡时吸附速度极其缓慢,而达到平衡后,萃取头上易挥发物质会被解吸,使吸附量下降,因此,需在萃取达到或接近平衡之前结束萃取过程。萃取时间对东坡肘子萃取效率的影响见图6。
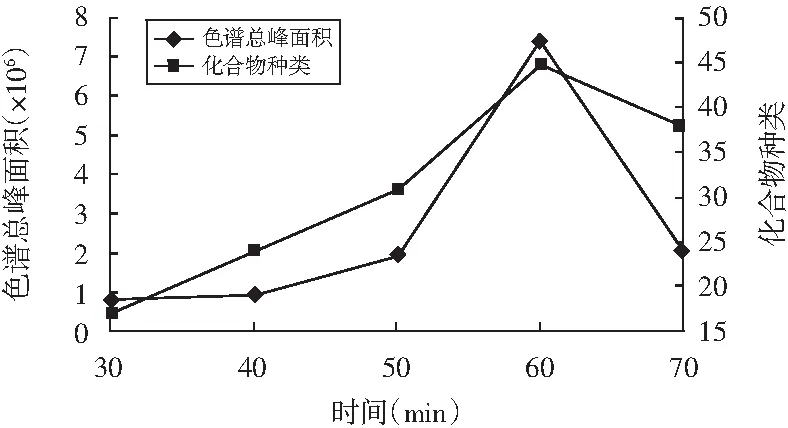
图6 萃取时间对萃取效果的影响Fig.6 Effect of extraction time on extraction effect
由图6可知,萃取时间为60 min时,萃取物种类最多且色谱总峰面积最大;萃取时间达到70 min时,萃取物种类和色谱总峰面积均有所降低,表明萃取60 min时已达平衡;在70 min时萃取头上易挥发物质已被解吸。故本次研究选取60 min作为最佳萃取时间。
2.3 正交试验设计
根据单因素试验结果选取的3个因素,按照正交试验设计原理,选取3个水平,得到正交设计试验结果及分析,见表3。

表3 正交试验结果及分析Table 3 The orthogonal experimental results and analysis
从正交试验9个处理中直观找出最优组合为8号处理样,即A3B1C2,试验指标为化合物种类67种、色谱总峰面积1.9262(×1010);其次是7号和5号处理样,分别为A3B3C1和A2B3C2,试验指标分别为7号化合物种类58种、色谱总峰面积1.5585(×1010),5号化合物种类51种、色谱总峰面积1.8857(×1010)。对正交试验结果和试验指标进行直观分析验证得到表3所示结果。由表3可知,由萃取得到的化合物种类考察萃取效果时,其涂层厚度所在因素列的极差R最大,表明萃取头涂层厚度的水平变化对试验指标的影响度最大,其次是萃取时间对试验指标的影响,而温度对其影响相对较小;由萃取得到的色谱总峰面积考察萃取效果时,其萃取温度所在因素列极差R最大,其次是涂层厚度,极差最小的为萃取时间。
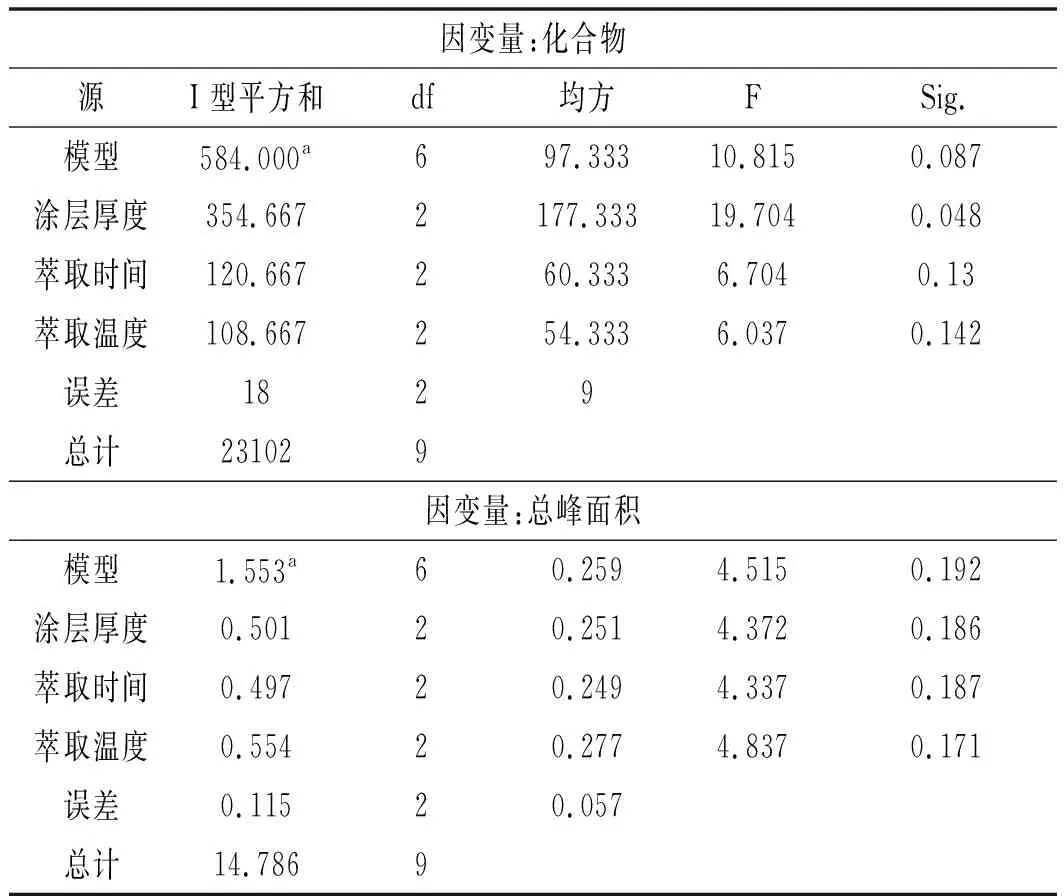
表4 正交试验方差分析表Table 4 Table of variance analysis of orthogonal experiment
由表4可知,萃取头涂层厚度和萃取时间2个因素对萃取具有显著影响,而萃取温度对其的影响较小,因此,选出最佳实验条件为A3B2C2,即萃取头涂层厚度为75 μm,萃取时间为60 min,萃取温度为65 ℃。由于选出的最佳实验条件与实际最优水平组合实验条件不一致,因此需要对2个实验条件进一步进行验证。
2.4 最优萃取条件验证性实验
由正交试验选出的最佳实验条件A3B2C2以及其实际最佳条件A3B1C2对东坡肘子挥发性成分进一步萃取,得到其萃取结果见表5。
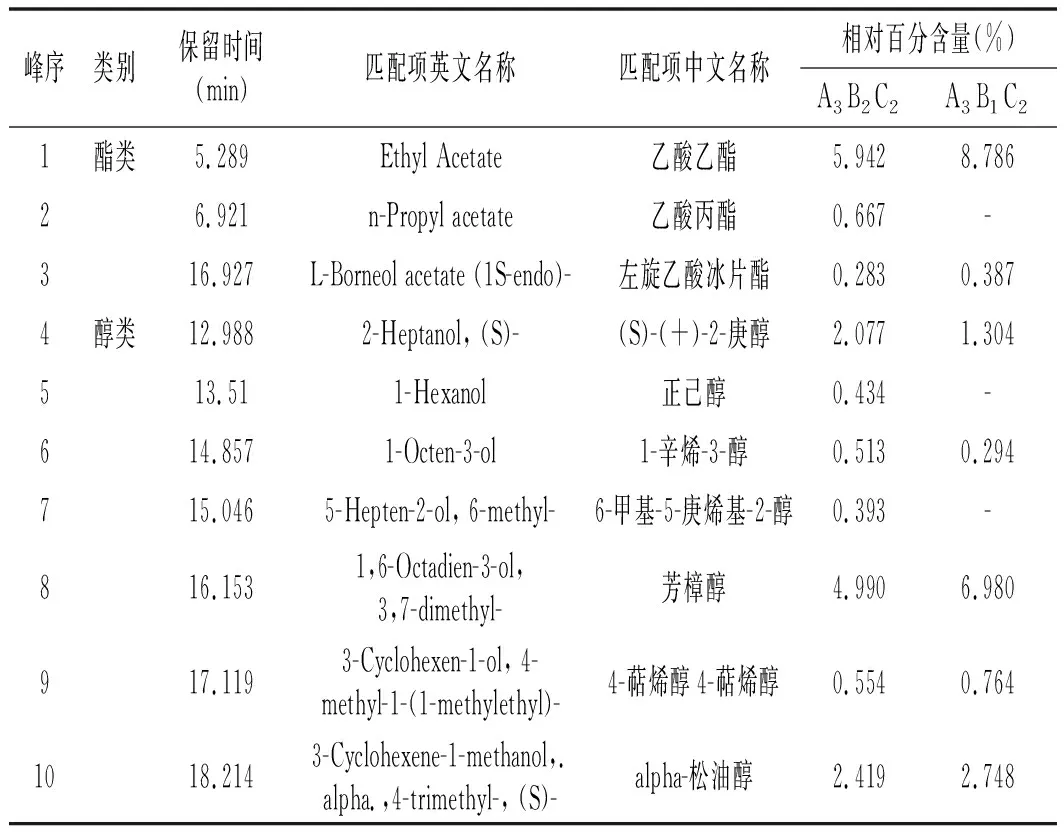
表5 东坡肘子的GC-MS分析Table 5 GC-MS analysis of Dongpo elbow

续 表
注:“-”表示未检测到该种物质。
由表5可知,采用正交试验得到的最优萃取组合和利用正交分析得到的最佳萃取条件对东坡肘子进行GC-MS分析,共检测出44种挥发性物质,其中以条件A3B2C2(即萃取头涂层厚度为75 μm,萃取时间为60 min,萃取温度为65 ℃)萃取得到45种化合物,其中3种酯类化合物、11种醇类化合物、17种烯烃类化合物、5种醛类物质、2种酮类物质、3种呋喃类物质及3种含氮硫类物质和1种酸类物质;以条件A3B1C2(即萃取头涂层厚度为75 μm,萃取时间为45 min,萃取温度为65 ℃)萃取得到34种化合物,其中2种酯类物质、8种醇类物质、13种烯烃类化合物、5种醛类物质、3种酮类物质、2种呋喃及含氮硫类物质和1种酸类物质。两种萃取得到挥发性化合物类别一样,但以45 min为萃取时间得到的化合物种类及总量均比在60 min萃取条件下得到的少,且总峰面积最大的是60 min萃取条件下得到的色谱图,因此,本次研究选取最佳实验条件为A3B2C2,即萃取头涂层厚度为75 μm,萃取时间为60 min,萃取温度为65 ℃。
3 结语
本研究从样品处理对萃取效果的影响和正交设计优化萃取条件两个方面对东坡肘子挥发性风味成分的萃取条件进行研究,结果表明:对萃取样品采用不同的处理方式,萃取效果存在较大差异,东坡肘子成品风味由其汤汁和原料共同构成,采用东坡肘子汤汁与原料混合取样方式比单独选取其原料或汤汁萃取得到的化合物种类及含量多。采用正交设计试验对挥发性风味成分萃取条件进行优化研究,通过直观分析和方差分析得出其最佳萃取条件为:75 μm CAR/PDMS萃取头、萃取时间60 min、萃取温度65 ℃。采用最佳萃取条件检测王家渡东坡肘子香气成分,共得出45种挥发性风味物质,包括酯类、醇类、烃类、醛类、酮类、呋喃及含氮硫物质以及酸类物质,且化合物种类及总峰面积均远大于其他萃取条件。
东坡肘子作为具有悠久历史的传统名菜,现已经实现工业化生产,同时也带来了巨大的经济效益。风味是东坡肘子品质鉴定最重要的指标,但其评价方法均为各生产厂家根据国家食品标准制定的品质检测方法,这些方法受人为因素影响较大且没有统一的评价标准,造成当前市场各东坡肘子价格存在一定的差异,其风味各异。因此,通过研究可为东坡肘子挥发性成分的快速检测及进一步分析研究提供一定的技术保证。
参考文献:
[1]向东.东坡肘子味之腴[J].四川烹饪,2011(5):85.
[2]纪有华,王荣兰.红烧肉风味形成途径探讨[J].扬州大学烹饪学报,2006,23(2):19-23.
[3]刘云,张瑶.发酵肉制品风味物质的研究进展[J].肉类工业,2009(4):51-54.
[4]唐静,张迎阳,吴海舟,等.传统腌腊肉制品挥发性风味物质的研究进展[J].食品科学,2014(15):283-288.
[5]周芳伊,张泓,黄峰,等.肉制品风味物质研究与分析进展[J].肉类研究,2015(7):34-37.
[6]钟昳茹,周辉,娄爱华,等.不同烟熏烘烤方式对湘西腊肉挥发性成分的比较[J].现代食品科技,2015(7):361-371.
[7]刘士健.腊肉加工过程中主体风味物质变化研究[D].重庆:西南农业大学,2005.
[8]高尧来,朱晶莹.美拉德反应与肉的风味[J].广州食品工业科技,2004,20(1):91-94.
[9]贺家亮,康怀彬,刘丽莉,等.肉制品风味研究进展[J].中国食物与营养,2014,20(5):34-37.
[10]周洁,王立,周惠明.肉品风味的研究综述[J].肉类研究,2003(2):16-18.
[11]Wang R,Yang C,Song H.Key meat flavour compounds formation mechanism in a glutathione-xylose Maillard reaction[J].Food Chemistry,2012,131(1):280-285.
[12]Machiels D.Gas chromatography-olfactometry analysis of the volatile compounds of two commercial Irish beef meats[J].Talanta,2003,60(4):755-764.
[13]罗奎,于淑娟,李延军.影响肉制品风味形成的因素[J].肉类工业,2005(3):1-5.
[14]王锡昌,陈俊卿.顶空固相微萃取与气质联用法分析鲢肉中风味成分[J].上海水产大学学报,2005,14(2):176-180.
[15]刘妍,杨富巍.固相微萃取涂层的研究进展[J].资源开发与市场,2011(11):981-984.
[16]Song Jun,Gardner B D,Holland J F.Rapid analysis of volatile flavor compounds in apple fruit using SPME and GC/Time-of-Flight Mass Spectrometry[J].Journal of Agricultural & Food Chemistry,1997,45(5):1801-1807.
[17]Ligor M,Marek S,Buszewski B.New coating surfaces of fibers for solid-phase microextraction[J].Journal of Microcolumn Separations,1999,11(5):377-383.
[18]Buszewski B,Ligor M.Determination of menthol and menthone in food and pharmaceutical products by solid-phase microextraction-gas chromatography[J].Journal of Chromatography,1999,847(s1/2):161-169.
[19]崔丽伟,胡平,王璐.固相微萃取及其在食品分析中的应用[J].广东化工,2014,41(19):93.
[20]Steffen A,Pawliszyn J.Analysis of flavor volatiles using headspace solid-phase microextraction[J].Agric. Food Chem.,1996,44(8):2187-2193.
