内酯型槐糖脂与乳酸链球菌素对金黄色葡萄球菌的抑菌活性比较及联合抑菌效果研究
2018-06-13吕志飞连战王如娜冯昱宁陈静刘新利
吕志飞,连战,王如娜,冯昱宁,陈静*,刘新利
(1.齐鲁工业大学(山东省科学院)生物工程学院,济南 250353;2.齐鲁工业大学(山东省科学院)山东微生物工程重点实验室,济南 250353)
金黄色葡萄球菌是人类的一种重要病原菌,是食品安全国家标准规定的绝大多数食品的必检指标。乳酸链球菌素是我国《食品添加剂使用卫生标准》中允许在食品中使用的微生物源防腐剂,但是乳酸链球菌素仅抑制引起食品腐败的多种革兰氏阳性菌,一般对革兰氏阴性菌、霉菌、酵母菌没有抑制效果。因此,若将乳酸链球菌素与抗真菌的物质联合使用,可以抑制食品中的有害细菌和真菌。
槐糖脂是一类由非致病性酵母菌产生的糖脂类生物表面活性剂,具有无毒、生物可降解、环境友好等优点,在环境保护、洗涤剂及医药等方面展示了良好的应用前景[1-8]。近年来,对槐糖脂药物活性的研究已有许多文献报道,其中包括了槐糖脂的抗菌作用[9-14]。Kim等报道30 μg/mL的槐糖脂作用于大肠杆菌时,可使致病性大肠杆菌全部死亡。董永胜等报道了槐糖脂对植物源致病真菌有良好的抑制效果[15]。伏圣秘等报道了槐糖脂对水稻纹枯菌、水稻稻瘟菌和马铃薯晚疫病菌孢子的萌发、菌丝的生长都有明显抑制作用[16]。Joshi-Navare等报道了当槐糖脂和抗生素联合使用时,槐糖脂能够增强抗生素对细菌的作用[17]。
但是,槐糖脂与乳酸链球菌素联合使用对金黄色葡萄球菌的抑菌作用目前未见报道。本文首先研究并比较了内酯型槐糖脂、乳酸链球菌素单独使用对金黄色葡萄球菌的抑制作用与药物浓度、作用时间的关系;然后进一步研究了两者联合抑制金黄色葡萄球菌的效果。本研究为探讨槐糖脂作为新型微生物源食品防腐剂以及能否与乳酸链球菌素联合应用提供理论依据。
1 材料与方法
1.1 菌株
槐糖脂生产菌株:假丝酵母(CandidabombicolaATCC 22214)。
抑菌实验指示菌:金黄色葡萄球菌(Staphylococcusaureus),山东省工业微生物菌种保藏中心。
1.2 药物
内酯型槐糖脂:本实验室发酵制备,其主要结构见图1。乳酸链球菌素:山东元泰生物工程有限公司。

图1 内酯型槐糖脂分子结构
1.3 方法
1.3.1 药物溶液的配制
1.3.1.1 内酯型槐糖脂溶液
称取一定质量的内酯型槐糖脂加到蒸馏水中,反复震荡并用1 mol/L的NaOH溶液调节pH至6~7之间,使内酯型槐糖脂完全溶解,分别配制成槐糖脂浓度为10 mg/mL和1024 μg/mL的内酯型槐糖脂药物母液,并过滤除菌,根据实验需要稀释至相应浓度。
1.3.1.2 乳酸链球菌素溶液
称取一定质量的乳酸链球菌素于紫外灯下15 min后加到无菌水中,反复震荡至其完全溶解,分别配制成乳酸链球菌素浓度为10 mg/mL和1024 μg/mL的乳酸链球菌素药物母液。
1.3.2 金黄色葡萄球菌菌悬液的制备
挑取LB平板上的金黄色葡萄球菌单菌落接种于100 mL LB液体培养基中,35 ℃,150 r/min培养6 h。取一定体积的菌液用生理盐水稀释至细胞浓度为108cfu/mL,为金黄色葡萄球菌菌悬液。
1.3.3 药物对金黄色葡萄球菌抑菌圈直径的测定
用管碟法定性测定药物对金黄色葡萄球菌的抑制活性。
首先,用移液枪移取100 μL菌浓为108cfu/mL的菌悬液均匀涂布于LB平板上,再用无菌镊子夹取灭菌后的牛津杯置于涂有菌悬液的平板上,牛津杯中注入50 μL浓度分别为2.5,5,7.5,10 mg/mL的药物溶液。小心地将平板置于4 ℃的冰箱中使药物扩散2 h,然后置于35 ℃恒温培养箱中培养24 h,十字交叉法测量抑菌圈直径。
1.3.4 药物对金黄色葡萄球菌的最小抑菌浓度(minimal inhibitory concentration,MIC)
最小抑菌浓度是指微生物在特定生长环境下培养一定的时间,可抑制某种微生物明显增长的最低药物的浓度,用于定量测定体外的抗菌活性。采用美国临床委员会(CLSI)推荐的M7-A7标准方法试管二倍稀释法,再略加修改后进行测定,具体步骤如下:
首先,取13 mm×100 mm试管24支,每排12支,共2排,每排分别标记为1~12号。其中1~10号是药物组,11号是空白对照组,12号是金黄色葡萄球菌阳性对照组。除第1支试管外,其余试管内均加入LB培养基2 mL。分别用LB培养基稀释槐糖脂母液、乳酸链球菌素母液,稀释至最高浓度分别为256,8 μg/mL。然后在第1支和第2支试管中分别加入稀释好的药液2 mL,第2支试管混匀后吸出2 mL加到第3支试管中,依次对倍稀释至第10支试管,吸出2 mL弃去。这样第1排各管内酯型槐糖脂的最终浓度依次为256,128,64,32,16,8,4,2,1,0.5 μg/mL,第2排各管乳酸链球菌素的最终浓度依次为8,4,2,1,0.5,0.25,0.12,0.06,0.03,0.015 μg/mL。用LB液体培养基按照1∶10的比例稀释菌悬液(含菌量约107cfu/mL)。用移液枪准确移取0.1 mL金黄色葡萄球菌菌悬液依次由低浓度到高浓度加到2排1~10,12号试管中,最终接种菌量约为5×105cfu/mL。用移液枪分别准确移取0.1 mL LB液体培养基加到2排第11号试管中。35 ℃下培养24 h后阅读结果,抑制检测菌肉眼可见生长的最低药物浓度为该药对检测菌的MIC。
1.3.5 药物对金黄色葡萄球菌的最小杀菌浓度(minimum bactericidal concentration,MBC)
含菌量为107cfu/mL的金黄色葡萄球菌菌悬液用LB培养基以1∶10的方式连续稀释4次,最后稀释管的含菌量约为103cfu/mL。然后分别取0.1 mL加到3个LB平板上,用涂布器均匀涂布,35 ℃培养24 h后对平板进行菌落计数并计算其平均数N,然后计算菌落数I(I代表0.1% 最初接种菌量的菌落数),见下式:
I=N2+2N2。
将1.3.4中金黄色葡萄球菌培养20 h后将无肉眼可见生长的各试管混匀15 s后再培养4 h,再次混匀后从无肉眼可见生长的各试管中分别取0.1 mL加到LB平板中,用涂布器均匀涂布,35 ℃培养24 h后,对每个平板进行菌落计数并计算其平均值。菌落计数 ≤0.1%最初接种菌量的最低药物浓度为该药对检测菌的最低(或最小)杀菌浓度。
1.3.6 药物对金黄色葡萄球菌的抑菌动力学
采用液体培养抑制测定法略做修改。在菌浓为5×105cfu/mL的金黄色葡萄球菌菌悬液中分别加入一定量的内酯型槐糖脂和乳酸链球菌素,使其终浓度为各自的MIC。35 ℃,150 r/min摇床培养不同时间后用紫外可见分光光度计测定600 nm处的吸光度A。以蒸馏水为对照组。按Hultmark等的方法计算抗菌活力,见下式:
U=A0-AA0。
式中:A0为初始吸光度;A为不同时间的吸光度。
1.3.7 药物相互作用的研究
根据单药抑菌实验结果,按微量棋盘稀释法略做改良进行测定,具体步骤如下:
首先,在5 mL离心管内将内酯型槐糖脂原液和乳酸链球菌素原液分别用LB液体培养基稀释至256,4 μg/mL,再分别依次对倍稀释6个浓度梯度。然后按照“棋盘”稀释法原则组合在无菌的96孔板中加入内酯型槐糖脂和乳酸链球菌素各50 μL。用LB液体培养基稀释菌悬液为106cfu/mL,每孔接种100 μL。使2种药物的最终浓度与计划稀释度相同,最终接种菌量为5×105cfu/mL。将96孔板置于微型振荡器上振荡1 min,使各孔内溶液混匀,96孔板用封口膜密封以减少培养过程中的水分蒸发。35 ℃下培养20 h后,在每孔中加入显色剂5 μL(5 g/L氯化三苯四氮唑),继续培养2 h,将96孔板放在白色背景下观察,孔内液体呈红色表示菌体生长,孔内液体呈LB液体培养基的颜色表示菌体生长被抑制。
分级抑菌浓度指数(fractional inhibitory concentration, FIC)为抗菌药物药效学参数之一,是2种抗菌药的联合药效(2种抗菌药同时使用时,可出现协同、相加、无关和拮抗4种情况)指标。
FIC=(A药联用时的MIC/A药单用时的MIC)+(B药联用时的MIC/B药单用时的MIC)。
FIC≤0.5,是协同作用;0.5
2 结果与分析
2.1 药物对金黄色葡萄球菌的抑菌圈直径
内酯型槐糖脂和乳酸链球菌素对金黄色葡萄球菌均有较强的抑制作用,且抑菌圈直径随着2种药物浓度的增加而增大,最大抑菌圈直径分别为10.50,21.30 mm,呈浓度依赖性。乳酸链球菌素对金黄色葡萄球菌的抑制作用明显强于内酯型槐糖脂对金黄色葡萄球菌的抑制作用。同一药物浓度下,乳酸链球菌素对金黄色葡萄球菌的抑菌圈直径大约是内酯型槐糖脂对金黄色葡萄球菌抑菌圈直径的2倍,见图2和表1。
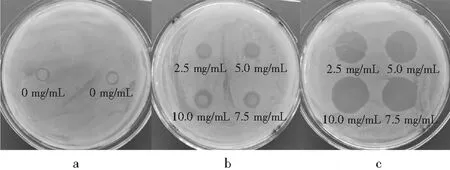
图2 药物对金黄色葡萄球菌的抑菌圈直径
注:a为空白对照,b为内酯型槐糖脂,C为乳酸链球菌素。

表1 药物对金黄色葡萄球菌的抑菌圈直径(N=4)
2.2 药物对金黄色葡萄球菌的最小抑菌浓度

图3 药物对金黄色葡萄球菌的最小抑菌浓度
注:S为内酯型槐糖脂,L-SLs;N为乳酸链球菌素,Nisin。
图3中S是内酯型槐糖脂对金黄色葡萄球菌的最小抑菌浓度实验结果。由图3中S可知,1~4号试管澄清,5~10号试管浑浊,11号试管澄清,12号试管浑浊。因此,抑制金黄色葡萄球菌肉眼可见生长的最低药物浓度为4号试管对应的内酯型槐糖脂浓度,即32 μg/mL。所以,内酯型槐糖脂对金黄色葡萄球菌的MIC值为32 μg/mL。
图3中N是乳酸链球菌素对金黄色葡萄球菌的最小抑菌浓度实验结果。由图3中N可知,1~5号试管澄清,6~10号试管浑浊,11号试管澄清,12号试管浑浊。因此,抑制金黄色葡萄球菌肉眼可见生长的最低药物浓度为5号试管对应的乳酸链球菌素浓度,即0.5 μg/mL。所以,乳酸链球菌素对金黄色葡萄球菌的MIC值为0.5 μg/mL。
2.3 药物对金黄色葡萄球菌的最小杀菌浓度
金黄色葡萄球菌在35 ℃培养24 h后对平板进行菌落计数,得出菌落数N=40,然后代入I值的计算公式,求得代表0.1%最初接种菌量的菌落数I值为28。
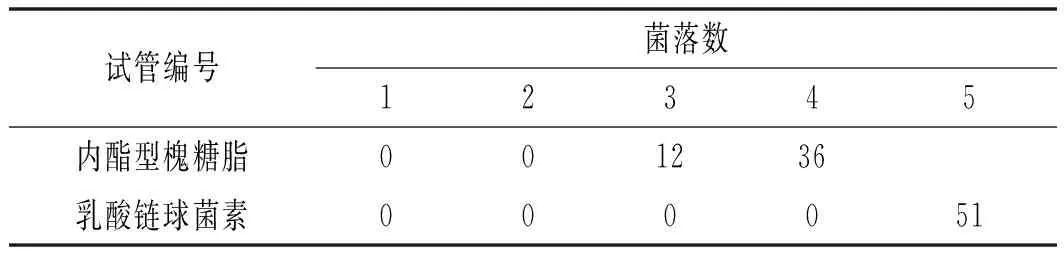
表2 药物对金黄色葡萄球菌的最小杀菌浓度(N=3)
由表2可知,菌落计数≤28的平板所对应的内酯型槐糖脂试管编号为1#,2#,3#,所对应的乳酸链球菌素试管编号为1#,2#,3#,4#。根据最小杀菌浓度的定义得出,内酯型槐糖脂对金黄色葡萄球菌的最小杀菌浓度为64 μg/mL;乳酸链球菌素对金黄色葡萄球菌的最小杀菌浓度为1 μg/mL。
2.4 药物对金黄色葡萄球菌的抑菌动力学
利用液体体外抑菌实验,测定内酯型槐糖脂、乳酸链球菌素的活性与作用时间的关系,即抑菌药物的抑菌动力学。实验结果表明:内酯型槐糖脂和乳酸链球菌素的药物活性随作用时间延长均呈先上升后下降再趋于平稳的趋势。两者均在0~1 h出现一个活性峰,1 h之后活性下降,随后一直趋于稳定,见图4。
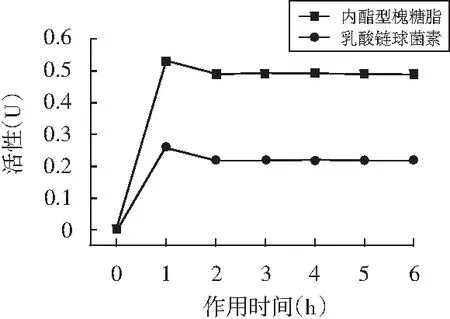
图4 药物对金黄色葡萄球菌的抑菌活性与作用时间的关系
2.5 药物的相互作用研究
根据抑菌圈直径以及MIC值的测定结果,采用微量棋盘稀释法对内酯型槐糖脂和乳酸链球菌素进行联合抑菌活性研究,并以FIC值进行效果评价。内酯型槐糖脂和乳酸链球菌素联合抑菌效果见图5。内酯型槐糖脂联用时的MIC为16 μg/mL,内酯型槐糖脂单用时的MIC为32 μg/mL,乳酸链球菌素联用时的MIC为0.5 μg/mL, 乳酸链球菌素单用时的MIC为0.5 μg/mL,然后代入FIC值的计算公式,求得FIC值为1.5,1<1.5<2,内酯型槐糖脂和乳酸链球菌素联合使用表现出无关作用。
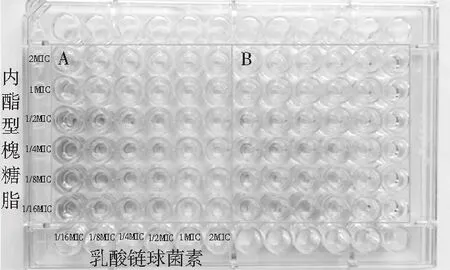
图5 内酯型槐糖脂与乳酸链球菌素的药物相互作用
注:A,B为2次平行实验。
3 讨论与结论
槐糖脂是一种微生物源的表面活性剂,具有降低表面张力、乳化、分散、增溶等作用,可以应用在食品加工过程中改善食品性状、口味和品质,槐糖脂不但能抑制细菌,也能抑制真菌,可以同时对食品起到防腐保鲜功能。因此有望开发成一种食品添加剂,既可以改善食品性状和口味从而提高品质,又可以防腐保鲜。一种添加剂能够达到两种目的,从而减少食品添加剂的使用种类。
槐糖脂既可以单独使用,也可以与其他药物联合使用。已有文献报道槐糖脂与临床药物联合使用的效果。Sanada等报道槐糖脂作为皮肤吸收促进剂能够促进聚六亚甲基双胍的皮肤渗透而增强抗真菌作用[18]。Joshi-Navare等报道槐糖脂与四环素、槐糖脂和头孢克洛联合使用时,对金黄色葡萄球菌和大肠杆菌的抑制呈现协同增效作用。但是,槐糖脂与乳酸链球菌素的联合应用未见报道。
乳酸链球菌素是乳酸链球菌产生的由多种氨基酸组成的多肽类化合物,是一种无毒的天然防腐剂,广泛应用于乳制品、罐头制品、鱼类制品、饮料等食品中。乳酸链球菌素能有效抑制引起食品腐败的多种革兰氏阳性细菌,如金黄色葡萄球菌、肉毒梭菌、李斯特氏菌等,其抗菌作用是通过干扰细胞膜的正常功能,造成细胞膜的渗透、养分流失和膜电位下降,从而导致致病菌和腐败菌的死亡。
本文研究了内酯型槐糖脂和乳酸链球菌素单独使用以及两者联合使用,不同情况下对金黄色葡萄球菌的抑制活性,探讨槐糖脂单独使用和两者联合应用到食品中的可能性。
研究表明:内酯型槐糖脂和乳酸链球菌素单独使用时都能够在短时间内有效抑制金黄色葡萄球菌的生长繁殖,且表现出较小的MIC值,分别为32,0.5 μg/mL。虽然乳酸链球菌素的抑菌活性稍强,但槐糖脂单独应用到食品中能够达到防腐保鲜和改良食品两种目的。本研究首次证明槐糖脂与乳酸链球菌素联合使用对金黄色葡萄球菌的抑制表现出无关作用,没有表现出拮抗作用。该结果与Joshi-Navare等报道的槐糖脂与四环素、槐糖脂与头孢克洛的协同增效作用不一致,可能原因是四环素和头孢克洛都是广谱抗生素,抗菌能力强,而乳酸链球菌素只抑制革兰氏阳性细菌。槐糖脂和乳酸链球菌素联合使用不表现出拮抗作用,说明二者联合应用具有可能性。
本研究证明了槐糖脂单独使用与槐糖脂和乳酸链球菌素联合使用对金黄色葡萄球菌具有很强的抑制作用,且槐糖脂和乳酸链球菌素联合使用不表现出拮抗作用,有望开发成槐糖脂食品添加剂和复合食品添加剂。
参考文献:
[1]Mulligan C N.Environmental applications for biosurfactants[J].Environ Pollut,2005,133:183-198.
[2]Sun X X,Choi J K,Kim E K.A preliminary study on the mechanism of harmful algal bloom mitigation by use of sophorolipid treatment[J].J Exp Mar Biol Ecol,2004,304:35-49.
[3]Singh P,Cameotra S S.Potential applications of microbial surfactants in biomedical sciences [J].Trends in Biotechnol,2004,22:142-146.
[4]Cameotra S S,Makkar R S.Recent applications of biosurfactants as biological and immunological molecules[J].Curr Opin Microbiol,2004(7):262-266.
[5]Mulligan C N,Yong R N,Gibbs B F.Remediation technologies for metal contaminated soils and groundwater:an evaluation [J].Eng Geol,2001,60:193-207.
[6]Mulligan C N,Yong R N,Gibbs B F.Removal of heavy metals from contaminated soil and sediments using the biosurfactant surfactin [J].J Soil Contam,1999(8):231-254.
[7]Sun X X,Lee Y J,Choi J K,et al.Synergistic effect of sophorolipid and loess combination in harmful algal blooms mitigation[J].Mar Pollut Bull,2004,48:863-872.
[8]袁兵兵,杨姗姗,陈静.微生物源槐糖脂对水果致腐真菌的抑制作用[J].应用与环境生物学报,2011,17(3):330-333.
[9]Bogaert V,Saerens K,Muynck D C,et al.Microbial production and application of sophorolipids [J].Appl Microbiol Biotechnol,2007,76:23-34.
[10]Chen J,Song X,Qu Y B,et al.Studies on optimization of sophorolipid fermentation by yeast strain Y2A and antimicrobial activity of sophorolipid [J].Shandong Univ Nat Sci,2005,40(3):116-120.
[11]Yoo D S,Lee B S,Kim E K.Characteristics of microbial biosurfactant as an antifungal agent against plant pathogenic fungus[J].Microbiol Biotechnol,2005,15(6):1164-1169.
[12]Kim K J,Yoo D,Kim Y,et al.Characteristics of sophorolipid as an antimicrobial agent[J].Microbiol Biotechnol,2002,12(2):235-241.
[13]Shah V,Badia D,Ratsep P.Sophorolipids having enhanced antibacterial activity [J].Antimicrobial Agents and Chemotherapy,2007,51(1):397-400.
[14]Dengle-Pulate V,Chandorkar P,Bhagwat S,et al.Antimicrobial and SEM studies of sophorolipids synthesized using lauryl alcohol[J].Journal of Surfactants and Detergents,2014,17(3):543-552.
[15]董永胜,袁兵兵,陈静.槐糖脂对水果致腐菌的抗菌作用及新型防腐保鲜剂的开发[D].济南: 山东轻工业学院,2011.
[16]伏圣秘,陈静.槐糖脂对作物病原真菌的抗菌作用及其新型生物杀菌剂的开发[D].济南:齐鲁工业大学,2014.
[17]Joshi-Navare K,Prabhune A.A biosurfactant-sophorolipid acts in synergy with antibiotics to enhance their efficiency[J].BioMed Research International,2013,2013:1-8.
[18]Sanada H,Nakagami G,Takehara K,et al.Antifungal effect of non-woven textiles containing polyhexamethylene biguanide with sophorolipid:a potential method for tinea pedis prevention [J].Health Care,2014(2):183-191.
