小G蛋白ARL8B是潜在的抗原发性胃低化黏液样腺癌的药物作用靶标
2018-06-13赵京凤成钟王楠任吉霞赵晓宏蔡大勇谢勇
赵京凤,成钟,王楠,任吉霞,赵晓宏,蔡大勇,谢勇
小G蛋白ARL8B是潜在的抗原发性胃低化黏液样腺癌的药物作用靶标
赵京凤,成钟,王楠,任吉霞,赵晓宏,蔡大勇,谢勇
100193 北京,中国医学科学院北京协和医学院药用植物研究所中草药物质基础与资源利用教育部重点实验室(赵京凤、王楠、赵晓宏、蔡大勇、谢勇);030001 太原,山西医科大学基础医学院(成钟);252059 山东,聊城大学生命科学学院(任吉霞)
发现更多表达小 G 蛋白 ARL8B 而 ARL8A 无表达的肿瘤细胞系,以扩大 ARL8B 在抗肿瘤药物研究中的应用范围。
利用实时荧光定量 PCR 法测定一些肿瘤细胞系中的 ARL8B/ARL8A 的相对表达量;以 ARL8A 和 ARL8B 都表达的细胞系作对照,对新发现的只表达 ARL8B 的肿瘤细胞系实施 siRNA 降低 ARL8B 表达量,用 CCK8 法检测 ARL8B 表达量被降低后的细胞活力变化;用 Western blot 考察 ARL8B 表达量降低诱导肿瘤细胞凋亡的原因。
发现 MGC-803 细胞表达 ARL8B 而 ARL8A 无表达,胃癌细胞系 BGC-823 和MKN-45 均表达 ARL8A 和 ARL8B。ARL8B 被敲低后 MGC-803 细胞出现了明显的凋亡,BGC-823 和 MKN-45 细胞无明显的凋亡出现。细胞自噬水平显著提高是引起细胞凋亡的原因。
MGC-803 细胞系来源于胃低分化黏液样腺癌患者,是新发现的表达 ARL8B 而ARL8A 无表达的肿瘤细胞系,降低ARL8B 表达能导致明显的细胞凋亡,提示 ARL8B 是抗胃低分化黏液样腺癌潜在的药物作用靶标。
单体 GTP 结合蛋白质类; ADP 核糖基化因子样蛋白 8B; 分子靶向治疗; 自噬; 原发性胃低分化黏液样腺癌
ADP 核糖基化因子样蛋白 8B(ARL8B)和ARL8A 是结构和功能极其相似的两个小 G 蛋白[1-2],具有调控细胞自噬增减的功能[3-4]。在全身各个器官内这两个蛋白都有表达[1],在极个别的肿瘤细胞,如前列腺癌细胞 PPC1 和 DU145 内仅有 ARL8B 表达而无 ARL8A 表达。对这样的肿瘤细胞实施的异位移植实验证明,降低 ARL8B 表达会显著提升细胞的自噬水平导致肿瘤消亡,因此 ARL8B 是抗肿瘤药物作用的靶标[5]。迄今为止,ARL8B 作为药物作用靶标仅适用于抗前列腺癌的新药筛选。为了扩大 ARL8B 作为抗肿瘤药物靶标的应用范围,我们利用荧光定量 PCR 法测定一些肿瘤细胞系内的 ARL8B/ARL8A 相对表达量,对新发现的表达 ARL8B 而无 ARL8A 的肿瘤细胞系开展 RNA 干扰法降低 ARL8B 表达量对细胞活力的影响研究,以期发现其他以 ARL8B 为潜在药物作用靶标的肿瘤细胞。
1 材料与方法
1.1 材料
1.1.1 细胞及培养基 HeLa、HepG2、IMR-32、MDA-MB-15、MGC-803、MKN-45、BGC-823、HCCC-9810 和 PC-3 细胞均来自国家实验细胞资源共享平台;MEM 培养基、DMEM 高糖培养基、1640 培养基和 F12 培养基均购自美国 HyClone 公司。
1.1.2 主要试剂 胎牛血清、青-链霉素、细胞裂解液、蛋白定量试剂、β-actin 兔多克隆抗体、山羊抗兔 IgG (H+L)、HRP 和 ECL 化学发光试剂均购自北京博奥龙公司;TRIGene 总 RNA 提取试剂购自美国 GenStar 公司;EasyScript First-Strand cDNA Synthesis SuperMix 和 TransStart Top Green qPCR SuperMix 购自北京全式金生物技术有限公司;0.25% 胰蛋白酶溶液购自美国 HyClone 公司;PVDF 转印膜购自德国Merck Millipore 公司;LipofectamineTM2000 购自美国 Invitrogen 公司;CCK8 试剂盒购自日本同仁公司;ARL8A 兔多克隆抗体和 LC3B 特异性识别多克隆抗体购自美国 Proteintech 公司;KIF2A 多克隆抗体购自美国 Abnova 公司。
1.1.3 主要仪器 电泳仪和 CFX96 实时 PCR 系统购自美国 Bio-Rad 公司;高速台式冷冻离心机购自湖南湘仪离心机仪器有限公司;化学发光成像系统购自美国Bio-Rad 公司;细胞培养箱和微量紫外分光光度计购自美国 Thermo 公司。
1.2 方法
1.2.1 细胞培养 MGC-803、MKN-45、BGC-823、HCCC-9810、MDA-MB-15 细胞用 1640 培养基培养,HeLa 和 HepG2 细胞用 DMEM 培养基培养,IMR-32 细胞用 MEM 培养基培养,PC3 细胞用 F-12 培养基培养,每种培养基中添加 10% 胎牛血清、100 IU/ml 青霉素、100 μg/ml 链霉素,细胞静置于 37 ℃、含 5% CO2的细胞培养箱培养。当细胞融合度在 80% ~ 90% 时用 0.25% 胰蛋白酶消化,以 1:3 比例传代。
1.2.2 实时荧光定量 PCR 法检测肿瘤细胞内 ARL8A 和 ARL8B 基因的相对表达量 根据NCBI 上公布的 ARL8A 和 ARL8B 基因的序列设计引物;GAPDH 和 β-actin 引物序列依据文献[6-7]由北京擎科新业生物技术有限公司合成。ARL8A 正向引物:5' GATCGCTTTGTTCAACA AGC 3',反向引物:5' GTCCCAGAGCTTGATAGT CACA 3';ARL8B 正向引物:5' GCTGGCGCTCATC TCC 3',反向引物:5' GCTTCGAAATCGGGGTT 3';GAPDH 正向引物:5' GTCCACTGGCGTCTTCAC 3',反向引物:5' AGGCATTGCTGATGATCTTGA 3';β-actin 正向引物:5' GGACTTCGAGCAAGAGAT GG 3',反向引物:5' AGCACTGTGTTGGCGTA CAG 3'。
当细胞的融合度为 80% ~ 90% 时收集细胞,应用 TRIGene 试剂提取细胞总 RNA。采用反转录试剂盒和 1.0 μg 总 RNA 进行逆转录反应生成 cDNA。采用实时荧光定量试剂盒采用三步法进行扩增反应。每种肿瘤细胞做 3 次生物重复,每种反转录产物做 3 次平行测定,实验数据用比较阈值法(2-∆∆CT)进行相对定量分析[8]。
1.2.3 siRNA 合成、细胞转染以及 CCK8 法检测细胞活力 用于降低 ARL8B 表达的siRNA 由上海吉玛制药技术有限公司设计及合成,合成方法依据化学合成寡聚 RNA 方法实行,合成产物用HPLC 纯化,纯度大于 99%。合成的 siRNA 序列如下:正义链5' CCACCUUCGUCAACGUGAUTT 3',反义链5' AUCACGUUGACGAAGGUGGTT 3'。
将肿瘤细胞制成细胞悬液,接种到 6 孔板中,分为两组,分别是对照组和 siRNA 干扰组,每组设 3 次重复。对照组为不加转染试剂的正常细胞,siRNA 干扰组每孔转染试剂配方:15 μl LipofectamineTM2000、15 μl siRNA(20 μmol/L)、500 μl opti-MEM。具体转染方法按照 LipofectamineTM2000 说明书操作,转染 5 h 后换培养液继续培养 36 h。
取处于对数生长期的细胞,以大约每孔10000 个种于 96 孔板中,每组设6 个复孔,分为对照组和 siRNA 干扰组,并设不含细胞的空白对照。37 ℃、5% CO2培养24 h 后进行siRNA 转染,siRNA 干扰组每孔转染试剂配方为 0.75 μl LipofectamineTM2000、0.75 μl siRNA(20 μmol/L)、100 μl opti-MEM。siRNA 转染按照 LipofectamineTM2000 说明书操作,转染 5 h 后换培养液,继续培养 36 h 后加入CCK8 溶液 10 μl,37 ℃继续培养 15 min,使用多功能酶标仪检测 450 nm 波长处的吸光度值(450)并计算细胞的生长抑制率,公式为:抑制率(%)=[(对照–干扰)/(对照–空白)]× 100%
1.2.4 Western blot 法检测蛋白表达水平 裂解细胞并提取细胞总蛋白,用 Bradford 法检测蛋白溶液浓度。取待测样品 40μg 进行 SDS-PAGE,电泳后采用湿转法将凝胶中的蛋白转移至 PVDF 膜。用含 5% 脱脂奶粉的 TBST 室温封闭 2 h 后,加入按配比要求稀释的一抗溶液,摇床 4 ℃振荡过夜。用 TBST 缓冲液充分洗去多余的一抗和其他杂质后加入二抗溶液,室温孵育 2 h,再用 TBST 缓冲液洗去多余二抗体后加入 ECL 进行发光反应,用化学发光成像系统观测发光强度,使用 ImageJ 软件计算蛋白质的相对表达量。
1.3 统计学处理
2 结果
2.1 肿瘤细胞内 ARL8B 和 ARL8A 的相对表达量
荧光定量 PCR 法测定了 3 种胃癌细胞 MGC-803、BGC-823 和 MKN-45,及乳腺癌MDA-MB-15 细胞,前列腺癌 PC3 细胞,肝癌HepG2 细胞,胆管癌 HCCC-9810 细胞,宫颈癌 HeLa 细胞,神经胶质瘤 IMR-32 细胞等 9 种肿瘤细胞内 ARL8B、ARL8A、β-actin、GAPDH 基因的 CT 值。以 β-actin 为内参,采用 2-∆∆CT法计算出每种肿瘤细胞内 ARL8B 和 ARL8A 对于 GAPDH 的相对表达量,结果如图 1 所示。在这些肿瘤细胞内,ARL8A 和 ARL8B 的表达量都明显低于 GAPDH,并且同种细胞内 ARL8B 表达量高于 ARL8A。以 β-actin 为内参,采用 2-∆∆CT法计算出的每种细胞内 ARL8B 对于 ARL8A 的相对表达量,MGC-803:134.65;BGC-823:11.79;MKN-45:9.26;MDA-MB-15:22.41;PC3:10.65;HepG2:6.53;HCCC-9810:5.56;HeLa:4.13;IMR-32:2.72。结果显示,胃癌 MGC-803 细胞内 ARL8B 和 ARL8A 表达量悬殊值最大,并且 ARL8A 的表达量为无检出状态,因此可以认为 MGC-803 细胞表达 ARL8B 而无 ARL8A 表达,ARL8B 的表达类型和前列腺癌细胞 PPC1 和 DU145 相同。
2.2 siRNA 降低 ARL8B 表达对 3 种胃癌细胞 MGC-803、BGC-823 和 MKN-45 细胞活力的影响
如图 2 所示,siRNA 作用于细胞 36 h 后,MGC-803 细胞的生长抑制率是(68.0 ± 1.9)%,BGC-823 细胞的生长抑制率是(10.9 ± 7.4)%,MKN-45 细胞的生长抑制率是(0.9 ± 4.6)%;显微镜观察发现,MGC-803 细胞出现大量死细胞,而 BGC-823 细胞和 MKN-45 细胞生长状况正常。
2.3 Western blot 检测 siRNA 干扰 ARL8B 基因后相关蛋白的表达水平变化
前列腺癌细胞 PPC1 或 DU145 内降低 ARL8B 表达诱导细胞凋亡的原因是 ARL8B 和 ARL8A 都消失能促进细胞自噬,过度降解自身成分最终导致凋亡[5]。为了验证降低 ARL8B 的表达量诱导胃癌细胞 MGC-803 是否也是同样的原因导致细胞凋亡,用Western blot 检测了 MGC-803 细胞内 siRNA 抑制 ARL8B 表达后表征细胞自噬水平高低的几个蛋白质的相对表达量变化。结果如图 3 显示,siRNA 作用于细胞后观测不到 ARL8B。ARL8A 和 ARL8B 的氨基酸序列相似度为 91%[1],Western blot 分析使用的 ARL8B 抗体也能识别 ARL8A,如果细胞内有 ARL8A 存在的话,在同样的位置也能检测出条带,这个结果支持MGC-803 内 ARL8A 无表达。如已报道的 ARL8B诱导细胞自噬机制所述,ARL8B 蛋白表达量降低,KIF2A 表达量也降低,溶酶体无法迁移到细胞外围只能定位到核区附近,此时 mTORC1 通路被抑制使得细胞自噬被顺利诱导,细胞长期处于高自噬状态最终导致凋亡[3-5]。本项研究中,Western blot 测定结果显示 ARL8B 消失伴随 KIF2 的表达水平降低,与报道的 ARL8B 表达量降低可诱导细胞结论一致(图 3B)。此外观测到的LC3-II/LC3-I 的数值明显增大(图 3C),表明LC3-I 转换 LC3-II的量增加,标志细胞的自噬体形成增多,细胞的自噬水平提升[9-10]。以上实验结果证明,胃癌 MGC-803 细胞也是只表达 ARL8B 的肿瘤细胞,敲低 ARL8B 也能发生细胞凋亡,因此,ARL8B 不仅可以作为抗前列腺癌的药物作用靶标,也能作为抗原发性胃低分化黏液样腺癌的药物作用靶标,对于 ARL8A 和 ARL8B 都表达的胃癌或者其他肿瘤细胞系,仅降低 ARL8B 的表达量不能诱导明显的细胞凋亡,则将 ARL8B 作为抗肿瘤药物作用靶标是不合适的。

图 1 肿瘤细胞内的 ARL8A 和 ARL8B 相对于该细胞 GAPDH 的相对表达量统计图(n = 3,*P < 0.05,**P < 0.01,***P < 0.001)
Figure 1 Statistics of the relative expression of ARL8A and ARL8B, compared with GAPDH in the tumor cells (n = 3,*< 0.05,**< 0.01,***< 0.001)
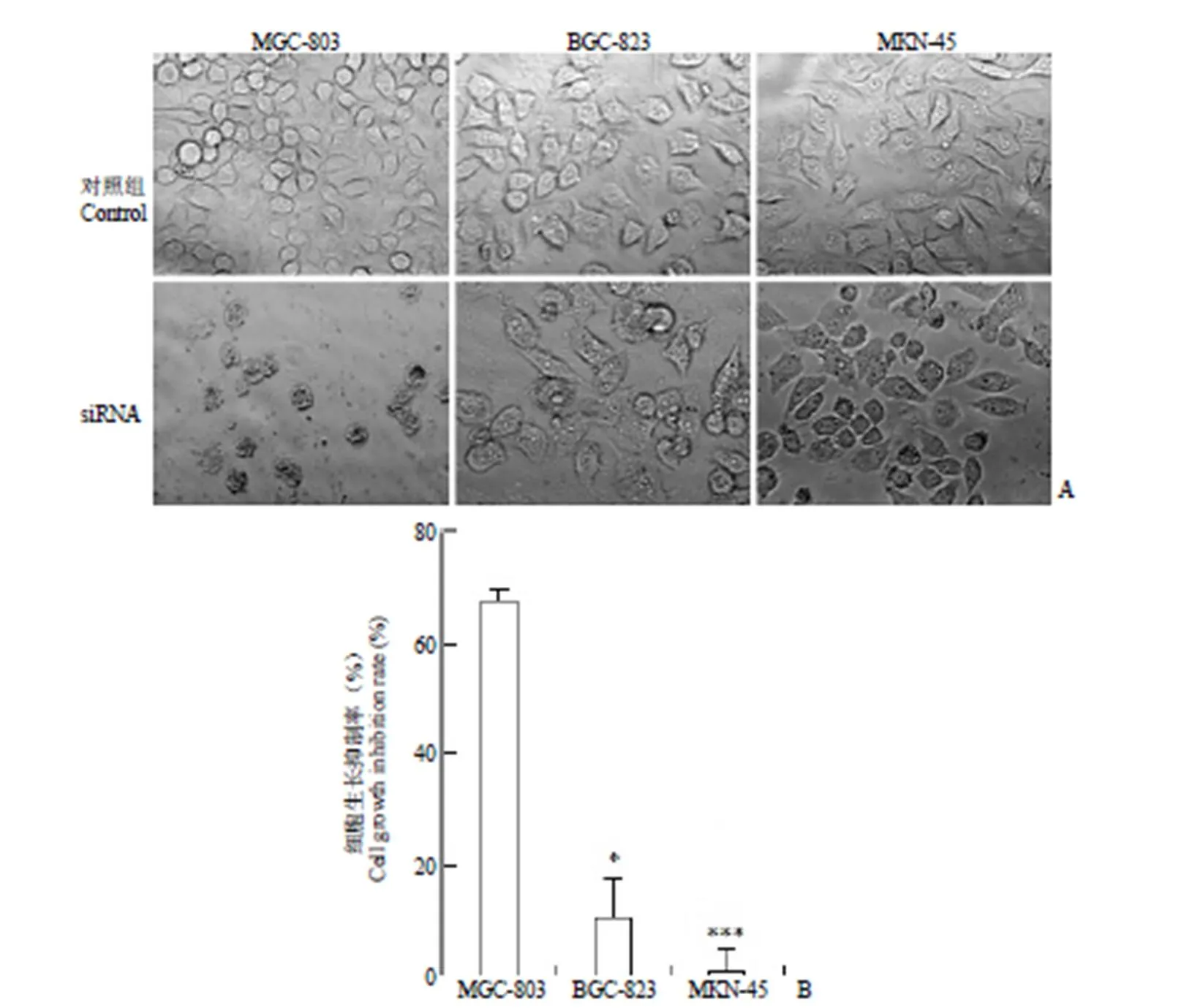
图 2 siRNA 干扰 ARL8B 基因 36 h 时 MGC-803、BGC-823 和 MKN-45 细胞的显微观察(A)(× 200)和生长抑制率统计图(B)(n = 3,和 MGC-803 相比,*P < 0.05,***P < 0.001)
Figure 2 Morphological changes (A) (× 200) and analysis of cell growth inhibition rate (B) of MGC-803, BGC-823 and MKN-45 cells after ARL8B gene knockdown with siRNA for 36 h (n = 3,*< 0.05,***< 0.001 vs MGC-803)
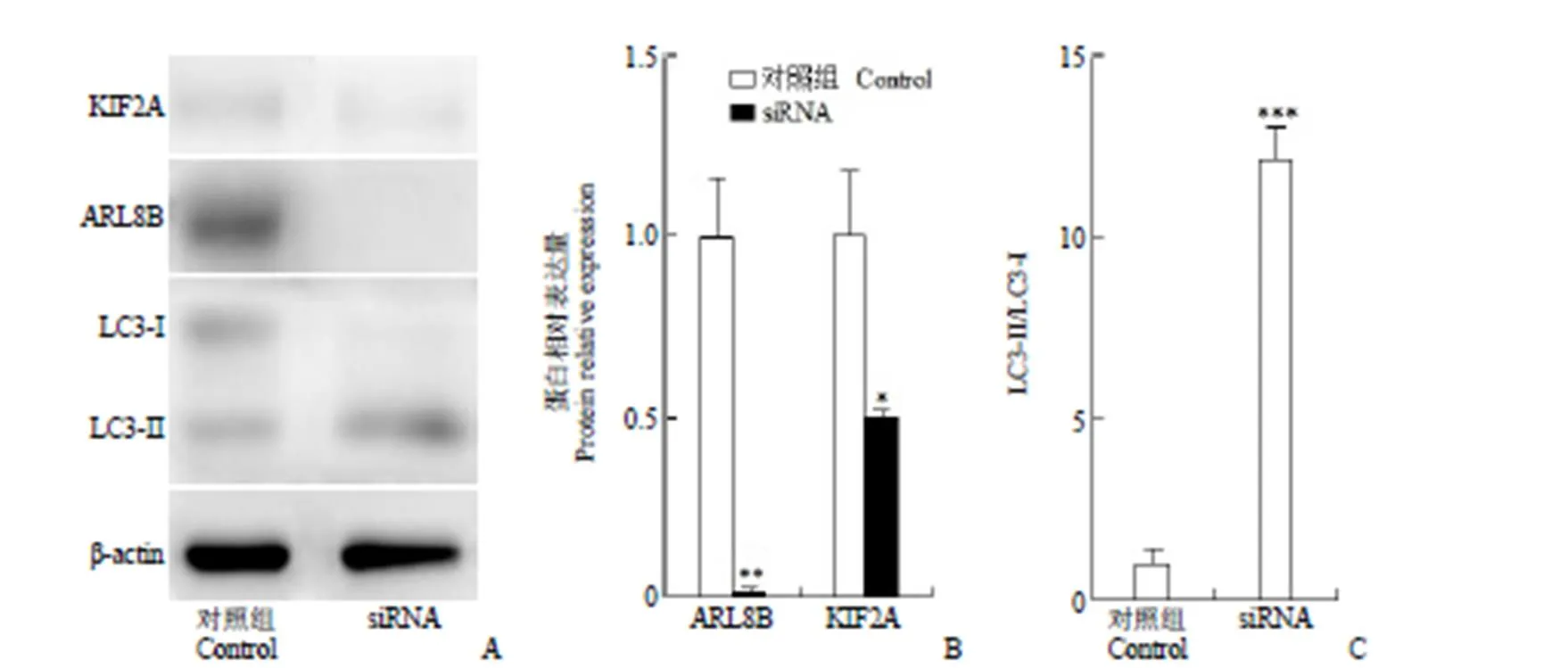
图 3 Western blot 检测 siRNA 干扰 ARL8B 基因后相关蛋白的表达水平变化[A:MGC-803 细胞中表征细胞自噬的几个主要蛋白的印迹图;B:对照组和siRNA 干扰组中 ARL8B 和 KIF2A 蛋白相对表达量(n = 3,*P < 0.05,**P < 0.01);C:对照组和siRNA 干扰组中 LC3-II/LC3-I 比值(n =3,***P < 0.001)]
Figure 3 Expression of related proteins by Western blot after ARL8B knockdown [A: Blots of several major proteins that characterize autophagy in MGC-803 cells; B: Relative expression of ARL8B and KIF2A proteins in control and siRNA interference groups (n = 3,*< 0.05,**< 0.01); C: LC3-II/LC3-I ratio in control and siRNA interference groups (n = 3,***< 0.001)
3 讨论
ARL8A 和 ARL8B 是和溶酶体结合的小 G 蛋白,是溶酶体运动和膜转运的重要调控因子,是调控溶酶体定位诱导细胞自噬水平增减的关键蛋白质[3, 11-15],在免疫细胞内抗原呈递中也发挥关键调控作用[16-17]。自噬是细胞抵抗饥饿产生的反应,对于 ARL8A 和 ARL8B 都存在的细胞,诸如 HeLa 细胞,在营养贫乏的环境中,细胞靠降解细胞内的成分来提供能量和必要营养物质以抵抗饥饿导致的损伤,此时 ARL8A 和 ARL8B 的表达量都降低,溶酶体迁移至细胞中部形成自噬溶酶体,细胞自噬水平增加。当细胞恢复到营养丰富的环境中,ARL8A 和 ARL8B 的表达量都升高,溶酶体迁移至细胞外围,不易形成自噬溶酶体,此时细胞直接吸收外来营养物质维持生命活动,自噬水平降低。又如本项研究中的胃癌 BGC-823 细胞和 MKN-45 细胞,它们在营养丰富的环境中被敲除 ARL8B 时,由于 ARL8A 依然能让溶酶体定位在外围,细胞内不易形成自噬溶酶体,自噬水平不发生显著提升,细胞依然从培养基中摄取营养来维持生命活动,因而细胞活力无明显降低。对只表达 ARL8B 的肿瘤细胞,如前列腺癌细胞 PPC1、DU145 和本文中的胃癌 MGC-803 细胞,在营养丰富的环境中降低 ARL8B 表达量就能导致明显的细胞凋亡。原因是当 ARL8B 和 ARL8A 都不存在的情况下,溶酶体迁移不受它们的控制,更容易形成自噬溶酶体提升细胞的自噬水平。相当于尽管细胞处于营养丰富的环境中却无法从外界吸收营养,只能降解自身的成分来维持生命活动而导致凋亡[5]。依据已有的报道和本项研究发现的 ARL8B 与 ARL8A 的表达量对比结果,肿瘤细胞系分为 ARL8B 单表达型、ARL8A 单表达型和两者共有型,也许还存在 ARL8A 和 ARL8B 都不表达的肿瘤细胞系。迄今为止肿瘤细胞系或者肿瘤患者的癌组织内关于 ARL8B 与 ARL8A 相对表达量的研究成果还很缺乏。尚无 ARL8A 单独表达的肿瘤细胞系的研究报告,ARL8A 是否也能作为药物作用靶标尚需开展深入研究。既有文献[4]和本项研究结果都证实通过降低 ARL8B 的表达量诱导细胞凋亡的方法仅适用于抗 ARL8B 单表达型肿瘤的新药研发。
人源 ARL8B-GDP 复合体的晶体结构已被测定。为开展靶向 ARL8B 抗肿瘤药物理性化筛选提供了分子结构证据。由于 ARL8B 的结构与 ARL8A 极其相似且在全身都有表达,ARL8B 抑制剂对 ARL8A 也会有很好的抑制效果,直接作用于人体可能会出现很大的毒副作用。而 siRNA 是抑制特定基因表达的小分子量核酸,如果能利用靶向给药系统成功实现 ARL8B 的 siRNA 对前列腺癌、原发性胃低分化黏液样腺胃癌组织的定点输送,通过敲低 ARL8B 的表达量实现抑制肿瘤的增殖或扩散,则有望成为高效低毒的抗肿瘤药物。
[1] Okai T, Araki Y, Tada M, et al. Novel small GTPase subfamily capable of associating with tubulin is required for chromosome segregation.J Cell Sci, 2004, 117(Pt 20):4705-4715.
[2] Hofmann I, Munro S. An N-terminally acetylated Arf-like GTPase is localised to lysosomes and affects their motility. J Cell Sci, 2006, 119(Pt 8):1494-1503.
[3] Korolchuk VI, Saiki S, Lichtenberg M, et al. Lysosomal positioning coordinates cellular nutrient responses. Nat Cell Biol, 2011, 13(4): 453-460.
[4] Bento CF, Puri C, Moreau K, et al. The role of membrane-trafficking small GTPases in the regulation of autophagy. J Cell Sci, 2013,
126(Pt 5):1059-1069.
[5] Dykes SS, Gray AL, Coleman DT, et al. The Arf-like GTPase Arl8b is essential for three-dimensional invasive growth of prostate cancer in vitro and xenograft formation and growth in vivo. Oncotarget, 2016, 7(21):31037-31052.
[6] Moein S, Javanmard SH, Abedi M, et al. Identification of appropriate housekeeping genes for gene expression analysis in long-term hypoxia-treated kidney cells. Adv Biomed Res, 2017, 6:15.
[7] Yan B, Huang J, Pang SC, et al. Age-related alterations of the LC3 gene expression in human leukocytes. J Jining Med Univ, 2012, 35(1): 9-13. (in Chinese)闫波, 黄建, 逄淑超, 等. 健康成人白细胞中LC3基因表达水平的年龄相关性研究. 济宁医学院学报, 2012, 35(1):9-13.
[8] Tang YK, Jia YY. Method of processing real time PCR date. Biotechnology, 2008, 18(3):89-91. (in Chinese)唐永凯, 贾永义. 荧光定量PCR数据处理方法的探讨. 生物技术, 2008, 18(3):89-91.
[9] Kabeya Y, Mizushima N, Ueno T, et al. LC3, a mammalianhomologue of yeast Apg8p, is localized in autophagosome membranes after processing. EMBO J, 2000, 19(21):5720-5728.
[10] Tanida I, Minematsu-Ikeguchi N, Ueno T, et al. Lysosomal turnover, but not a cellular level, of endogenous LC3 is a marker for autophagy. Autophagy, 2005, 1(2):84-91.
[11] Mrakovic A, Kay JG, Furuya W, et al. Rab7 and Arl8 GTPases are necessary for lysosome tubulation in macrophages. Traffic, 2012, 13(12):1667-1679.
[12] Garg S, Sharma M, Ung C, et al. Lysosomal trafficking, antigen presentation, and microbial killing are controlled by the Arf-like GTPase Arl8b. Immunity, 2011, 35(2):182-193.
[13] Bagshaw RD, Callahan JW, Mahuran DJ. The Arf-family protein, Arl8b, is involved in the spatial distribution of lysosomes. BiochemBiophys Res Commun, 2006, 344(4):1186-1191.
[14] Sasaki A, Nakae I, Nagasawa M, et al. Arl8/ARL-8 functions in apoptotic cell removal by mediating phagolysosome formation in Caenorhabditis elegans. Mol Biol Cell, 2013, 24(10):1584-1592.
[15] Klassen MP, Wu YE, Maeder CI, et al. An Arf-like small G protein, ARL-8, promotes the axonal transport of presynaptic cargoes by suppressing vesicle aggregation. Neuron, 2010, 66(5):710-723.
[16] Garg S, Sharma M, Ung C, et al. Lysosomal trafficking, antigen presentation, and microbial killing are controlled by the Arf-like GTPase Arl8b. Immunity, 2011, 35(2):182-193.
[17] Michelet X, Garg S, Wolf BJ, et al. MHC class II presentation is controlled by the lysosomal small GTPase, Arl8b. J Immunol, 2015, 194(5):2079-2088.
A small GTPase ARL8B as a potential drug target for treatment of primary gastric myxoid adenocarcinoma with low differentiation
ZHAO Jing-feng, CHENG Zhong, WANG Nan, REN Ji-xia, ZHAO Xiao-hong, CAI Da-yong, XIE Yong
Author Affiliations: Key Laboratory of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine, Ministry of Education, Department of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China (ZHAO Jing-feng, WANG Nan, ZHAO Xiao-hong, CAI Da-yong, XIE Yong); Department of Biochemistry and Molecular Biology, Shanxi Medical University, Taiyuan 030001, China (CHENG Zhong); College of Life Science, Liaocheng University, Shandong 252059, China (REN Ji-xia)
To identify more tumor cell lines expressing the small GTPase ARL8B but not ARL8A, and to understand more about the application of ARL8B in antitumor drug research.
Real-time fluorescence quantitative PCR was used to determine the relative expression levels of ARL8B/ARL8A in some tumor cell lines. The tumor cell line expressing ARL8B only were treated with siRNA to reduce ARL8B expression, then CCK8 was used to detect cell viability. The cell lines expressing both ARL8A and ARL8B were used as control. Western blot was used to examine the mechanism for the apoptosis induced by decreased ARL8B.
Gastric cancer cell line MGC-803 was found to solely express ARL8B, while gastric cancer cell lines BGC-823 and MKN-45 expressed both ARL8A and ARL8B. After ARL8B knockdown, more obvious apoptosis was found in MGC-803 cells, than that in BGC-823 and MKN-45 cells. Significant increase of autophagy might be the cause of apoptosis.
The MGC-803 cell line, isolated from primary gastric myxoid adenocarcinoma with low differentiation, is identified to express only ARL8B. Decreasing the expression of ARL8B can lead to significant cell apoptosis, suggesting that ARL8B might be a potential drug target for the treatment of the primary gastric myxoid adenocarcinoma.
Monomeric GTP-binding protein; ADP-ribosylation factor like protein 8B; Molecular targeted therapy; Autophagy; Primary gastric low differentiation myxoid adenocarcinoma
XIE Yong, Email: yxie@implad.ac.cn
国家自然科学基金(81473114);教育部“新世纪优秀人才支持计划”
谢勇,Email:yxie@implad.ac.cn
2018-01-08
10.3969/j.issn.1673-713X.2018.03.002
