miR-195在胃癌细胞中的表达及对癌细胞凋亡的机制研究
2018-06-13王启船王青屈中玉陶海云赵得堡万里新孙星
王启船,王青,屈中玉,陶海云,赵得堡,万里新,孙星
miR-195在胃癌细胞中的表达及对癌细胞凋亡的机制研究
王启船,王青,屈中玉,陶海云,赵得堡,万里新,孙星
473009 河南省南阳市中心医院肿瘤内科一病区(王启船、屈中玉、陶海云、赵得堡、万里新、孙星),消毒供应中心(王青)
探讨 miR-195 在胃癌细胞中的表达及对癌细胞凋亡的影响和机制。
以人胃黏膜正常细胞 GES-1 作为对照,RT-PCR 检测人胃癌 MNK-28、SGC-7901、BGC-823 细胞中 miR-195 基因的表达;将 miR-195 mimics 转染 BGC-823 细胞,48 h 后 RT-PCR 检测 miR-195 的 mRNA 表达;流式细胞仪检测细胞凋亡;Western blot 检测 cleaved caspase3、Notch1、Hes1 蛋白表达。
miR-195 在 MNK-28、SGC-7901、BGC-823 细胞中的 mRNA 表达均显著低于GES-1(< 0.01),miR-195 在 BGC-823 细胞中的表达最低,选择作为后续研究对象;过表达组细胞凋亡率及 cleaved caspase3 蛋白表达显著高于对照组,Notch1、Hes1 蛋白表达显著低于对照组(< 0.01),而空转染组细胞凋亡率及 cleaved caspase3、Notch1、Hes1 蛋白表达与对照组差异无统计学意义(> 0.05)。
miR-195 在胃癌细胞的过表达可促进癌细胞的凋亡,其机制与下调 cleaved caspase3蛋白表达及 Notch1 信号通路有关。
胃肿瘤; 细胞凋亡; miR-195; Notch1 信号通路
胃癌是常见的消化道肿瘤之一,在世界范围内的发病率和死亡率均较高[1]。胃癌的发生及发展是涉及多种致癌信号传导通路的复杂过程,其中表观遗传的变化受到广泛关注。微小 RNA(microRNAs,miRNAs)是在生物体内发现的一类新的小分子 RNA,由 19 ~ 25 个核苷酸组成,在进化上高度保守,且不编码蛋白,可通过与其特异性的靶 mRNA 结合,降解或抑制蛋白的翻译,从而对基因的表达进行调控[2]。研究显示,在多种恶性肿瘤中 miRNA 的表达出现失调,而一半以上的人类 miRNA 基因定位于人染色体肿瘤相关性基因位点,这提示 miRNA 有抑癌或癌基因样作用[3]。miR-195 是 miR-15a/15b/195/16/497 家族中的一员,定位于人类染色体 17p13.1,该区域常发生杂合性缺失,研究显示,miR-195 与精神分裂症、心脏病、肿瘤等的发生及发展有密切联系[4]。在肺癌、肝癌、膀胱癌等多种肿瘤中表达下调,发挥抑癌样作用[5-7]。但 miR-195 与胃癌的生物学特性及机制尚不清楚。因此,本研究首先检测了不同胃癌细胞 miR-195 的表达,检测过表达后的胃癌细胞的凋亡情况,并进一步探讨引起的机制,为胃癌的早期分子诊断及靶向治疗提供理论基础。
1 材料与方法
1.1 材料
人胃黏膜正常细胞 GES-1 及人胃癌 MNK-28、SGC-7901、BGC-823 细胞均购自中国科学院上海细胞生物学研究所;胎牛血清、RPMI1640 培养基均购自美国 Gibco 公司;Trizol 试剂、LipofectamineTM2000 脂质体转染试剂购自美国 Invitrogen 公司;荧光定量试剂盒及反转录试剂盒购自日本Takara 公司;cleaved caspase3、Notch1、Hes1、GAPDH 抗体均购自美国 Cell Signal Technology 公司;HRP 标记的羊抗鼠 IgG 购自北京中杉金桥生物技术有限公司;BCA 试剂盒、Annexin V-FITC 凋亡试剂盒均购自碧云天生物技术研究所;流式细胞仪购自美国 Becton Dickinson 公司;CO2细胞培养箱购自美国西盟公司。
1.2 方法
1.2.1 细胞培养 取出保存在液氮罐中的 GES-1、MNK-28、SGC-7901、BGC-823 细胞,置于 37 ℃水浴锅中解冻后,在 37 ℃、5% CO2、95% 饱和湿度的恒温孵育箱中用含有 10% 胎牛血清的RPMI1640 细胞培养液培养。细胞生长在 80% ~ 90% 融合度时,用 0.25% 的胰蛋白酶消化细胞,用完全培养基终止消化,根据实验需要传代。
1.2.2 RT-PCR 检测胃癌细胞 miR-195 的表达 取生长至对数期的 GES-1、MNK-28、SGC-7901、BGC-823 细胞,Trizol 法提取细胞中的总 RNA,根据紫外分光光度计检测的值判断 RNA 的质量,260/280在 1.8 ~ 2.0 被认为是质量好的 RNA,根据逆转录试剂盒操作说明将总 RNA 反转录为 cDNA,以 cDNA 为模板,U6 作为内参基因,RT-PCR 检测各组细胞中 miR-195 的 mRNA 表达。所有引物由 Primer premier6.0 软件设计,并由生工生物工程(上海)有限公司合成。反应条件参考产品的说明书。根据 Ct 值利用 2-△△Ct法计算miR-195 的 mRNA 相对表达量。
1.2.3 细胞转染及转染效果检测 转染分为3 组,即对照组(不做任何处理)、空转染组(转染空载体)、过表达组(转染 miR-195 模拟物)。转染前 1 天以 5 × 105个/ml 浓度将生长至对数期的 BGC-823 细胞接种于 6 孔细胞培养板中,细胞生长在 80% 以上融合时进行转染。转染按照 LipofectamineTM2000 说明进行操作。取转染48 h 的上述三组细胞,提取细胞中的总 RNA,按照 1.2.2 方法检测各组细胞中 miR-195 的 mRNA 表达。
1.2.4 细胞凋亡检测 以 1 × 106个/孔将生长至对数期的 BGC-823 细胞接种于 6 孔细胞培养板中,按照上述分组进行转染,转染 48 h 后收集细胞,根据细胞凋亡试剂盒操作说明检测各组细胞的凋亡情况。
1.2.5 Cleaved caspase3、Notch1、Hes1 蛋白表达检测 收集转染后 48 h 的 3 组细胞,加入细胞裂解液置于冰上充分裂解,高速离心后收集上清液,二喹啉甲酸试剂盒检测蛋白浓度。蛋白样品与上样缓冲液按照 1:5 比例充分混匀后煮沸变性 10 min,取变性蛋白用 12% SDS-PAGE 分离,半干法 PVDF 转膜,5% 的脱脂奶粉 TBST 溶液中室温封闭 90 min,分别加入 cleaved caspase3、Notch1、Hes1(均按照 1:500 稀释)和 GAPDH(1:1000 稀释)一抗,4 ℃过夜,TBST 洗涤 3次,每次10 min,加入 1:5000 稀释的 HRP 标记的羊抗鼠 IgG,室温孵育 1 h,ECL 显色,显影后采用 Gel-Pro analyzer 分析各个条带的光密度,以GAPDH 作为内参蛋白,分析 cleaved caspase3、Notch1、Hes1 的蛋白相对表达量。
1.3 统计学处理
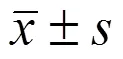
2 结果
2.1 胃癌细胞中 miR-195 的表达
人胃黏膜正常细胞 GES-1 作为对照,RT-PCR 检测人胃癌 MNK-28、SGC-7901、BGC-823 细胞中 miR-195 的表达。结果(图 1)显示,miR-195 在 GES-1、MNK-28、SGC-7901、BGC-823 细胞中的表达分别为 1.00 ± 0.07、0.71 ± 0.11、0.52 ± 0.09、0.39 ± 0.06,miR-195 在 MNK-28、SGC-7901、BGC-823 细胞中的 mRNA 表达均显著低于 GES-1(< 0.01),miR-195 在 BGC-823 细胞中的表达最低,故选择 BGC-823 作为后续研究对象。
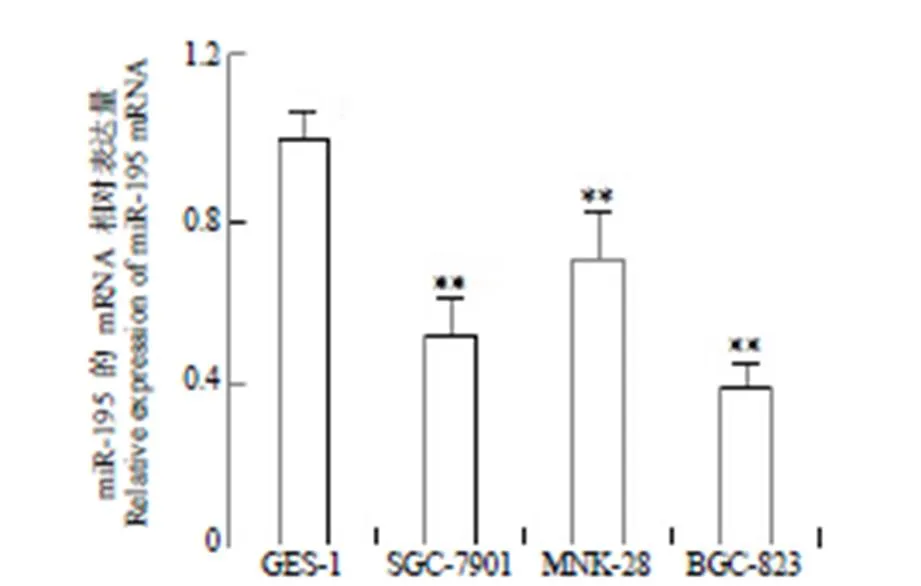
图 1 miR-195 在胃癌细胞中的表达(**P < 0.01)
Figure 1 Expression of miR-195 in gastric cancer cells (**< 0.01)

图 2 过表达 miR-195 后的 BGC-823 细胞中 miR-195 的表达(与对照组比较,**P < 0.01)
Figure 2 Expression of miR-195 in BGC-823 cells after miR-195 overexpression (compared with the control group,**< 0.01)
2.2 过表达 miR-195 后的 BGC-823 细胞中 miR-195 的表达
将对照组、空转染组及 miR-195 过表达组转染 BGC-823 细胞,48 h 后 RT-PCR 检测各组细胞中 miR-195 的 mRNA 表达。结果(图 2)显示,对照组、空转染组及过表达组 miR-195 的 mRNA 表达分别为 1.00 ± 0.15、1.02 ± 0.14、7.56 ± 0.56,过表达组 miR-195 的 mRNA 表达显著高于对照组(< 0.01),而空转染组 miR-195 的 mRNA 表达与对照组差异无统计学意义(> 0.05)。
2.3 过表达 miR-195 促进 BGC-823 细胞凋亡
流式细胞仪检测过表达 miR-195 的各组 BGC-823 细胞的凋亡情况。结果(图 3)显示,对照组、空转染组及过表达组细胞凋亡率分别为(7.12 ± 1.02)%、(7.16 ± 1.06)%、(17.83 ± 1.23)%,过表达组细胞凋亡率显著高于对照组(< 0.01),而空转染组细胞凋亡率与对照组差异无统计学意义(> 0.05)。
2.4 过表达 miR-195 对 BGC-823 细胞 cleaved caspase3、Notch1、Hes1 蛋白表达的影响
Western blot 检测过表达 miR-195 后的BGC-823 细胞凋亡相关蛋白 cleaved caspase3、Notch1 信号通路蛋白 Notch1 和 Hes1 的蛋白表达。结果(图 4)显示,对照组、空转染组及过表达组 cleaved caspase3 蛋白表达分别为 0.052 ± 0.011、0.048 ± 0.010、0.107 ± 0.012,Notch1 蛋白表达分别为 0.778 ± 0.053、0.762 ± 0.051、0.237 ± 0.021,Hes1 蛋白表达分别为 0.341 ± 0.032、0.335 ± 0.030、0.086 ± 0.012,过表达组 cleaved caspase3 蛋白表达显著高于对照组,而 Notch1、Hes1 蛋白表达显著低于对照组(< 0.05),空转染组 cleaved caspase3、Notch1、Hes1 蛋白表达与对照组差异无统计学意义(> 0.05)。
3 讨论
miRNA 是一种内源性非编码的小分子 RNA,通过对靶基因的调控而在多种生命活动过程中发挥重要作用,包括细胞的增殖、凋亡、分化、发育等。有研究表明,大约 60% 的基因编码蛋白受到 miRNA 的调控[8]。miRNA 可通过翻译抑制、切割降解特定的 mRNA 而调控靶基因的表达、蛋白质合成、生物发育、细胞分化等生物学行为,进而影响生命过程的各个阶段[9]。近些年来的研究表明,在多种肿瘤中 miRNA 有异常表达,有癌基因或抑癌基因样作用,与肿瘤的发生发展、转移、复发等有密切关系[10]。miR-195 是 miRNA 家族中的一员,在心、肝、肺、肾、脑组织等均有表达,在心肌肥大、精神分裂症、癫痫等患者中有异常表达,与肿瘤的发生也存在密切关系[11]。研究显示,miR-195 可通过靶向调控 Bcl-2、WEE1、CDK6 等基因表达,参与细胞增殖、周期变化、凋亡等生物过程的调控。在结直肠癌、脑胶质瘤等多种恶性肿瘤中广泛的表达下调,结直肠癌中 miR-195 的表达下调与临床分期及淋巴转移有关[12]。过表达 miR-195 可抑制脑胶质瘤细胞的增殖、诱导 G0/G1 期阻滞,并通过下调 Bcl-2 表达促进细胞的凋亡[13]。miR-195 在胃癌中的研究相对较少。有研究显示,miR-195 在胃癌中表达降低,其表达与淋巴结转移有关[14],将 miR-195 的模拟物转染胃癌细胞后可明显降低癌细胞的侵袭及迁移能力[15]。但过表达 miR-195 对胃癌细胞的凋亡及诱导细胞凋亡的方式和调控的信号通路还未明确。miR-195 在胃癌中表达降低,但在胃癌细胞系中表达情况怎样还未明确,因此本研究首先以人胃黏膜正常细胞 GES-1 为对照细胞,检测了在人胃癌 MNK-28、SGC-7901、BGC-823 细胞 miR-195 的表达,发现 BGC-823 细胞 miR-195 的表达最低,因此选择作为研究对象。通过将 miR-195 的模拟物转染 BGC-823 细胞,流式细胞仪检测细胞凋亡情况,发现过表达 miR-195 可诱导胃癌细胞凋亡。
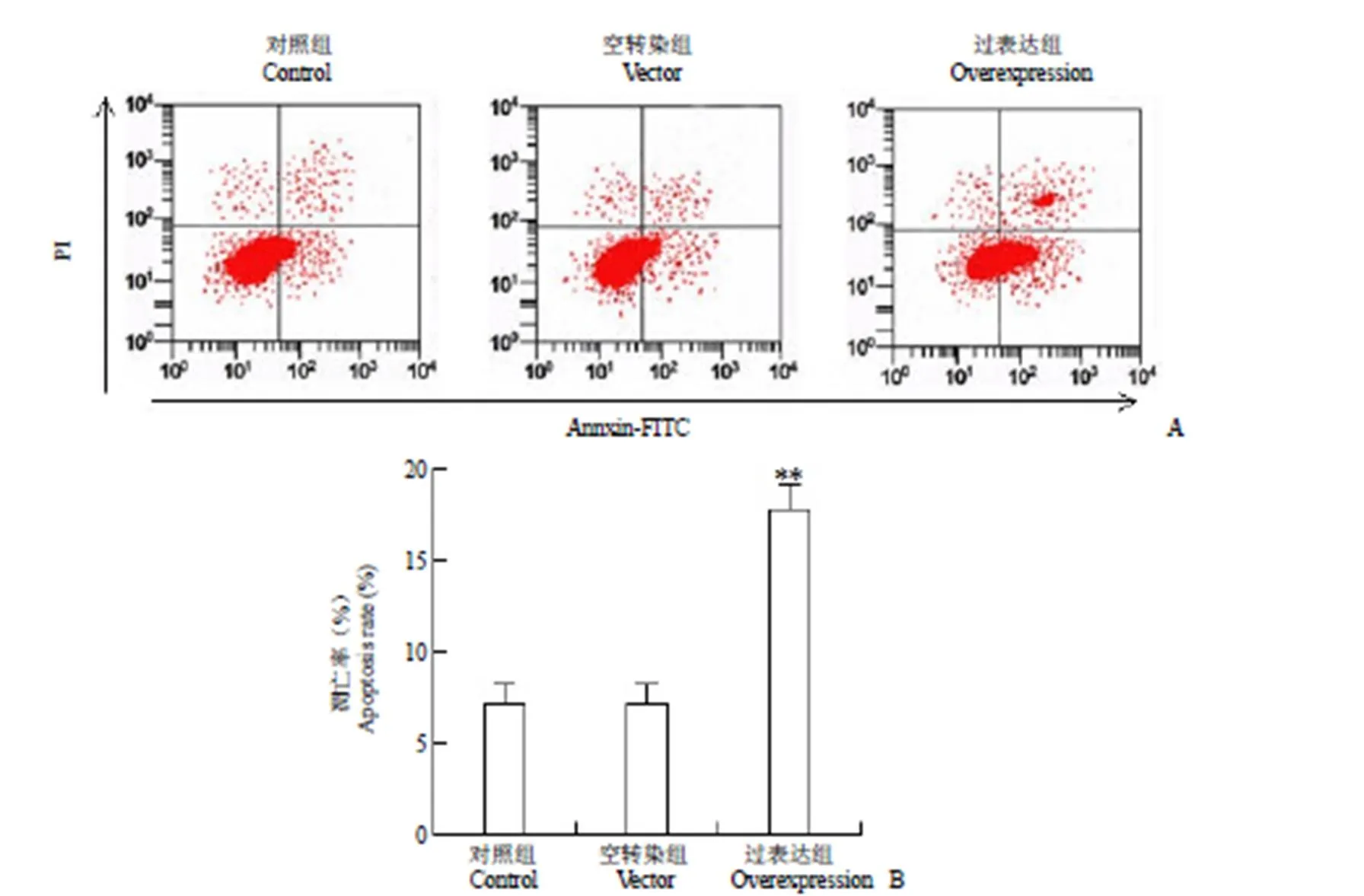
图 3 过表达 miR-195 对 BGC-823 细胞凋亡的影响(A:流式细胞仪检测结果图;B:各组细胞的凋亡率,与对照组比较,**P < 0.01)
Figure 3 Effect of overexpression of miR-195 on the apoptosis of BGC-823 cells (A: Flow cytometry test results; B: Apoptosis rate of each cell, compared with the control group,**< 0.01)
图 4 过表达 miR-195 对 BGC-823 细胞 cleaved caspase3、Notch1、Hes1 蛋白表达的影响
Figure 4 Effect of over expression of miR-195 on the expression of cleaved caspase3, Notch1 and Hes1 protein in BGC-823 cells
Notch1 是一条在进化上保守的信号通路,参与细胞的增殖、凋亡、发育、生存、分化等过程,首先在人类 T 淋巴母细胞白血病中被鉴定出来,目前在肿瘤研究中成为炙手可热的话题。Notch1信号的异常与胃癌、肺癌等肿瘤的发生有密切联系,其信号的紊乱可通过直接或间接作用引起肿瘤的发生[16-17]。有研究指出,抑制 Notch1 信号可降低胃癌的发生及发展[18]。Caspase3 在 caspase 级联反应的下游,是该家族中的关键酶和效应蛋白,被称为“凋亡的执行者”,在正常情况下无活性,有凋亡信号刺激后被激活,其活化是细胞进入凋亡不可逆阶段的标志[19-20]。有研究显示,胃癌细胞中可通过抑制 Notch 信号通路诱导癌细胞凋亡,其诱导凋亡的方式是激活 caspase3[21]。因此,本研究试图证实过表达 miR-195 可通过影响 Notch 信号通路及 caspase3 表达诱导胃癌细胞凋亡。结果显示,过表达 miR-195 后 Notch1 及重要靶基因 Hes1 的表达均显著降低,cleaved caspase3 的表达升高,这提示过表达 miR-195 可通过抑制 Notch1 信号通路诱导胃癌细胞凋亡,其对凋亡的影响方式是上调 cleaved caspase3 的表达。
综上所述,胃癌细胞 miR-195 的过表达可通过下调 cleaved caspase3 蛋白表达及Notch1 信号通路促进癌细胞的凋亡。该研究从分子水平上为胃癌的病因寻找到了理想的标记物,也为该病的诊治提供了一定的线索。
[1] Li Z, Lei H, Luo M, et al. DNA methylation downregulated mir-10b acts as a tumor suppressor in gastric cancer. Gastric Cancer, 2015, 18(1):43-54.
[2] Schwarzenbach H, Nishida N, Calin GA, et al. Clinical relevance of circulating cell-free microRNAs in cancer. Nat Rev Clin Oncol, 2014, 11(3):145-156.
[3] Hayes J, Peruzzi PP, Lawler S. MicroRNAs in cancer: biomarkers, functions and therapy. Trends Mol Med, 2014, 20(8):460-469.
[4] Mortuza R, Feng B, Chakrabarti S. miR-195 regulates SIRT1-mediated changes in diabetic retinopathy. Diabetologia, 2014, 57(5):1037-1046.
[5] Guo H, Li W, Zheng T, et al. MiR-195 targets HDGF to inhibit proliferation and invasion of NSCLC cells. Tumor Biol, 2014, 35(9): 8861-8866.
[6] Yang Y, Li M, Chang S, et al. MicroRNA-195 acts as a tumor suppressor by directly targeting Wnt3a in HepG2 hepatocellular carcinoma cells. Mol Med Rep, 2014, 10(5):2643-2648.
[7] Itesako T, Seki N, Yoshino H, et al. The microRNA expression signature of bladder cancer by deep sequencing: the functional significance of the miR-195/497 cluster. PLoS one, 2014, 9(2): e84311.
[8] Li Y, Liu M, Zhang Y, et al. Effects of ARHI on breast cancer cell biological behavior regulated by microRNA-221. Tumor Biol, 2013, 34(6):3545-3554.
[9] Wei C, Song H, Sun X, et al. miR-183 regulates biological behavior inpapillary thyroid carcinoma by targeting the programmed cell death 4. Oncol Rep, 2015, 34(1):211-220.
[10] Chen D, Guo W, Qiu Z, et al. MicroRNA-30d-5p inhibits tumour cell proliferation and motility by directly targeting CCNE2 in non-small cell lung cancer. Cancer Lett, 2015, 362(2):208-217.
[11] Zheng D, Ma J, Yu Y, et al. Silencing of miR-195 reduces diabetic cardiomyopathy in C57BL/6 mice. Diabetologia, 2015, 58(8):1949- 1958.
[12] Furuya K, Sasaki A, Tsunoda Y, et al. Eribulin upregulates miR-195 expression and downregulates Wnt3a expression in non-basal-like type of triple-negative breast cancer cell MDA-MB-231. Hum Cell, 2016, 29(2):76-82.
[13] Yilaz Susluer S, Biray Avci C, Dodurga Y, et al. Downregulation of miR-195 via cyclosporin A in human glioblastoma cells. J BUON, 2015, 20(5):1337-1340.
[14] Shen YH, Xie ZB, Yue AM, et al. Expression level of microRNA-195 in the serum of patients with gastric cancer and its relationship with the clinicopathological staging of the cancer. Eur Rev Med Pharmacol Sci, 2016, 20(7):1283-1287.
[15] Zhou C, Zhang J, Zheng M, et al. Effect of miR-195 on the abilities of proliferation, migration and invasion in gastric cancer cell. Guangdong Med J, 2014, 35(8):1137-1139. (in Chinese)周畅, 张洁, 郑敏, 等. miR-195对胃癌细胞增殖、迁移及侵袭能力的影响. 广东医学, 2014, 35(8):1137-1139.
[16] Du X, Cheng Z, Wang YH, et al. Role of Notch signaling pathway in gastric cancer: a meta-analysis of the literature. World J Gastroenterol, 2014, 20(27):9191-9199.
[17] Wael H, Yoshida R, Kudoh S, et al. Notch1 signaling controls cell proliferation, apoptosis and differentiation in lung carcinoma. Lung Cancer, 2014, 85(2):131-140.
[18] Kim SJ, Lee HW, Baek JH, et al. Activation of nuclear PTEN by inhibition of Notch signaling induces G2/M cell cycle arrest in gastric cancer. Oncogene, 2016, 35(2):251-260.
[19] Yin SJ, Liu CY, Ren YB, et al. Mechanism of tetramethylpyrazine against apoptosis of SH-SY5Y cells induced by β-amyloid 25-35. Chin J Gerontol, 2016, 36(17):4151-4153. (in Chinese)尹淑杰, 柳朝阳, 任永波, 等. 川芎嗪抗β淀粉样蛋白25~35诱导的SH-SY5Y细胞凋亡作用的机制. 中国老年学杂志, 2016, 36(17): 4151-4153.
[20] Cheng Q, Cao X, Yuan F, et al. Knockdown of WWP1 inhibits growth and induces apoptosis in hepatoma carcinoma cells through the activation of caspase3 and p53. Biochem Biophys Res Commun, 2014, 448(3):248-254.
[21] Yang G, Gong Y, Wang Q, et al. The role of miR-100-mediated Notch pathway in apoptosis of gastric tumor cells. Cell Signal, 2015, 27(6): 1087-1101.
The expression of miR-195 in gastric cancer cells and its mechanism on the apoptosis of cancer cells
WANG Qi-chuan, WANG Qing, QU Zhong-yu, TAO Hai-yun, ZHAO De-bao, WAN Li-xin, SUN Xing
Author Affiliations: Internal Medicine-Oncology (WANG Qi-chuan, QU Zhong-yu, TAO Hai-yun, ZHAO De-bao, WAN Li-xin, SUN Xing), Sterilization and Supply Center (WANG Qing), Nanyang City Center Hospital, Henan 473009, China
To investigate the expression of miR-195 in gastric cancer cells and its influence and mechanism on the apoptosis of cancer cells.
As the control of human gastric mucosa of normal GES-1 cells, miR-195 expression in human gastric cancer SGC-7901, MNK-28, BGC-823 cells were detected by RT-PCR. The miR-195 mimics were transfected into BGC-823 cells. After 48 hours, the mRNA expression of miR-195 was detected by RT-PCR. Apoptosis was detected by flow cytometry. The expression of cleaved caspase3, Notch1, Hes1 protein was detected by Western blot.
The mRNA expression of miR-195 in MNK-28, SGC-7901, BGC-823 cells were significantly lower than that in GES-1 (< 0.01). The expression of miR-195 was lowest in BGC-823 cells and was selected as a follow-up study. Apoptosis rate and cleaved caspase3 protein expression in the overexpression group were significantly higher than those in the control group. The protein expression of Notch1 and Hes1 was significantly lower than that in the control group (< 0.01). However, there was no significant difference of the apoptosis rate, cleaved caspase3, Notch1, and Hes1 protein expression between the empty transfection group and the control group (> 0.05).
Overexpression of miR-195 in gastric cancer cells can promote the apoptosis of cancer cells through up-regulation of cleaved caspase3 protein expression and down-regulation of Notch1 signaling pathway.
Stomach neoplasms; Apoptosis; miR-195; Notch1 signaling pathway
WANG Qi-chuan, Email: ywyrzl@163.com
王启船,Email:ywyrzl@163.com
10.3969/j.issn.1673-713X.2018.03.008
2017-11-15
