PML/RARα融合基因FISH检测试剂盒的研究
2018-06-13缪为民石琳胡林萍李娟刘芸李承文李思奇杜宏伟王征宇
缪为民,石琳,胡林萍,李娟,刘芸,李承文,李思奇,杜宏伟,王征宇
PML/RARα融合基因FISH检测试剂盒的研究
缪为民,石琳,胡林萍,李娟,刘芸,李承文,李思奇,杜宏伟,王征宇
300084 天津,协和干细胞基因工程有限公司(缪为民、石琳、李娟、刘芸、李思奇、杜宏伟);300020 天津,中国医学科学院血液病医院/血液学研究所(缪为民、胡林萍、李承文、王征宇);300084 天津市血液细胞治疗技术企业重点实验室(石琳、李娟、刘芸、李思奇、杜宏伟、王征宇)
自主研制用于检测白血病染色体 PML/RARα 融合基因的双色荧光原位杂交(FISH)检测试剂盒。
根据染色体基因图谱,选定合适的细菌人工染色体(BAC)克隆重叠群分别作为 PML 基因探针和 RARα 基因探针。对入选的 BAC 克隆进行 STS-PCR 鉴定和荧光原位杂交鉴定。最后将完成鉴定的 PML 探针标记红色荧光素,RARα 探针标记绿色荧光素,加上配套试剂组成 FISH 检测试剂盒。用双盲法检测白血病临床样本 37 例,对自制探针和同类进口探针在各项技术参数上进行对比研究。
自制试剂盒检测 PML/RARα 融合基因与进口探针相比,其阴、阳性率和同类进口产品完全符合;自制探针的荧光信号更强,信噪比更高。
自主研制的 PML/RARα 融合基因 FISH 检测试剂盒设计合理、质量可靠,可用于替代价格昂贵的进口产品。
白血病; 易位,遗传; 原位杂交,荧光;PML/RARα 融合基因
15 号染色体长臂 2 区 2 带和 17 号染色体长臂 1 区 2 带易位t(15;17)(q22;q21)是急性早幼粒白血病(acute promyelocytic leukemia,APL)所具有的特征型染色体畸变[1]。该染色体改变导致位于 15q22 的早幼粒白血病(PML)基因与位于 17q21 的维甲酸受体α(RARα)基因发生融合[2]。PML/RARα 融合基因在 90% 以上 APL 初发患者均可检出,已成为 APL 的特异分子标志[3]。APL 也是急性髓系白血病(acute myelocytic leukemia,AML)的一个亚型(M3)[4]。APL 发病凶险、死亡率高,但近年由于诱导分化剂—‒全反式维甲酸(ATRA)的应用,骨髓移植的开展以及三氧化二砷联合用药,使得 APL 成为 AML 中治疗效果和预后最好的一型[5]。靶向药物 ATRA 可以特异性地抑制 PML/RARα 融合蛋白的活力,从而有效地治疗 APL[6]。检测 PML/RARα 融合基因,一方面可以为 APL 提供初始诊断,进而为 ATRA 靶向治疗提供用药依据。另一方面,还可用于 APL 微小残余白血病的监测。由于 APL 即使经 ATRA 诱导达完全缓解后,PML/RARα 仍有较高的阳性率,因此,PML/RARα 融合基因阳性率还可用作预后评估的依据。综上所述,检测 PML/RARα 具有重大的临床意义。
目前,检测 PML/RARα 融合基因有常规细胞遗传学核型分析法、RT-PCR 法以及 FISH 法[7]。其中,FISH 法以其简便、准确、敏感和特异等优点,成为检测 PML/RARα 融合基因的金标准[8]。国际上有美国雅培公司等生产的双色探针用于检测 PML/RARα 融合基因,然而价格昂贵。国内尚无经药监局注册的 PML/RARα 探针用于临床检测。为了满足国内血液学临床和科研的需要,我们对 PML/RARα FISH 检测试剂盒进行了自主研发,并与进口同类产品相比较,报告如下。
1 材料和方法
1.1 材料
质粒纯化试剂盒购于德国 Qiagen 公司;R I、ssDNA、tRNA 购于美国 Sigma 公司;质粒 DNA、DNA 聚合酶 I、人cot-1 DNA、核酸杂交缓冲液 SSPE 购于美国 Invitrogen 公司;绿色荧光素 Spectrum Green-dUTP 购于美国Abbott Molecular公司;红色荧光素 PromoFluor-555-dUTP 购于美国 PromoKine 公司。Axioimager Z2 型荧光显微镜购自德国Zeiss 公司;ThermoBrite 原位杂交仪购自美国 Abbott Molecular 公司。
1.2 方法
1.2.1 样本选择 选择在我院就诊的临床初诊为急性髓系白血病(AML)的成年患者骨髓细胞作为阳性样本,AML 诊断依据文献[9]。
1.2.2 细菌人工染色体 DNA 的 STS-PCR 鉴定 使用 UCSC Genome Bioinformatics 数据库定位检索细菌人工染色体(bacterial artificial chromosome,BAC)克隆[10]。选择定位于 15q22 包含 PML 基因的 BAC 克隆重叠群(图 1A,包括7 个 BAC 克隆),长度达 986 kb,将该 BAC 克隆群标记 PromoFluor-555-dUTP 作为 PML 探针;选择定位于 17q21 包含 RARα 基因的 BAC 克隆群(图 1B,包括 7 个 BAC 克隆),长度达1120 kb,将 BAC 克隆群标记 Spectrum Green-dUTP作为 RARα 探针(表 1)。根据基因图谱,获取每个 BAC 克隆含有的序列标签位点(sequence tagged sites,STS)信息。合成相应的 STS 引物,用 PCR 法对每个 BAC 克隆进行相应的 STS 扩增。扩增条件为:94 ℃预变性 5 min;然后每个循环 94 ℃变性 30 s,58 ℃复性 30 s;72 ℃延伸 30 s,32 个循环;再 72 ℃延伸 7 min。
1.2.3 探针制备 用 Qiagen 质粒纯化试剂盒分离提取 BAC 的 DNA,然后用R I 酶切DNA。用缺口平移法将荧光素标记 DNA,其中 PromoFluor-555-dUTP 标记 PML 基因,Spectrum Green-dUTP 标记 RARα 基因,乙醇沉淀,最后溶于杂交缓冲液。
1.2.4 骨髓细胞与外周血细胞(间期)样本制备 取样本,用 0.075 mol/L KCl 低渗去除红细胞,细胞甩片后用甲醇室温固定过夜,第 2 天用 2% 甲醛固定 5 min 后,储存于–20 ℃ 70% 乙醇中,使用时分别在 70%、85%、100% 乙醇中梯度脱水,晾干后 FISH 检测备用。
1.2.5 外周血细胞中期染色体样本制备 接种正常人外周血细胞 1 ml 至染色体培养基中,轻轻混匀,37 ℃培养 72 h。加入秋水仙素(终浓度为0.4 μg/ml),37 ℃作用 1 h。将培养物转入 15 ml 离心管,1500 r/min 离心 5 min。加入预温至 37 ℃的低渗液 9 ml,混匀,置 37 ℃水浴 40 min。然后固定,滴片,显微镜下观察中期染色体分裂相形成情况,划定杂交区域。
1.2.6 FISH 检测 取制备好的间期和中期细胞片各 30 例,分别加入 2 μl 探针,加盖盖玻片,用封片胶封片后 85 ℃变性 5 min,47 ℃杂交24 h,并以 PML/RARα 融合基因试剂盒作为对照组。用 SSPE 于 47 ℃洗涤 5 min,55 ℃洗涤 10 min。梯度乙醇脱水后加 DAPI 复染细胞核,加盖Zeiss 盖玻片,荧光显微镜下观察,拍照。每张玻片选择 10 个区域拍照,每个通道分别测量 200 个以上细胞。
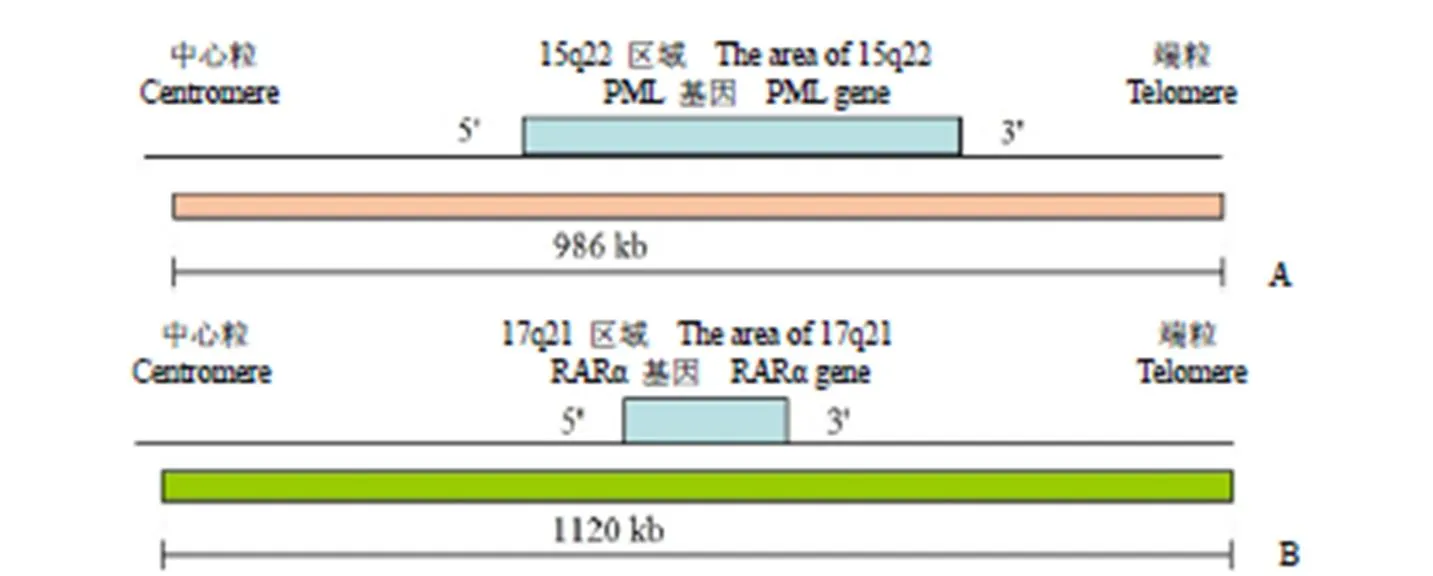
图 1 PML 与 RARα基因图谱(A:PML 基因位于染色体 15q22,红色长条表示包含 PML 基因的 BAC 克隆重叠群,长度达 986 kb;B:RARα基因位于染色体 17q21,绿色长条表示包含RARα基因的 BAC 克隆重叠群,长度达 1120 kb)
Figure 1 Gene map of PML and RARα (A: PML gene is located at chromosome 15q22, the red strip shows BAC clones contigs of the PML gene and the length is 986 kb; B: RARα gene is located at chromosome 17q21, the green strip shows BAC clones contigs of the RARα gene and the length is 1120 kb)

表 1 探针制备及使用 BAC 克隆编码
注:克隆编码为我们实验室的编号。
Note: The clone coding was made by our laboratory.
1.2.7 图像采集及 FISH 信号的检测 用荧光显微镜在 DAPI 图像下选择视野,定位,记录图像采集位置。分别于 Spectrum Green 和 Cy3TMv1(PromoFluor-555)滤光片下观察间期细胞荧光杂交信号。于 63 倍油镜下分别在 DAPI、Spectrum Green、Cy3TMv1 通道中采集细胞核和2 种荧光素的原始图像,软件分析合成最后的分类图像,照相记录。采用 AxioVisionRel 4.8 软件分析测量图像,评估探针杂交情况[11]。每张玻片选择 10 个区域拍照,每个通道分别测量 200 个以上细胞的平均荧光强度和背景强度。
1.3 统计学处理
2 结果
2.1 BAC 克隆的 PCR 鉴定
根据基因图谱,获取每个 BAC 克隆含有的 STS 信息后合成相应的 STS 引物,用 PCR 法对每个 BAC 克隆进行相应的 STS 扩增。图 2 显示部分 BAC 克隆的 STS-PCR 鉴定结果。
2.2 间期细胞 FISH 检测
检测结果显示,自制探针与进口探针分别与正常人的外周血细胞进行杂交,每组检测 30 例,由图 3 可以看出,自制探针与进口探针结果一致,均可以检出 2 个红色的信号点和 2 个绿色的信号点。表明正常人细胞含有 2 个独立的 PML 位点和 2 个独立的 RARα 位点。
2.3 中期细胞 FISH 检测
将制备好的 PML/RARα 探针与正常人的外周血细胞中期染色体分裂相杂交,可以观察到红色荧光素标记的 PML 探针定位在 15 号染色体,绿色荧光素标记的 RARα 探针定位在 17 号染色体。同样,自制探针信号点与对照组探针信号点定位一致无误。(图 4)。
2.4 自制探针和进口探针用于检测同一例已知白血病 PML/RARα 染色体易位阳性的样本
结果显示,自制探针(图5A)和进口探针(图 5B)均可检出一个独立的红色信号和一个独立的绿色信号,以及 1 个红色和绿色融合信号(黄色)。结果提示,该病人含有一个正常的 PML 基因拷贝和一个正常的 RARα 基因拷贝,另一个拷贝的 PML 基因和 RARα 发生了重组,形成了 PML/RARα 融合基因。将自制探针与进口探针对比发现,自制探针信号点更为明亮,与上述结果一致,均显示出自制探针在特异性方面具有更大的优势。
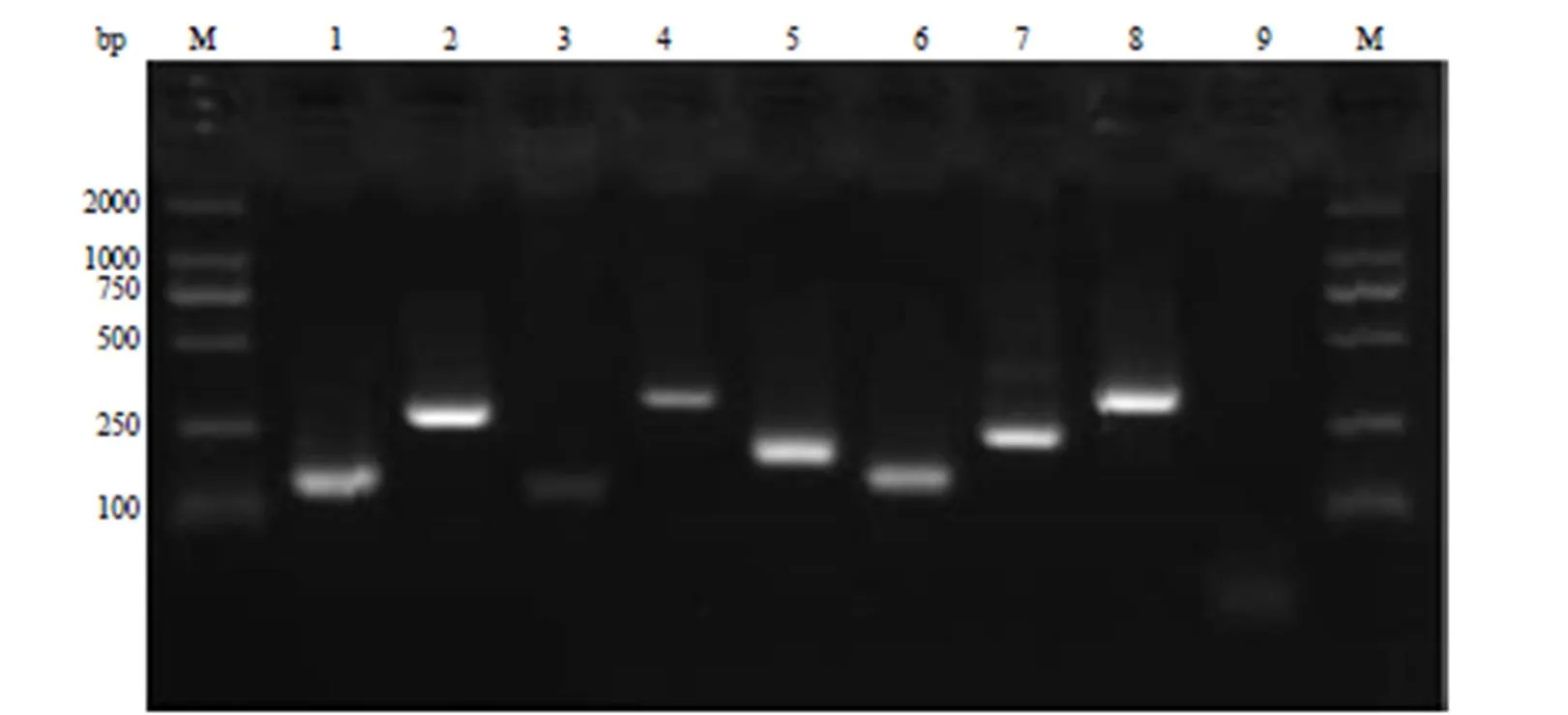
M:D2000;1:PML-R0(WI-14402);2:PML-R1(SHGC-79211);3:PML-R5(RH49076);4:PML-R6(CTD-2516P6);5:RARα-R5(142H19M2);6:RARα-R7(RH12872);7:RARα-R8(RH17717);8:RARα-R9(SHGC-111679);9:空白对照
Figure 2 STS-PCR electrophoretogram
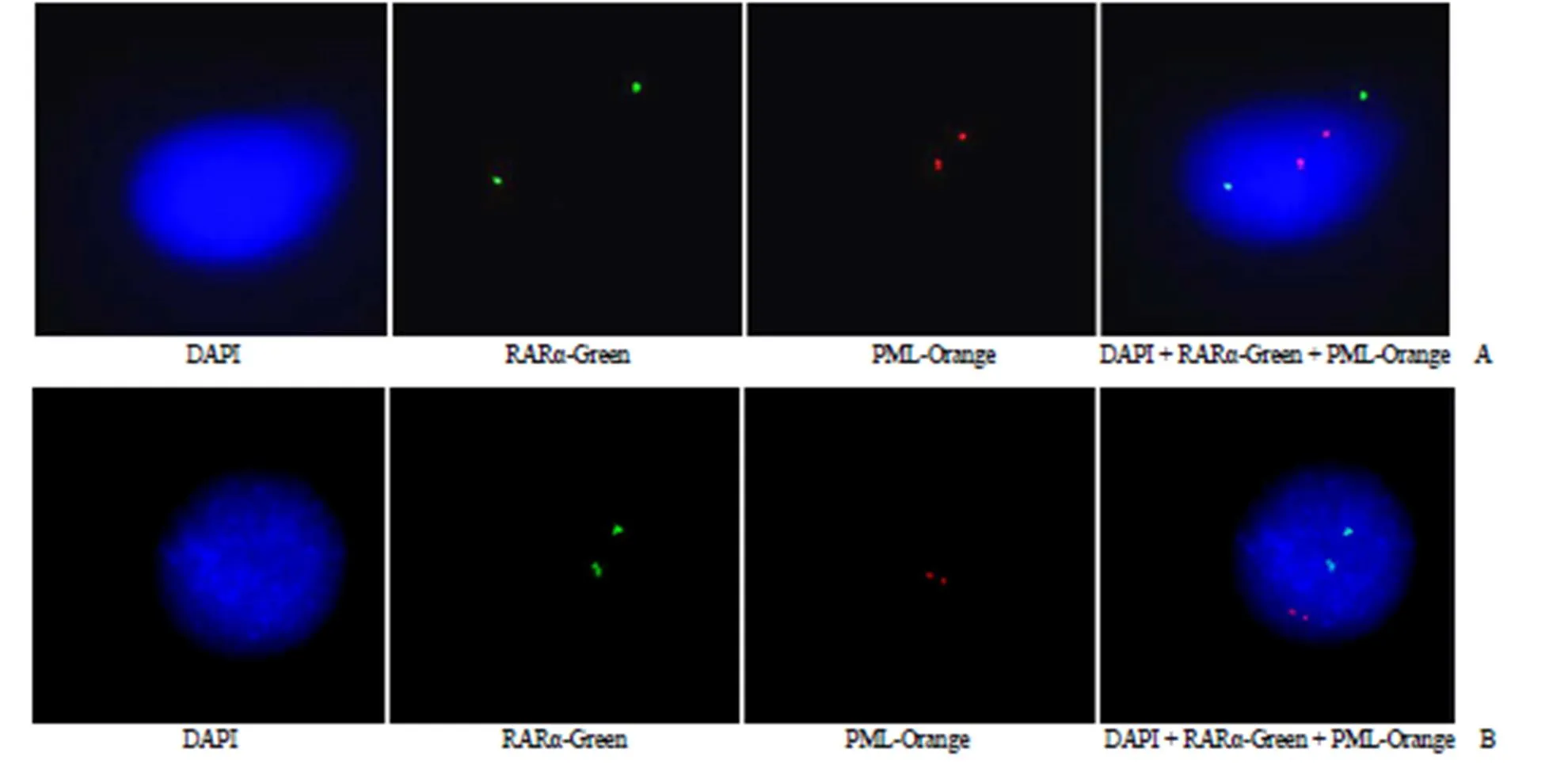
图 3 PML/RARα探针与已知正常人外周血间期细胞杂交(A:自制探针;B:进口探针)
Figure 3 The PML/RARα probes were hybridized with peripheral blood interphase cells of normal human (A: Self-made probes; B: Imported probes)

图 4 PML/RARα 探针与已知正常人外周血中期细胞杂交(A:自制探针;B:进口探针)
Figure 4 The PML/RARα probes were hybridized with peripheral blood metaphase cells of normal human (A: Self-made probes; B: Imported probes)
2.5 自制和进口 FISH 探针的对比研究
通过双盲法检测 37 例临床血液病门诊样本,结果显示自制和进口 FISH 探针均检测到其中相同的 5 例 PML/RARα 易位阳性的样本,两者阴阳性检测结果完全相符。采用 AxioVision Re 1.4.8 软件进行图像分析和测量,在 Spectrum Green 和 Cy3TMv1(PromoFluor-555)通道中,自制探针的平均荧光信号强度比进口探针明显提高(< 0.05),自制探针信噪比分别为进口探针的 2.1 倍和 1.5 倍(图 6)。
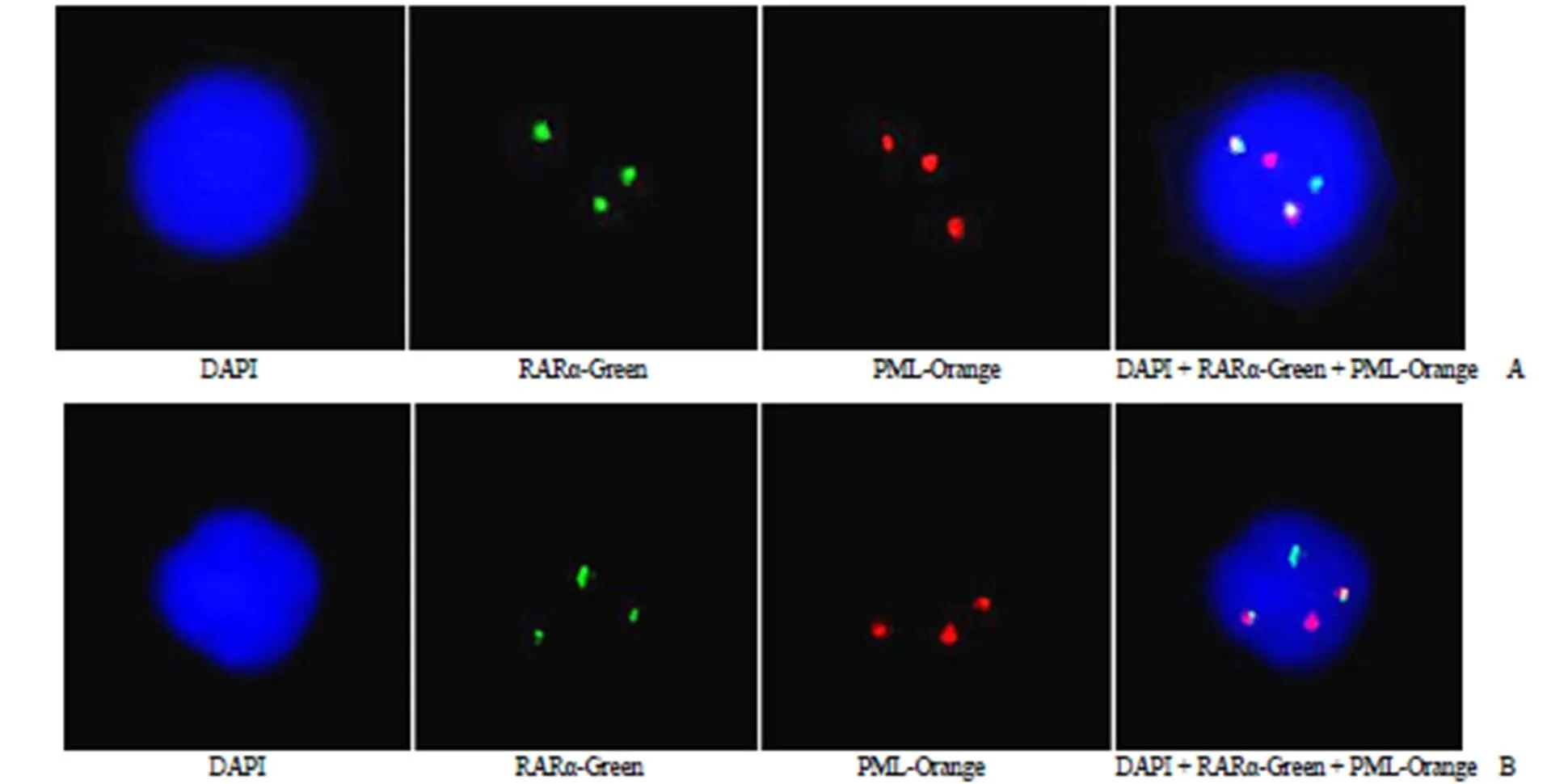
图 5 自制探针(A)和进口探针(B)检测同一例已知 PML/RARα 易位阳性的患者骨髓样本
Figure 5 Self-made probes (A) and imported probe (B) were used to detect bone marrow samples from the same patient with known PML/RARα translocation
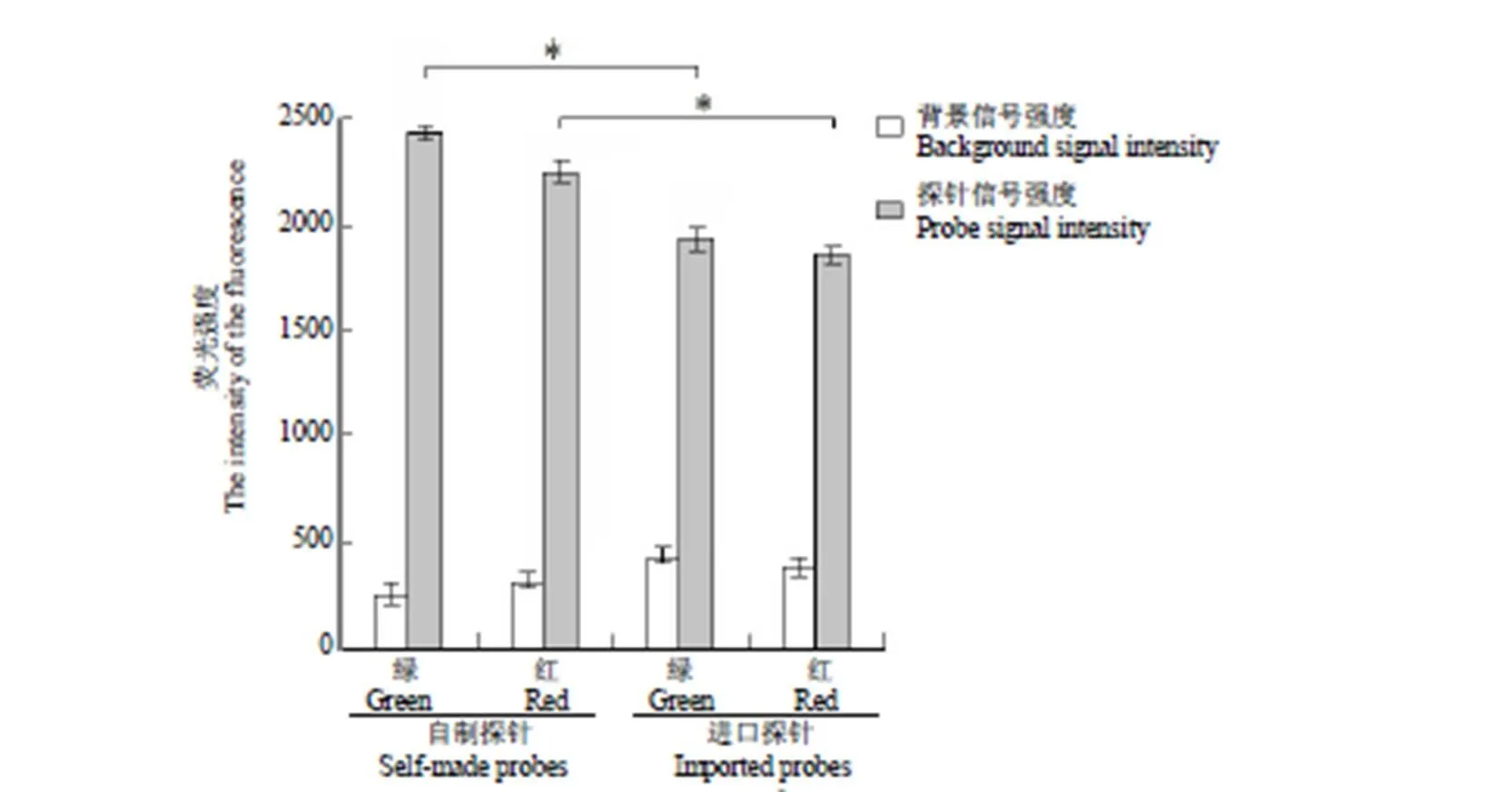
图 6 自制探针与进口探针的信号平均荧光强度和背景强度比较(*P<0.01)
Figure 6 Comparison of average fluorescence intensity and background intensity of self-made and imported probes (*<0.01)
3 讨论
染色体畸变,包括染色体缺失、扩增、重排等是引起血液病的重要发病机制[12]。不同的染色体变异引起不同类型的血液病,其治疗方案及预后结果均有显著的不同。FISH 利用特异性荧光标记探针与标本 DNA 杂交,检测细胞染色体、基因组异常,可应用于细胞分裂中期、间期染色体,检测包括染色体数目、复制和异位等异常,并能发现隐秘异位突变[13],因此已成为血液病精准诊疗以及微小残留病监测中必不可少的分子诊断工具。
目前,国内血液学临床及科研对于血液病 FISH 诊断试剂盒有巨大的需求。但由于大部分产品仍依赖进口,价格昂贵,使得临床和科研应用均受到很大的限制,同时也给患者带来沉重的经济负担。因此,有必要自主开发具有国际先进水平的血液病 FISH 检测试剂盒,以满足国内临床和科研的需要。
本实验自主设计 PML/RARα 基因 FISH 探针,尤其采用多个 BAC 克隆组成的克隆重叠群作为探针,本实验中共含有 14 个 BAC,其中 PML 有 7 个 BAC,长度为 986 kb,RARα 含有 7 个 BAC,长度为 1120 kb(图 1),大大提高了 FISH 杂交荧光信号的强度。同时我们在杂交缓冲液中加入ssDNA、tRNA 和 cot-1 DNA 等试剂封闭基因组中的重复序列,使得非特异性杂交信号显著下降,这些综合措施显著增强了探针信噪比。因此,大幅度增强了 PML/RARα 探针的信号强度及可视性。对 37 例临床血液病样本的检测结果显示,自制和进口 FISH 探针在检测 PML/RARα 染色体重组阴、阳性的结果是完全一致的(图 5)。另外,其他方面的技术指标,如外观、物理性状、荧光淬灭性、冷藏稳定性等也都达到了国外同类产品的标准,表明我们自主研发的 PML/RARα FISH 检测试剂盒达到了国际先进水平,可以替代国外同类品牌产品。
[1] Xiao JW, Xian Y, Guo YX, et al. Rare type of PML/RARα fusion gene in children with acute promyelocytic leukemia: a report of 2 cases. Int J Lab Med, 2015(11):1636-1638. (in Chinese)肖剑文, 宪莹, 郭玉霞, 等. 急性早幼粒细胞白血病患儿PML/RARα融合基因罕见型2例. 国际检验医学杂志, 2015(11): 1636-1638.
[2] Wang JS, Chen ZZ. Treatment of acute promyelocytic leukemia. Med Recapitulate, 2007, 13 (11):838-840. (in Chinese)王杰松, 陈志哲. 急性早幼粒细胞白血病的治疗现状. 医学综述, 2007, 13(11):838-840.
[3] Takayama N, Kizaki M, Hida T, et al. Novel mutation in the PML/RARα chimeric gene exhibits dramatically decreased ligand-binding activity and confers acquired resistance to retinoic acid in acute promyelocytic leukemia. Exp Hematol, 2001, 29(7):864-872.
[4] Zhang P, Lu JM, Li ZP. The application of all trans retinoic acid inchildren with acute promyelocytic leukemia. J Pediatr Pharm, 2014, 20(12):55-57. (in Chinese)张萍, 卢金淼, 李智平. 全反式维甲酸在儿童急性早幼粒细胞白血病中的应用. 儿科药学杂志, 2014, 20(12):55-57.
[5] Lallemand-Breitenbach V, Zhu J, Chen Z, et al. Curing APL through PML/RARΑ degradation by As2O3. Trends Mole Med, 2012, 18(1): 36-42.
[6] Chen A, Jia P, Li C, et al. The effect of As2O3and ATRA on the PML/RARΑ gene in myeloid leukemia cell NB4. Med J West China, 2013, 25(8):1140-1142, 1145. (in Chinese)陈艾, 贾鹏, 李程, 等. 三氧化二砷及全反式维甲酸对白血病NB4细胞PML/RARA融合基因的影响. 西部医学, 2013, 25(8):1140- 1142, 1145.
[7] Li CW, Liu SH, Bo LJ, et al. The application of fluorescence in situ hybridization in the diagnosis of acute promyelocytic leukemia. ChinJ Hematol, 2004, 25(6):346-350. (in Chinese)李承文, 刘世和, 薄丽津, 等. 荧光原位杂交技术在急性早幼粒细胞白血病诊断中的应用. 中华血液学杂志, 2004, 25(6):346-350.
[8] Lewis C, Patel V, Abhyankar S, et al. Microgranular variant of acute promyelocytic leukemia with normal conventional cytogenetics, negative PML/RARA FISH and positive PML/RARA transcripts by RT-PCR. Cancer Genet, 2011, 204(9):522-523.
[9] Zhang ZN, Shen T. Diagnostic and therapeutic standards for hematopathy. 2nd ed. Beijing: Science Press, 1998:228-236. (in Chinese)张之南, 沈悌. 血液病诊断及疗效标准. 2版. 北京: 科学出版社, 1998:228-236.
[10] O'Connor M, Peifer M, Bender W. Construction of large DNA segments in Escherichia coli. Science, 1989, 244(4910):1307-1312.
[11] Zhang S, Y Shao, G Hou, et al. QM-FISH analysis of the genes involved in the G1/S checkpoint signaling pathway in triple-negative breast cancer. Tumour Biol, 2014, 35(3):1847-1854.
[12] Nasr R, de Thé H. Eradication of acute promyelocytic leukemia-initiating cells by PML/RARA-targeting. Int J Hematol, 2010, 91(5):742-747.
[13] Soszynska K, B Mucha, R Debski, et al. The application of conventional cytogenetics, FISH, and RT-PCR to detect genetic changes in 70 children with ALL. Ann Hematol, 2008, 87(12):991- 1002.
Development of FISH diagnostic kit for detection of PML/RARα fusion gene in leukemia
MIAO Wei-min, SHI Lin, HU Lin-ping, LI Juan, LIU Yun, LI Cheng-wen, LI Si-qi, DU Hong-wei, WANG Zheng-yu
Author Affiliations: Stem Cell and Gene Bioengineering Co. Ltd., Tianjin 300084, China (MIAO Wei-min, SHI Lin, LI Juan, LIU Yun, LI Si-qi, DU Hong-wei); Institute of Hematologyand Blood Disease Hospital, Chinese Academy of Medical Sciences, Tianjin 300020, China (MIAO Wei-min, HU Lin-ping, LI Cheng-wen, WANG Zheng-yu); Tianjin Key Laboratory of Blood Cell Therapy and Technology, Tianjin 300084, China (SHI Lin, LI Juan, LIU Yun, LI Si-qi, DU Hong-wei, WANG Zheng-yu)
To develop a dual-colour FISH kit for detecting the leukemia PML/RARα fusion gene.
Based on the chromosome and gene map, corresponding BAC clone contigs were selected as PML and RARα FISH probes located on chromosome 15q22 and 17q21 respectively. The PML FISH and RARα probes were labeled with red and green fluorophores, respectively. The self-developed FISH kit and the commercial imported one were compared in terms of multiple technical parameters detected by double blind studies of 37 cases of clinical hematological samples.
The detection results were consistent between the self-developed FISH kit and the commercial imported one with respect to detecting PML/RARα gene translocation. The self-developed probes were comparable to the commercial imported FISH probes in terms of multiple technical parameters, such as appearance, physical characteristics, fluorencence quench and stability at cold storage. Furthermore, the self-developed probes possessed stronger fluorescence signal intensities and better signal noise ratios than the imported probes did.
The FISH diagnostic kit developed in this work could serve as a domestic replacement for the expensive imported products.
Leukemia; Translocation, genetic; In situ hybridization, fluorescence; PML/RARα fusion gene
MIAO Wei-min, Email: miaow@ihcams.ac.cn
国家自然科学基金(81400150、81370598);天津市科委项目(14ZCDZSY00176);中国医学科学院医学与健康科技创新工程项目(2016-12M-1-017)
缪为民,Email:miaow@ihcams.ac.cn
2018-01-29
10.3969/j.issn.1673-713X.2018.03.005
