大鼠乳腺增生模型造模要素及中医药防治数据挖掘研究
2018-06-13梁源胡凤娇王张孙位军
梁源,胡凤娇,王张,孙位军
乳腺增生常见于25-40岁的中青年妇女[1],随着生活节奏加快、社会压力增大及受生育率下降的影响,其发病率逐年增高且占乳房疾病的75%[2]。由不良精神刺激等因素引发,导致内分泌功能紊乱,雌孕激素比例失衡[3]。在药物治疗上,最常用他莫昔芬,但副作用大,长期服用易致月经不调、闭经等不良反应。与西药相比,中药能从多方面、多层次作用于乳腺及肝脾肾组织且安全性较高。
目前乳腺增生造模方法多样,但各文献报道的造模注射部位、周期、剂量及成功率参差不齐,又因造模耗时长,故模型复制效率不高。故本文对国内20多年来应用雌性大鼠制造乳腺增生模型的造模要素及其中医药防治的实验研究结果进行数据挖掘和分析,可精准把握造模要素,提高造模的成功率,对乳腺增生的有效性评价具有一定的参考和指导价值。
1 材料
在中国知识基础设施工程(CNKI)中,以大鼠和乳腺增生为关键词,收集1989年-2016年期间(27年)的相关文献202篇。
2 方法
2.1 信息录入
应用Excel软件,录入文章题目、造模情况(造模工具药名称、给予天数、注射剂量及部位、评价指标)、阳性对照药、受试药物情况(药物名称、给药时间、作用机制指标)等信息。
2.2 数据库构建
制作《大鼠乳腺增生模型的造模要素挖掘数据表》。
2.3 统计和分析
对录入的每项数据进行统计和分析,定量归纳造模要素。
3 结果
3.1 动物
SD或Wistar雌性未孕大鼠,SPF级,体重200±22 g,9-11周龄。
3.2 造模
3.2.1 造模参数 详见表1。造模试剂:常见的有苯甲酸雌二醇联合黄体酮、苯甲酸雌二醇、己烯雌酚注射液联合黄体酮、雌三醇、雌三醇联合四氯化碳、己烯雌酚注射液、戊酸雌二醇、摘除两侧卵巢后注射苯甲酸雌二醇,导致动物内分泌功能紊乱,雌孕激素比例失衡,亦有用束缚和强迫游泳方法模拟中医所谓“肝郁气滞”病机,亦有造模试剂和强迫游泳同时使用的方法。其中以苯甲酸雌二醇联合黄体酮最常使用,该方法重复性和稳定性好,其次是苯甲酸雌二醇(单用),再次是己烯雌酚注射液联合黄体酮。
注射剂量:苯甲酸雌二醇联合黄体酮的注射剂量配比最常见为0.5 mg·kg-1+4 mg·kg-1,其次为0.5 mg·kg-1+5 mg·kg-1;苯甲酸雌二醇(单用)注射剂量最常见为0.5 mg·kg-1;己烯雌酚注射液联合黄体酮的注射剂量配比最常见为0.5 mg·kg-1+4 mg·kg-1。
造模天数:造模时间都比较长(30±9天)。苯甲酸雌二醇联合黄体酮的造模方式是先注射苯甲酸雌二醇,其后注射黄体酮,最常见的时间组合分别为25 d+5 d,其次为20 d+5 d;苯甲酸雌二醇(单用)最常见的时间为30d;己烯雌酚注射液联合黄体酮最常见的时间组合为25 d+5 d。
造模次数:最常见为1次/天注射造模;其次为1次/2天。
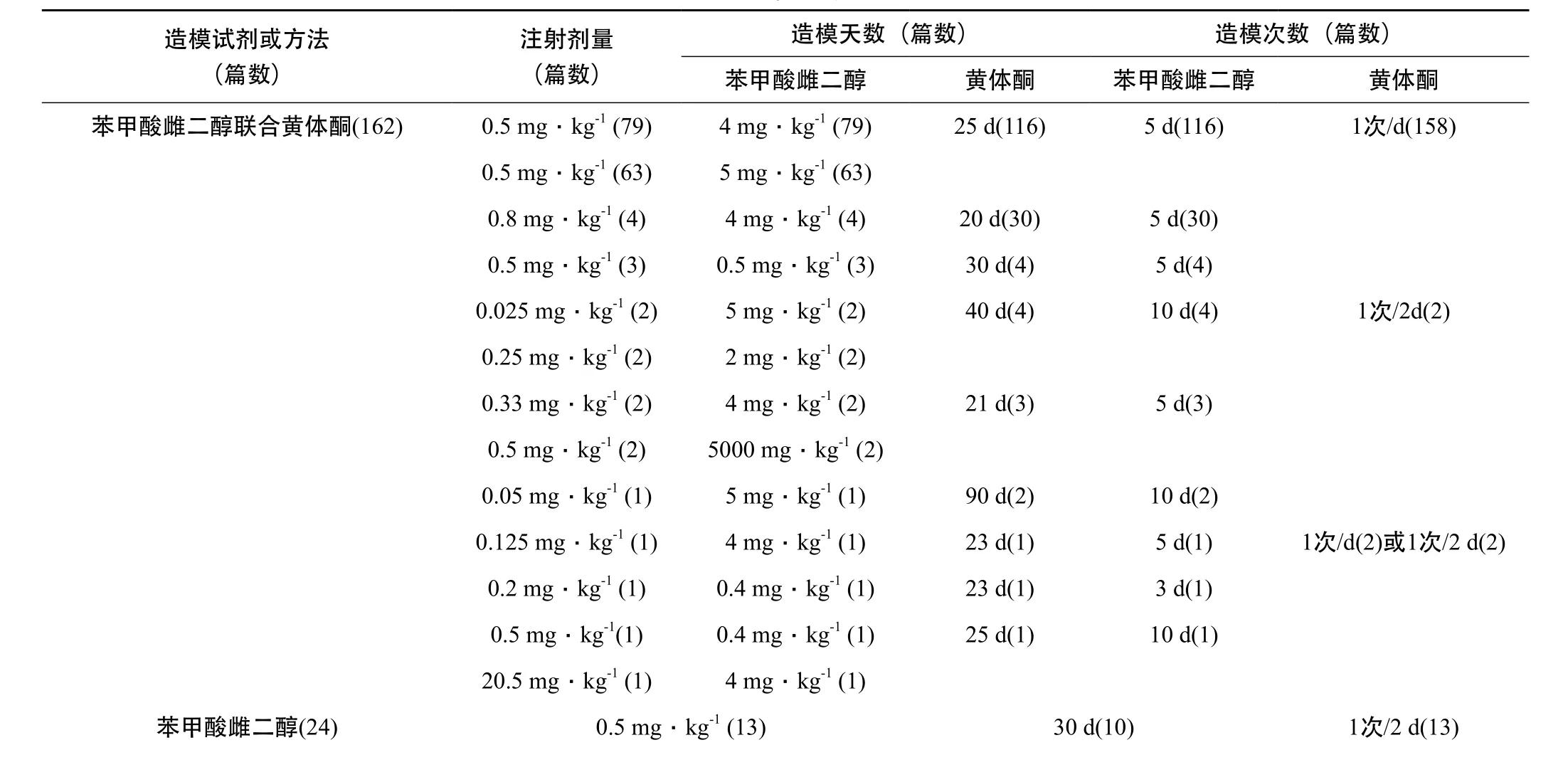
表1 造模参数统计表

0.3 mg·kg-1 (3) 28 d(5)0.8 mg·kg-1 (3) 20 d(4)0.6 mg·kg-1 (2) 21 d(1) 1次/d(10)10 mg·kg-1 (1) 22 d(1)0.05 mg·kg-1(1) 42 d(1) 1次/2 d(1)0.1 mg·kg-1 (1) 49 d(1)文献未写明(1) 60 d(1)己烯雌酚注射液联合黄体酮(8) 己烯雌酚0.5 mg·kg-1 (8)黄体酮4 mg·kg-1 (8) 己烯雌酚25 d(8) 黄体酮5 d(8) 1次/d(8)雌三醇(1) 1 mg·kg-1 (1) 30 d(1) 1次/2 d(1)雌三醇联合四氯化碳(1) 雌三醇0.1/只(1) 四氯化碳0.005 mL·g-1(1) 雌三醇2次/d 28 d(1) 四氯化碳1次/7 d己烯雌酚注射液(1) 20 mg·kg-1 (1) 20 d(1) 1次/2 d(1)戊酸雌二醇(1) 0.4 mg·kg-1 (1) 20 d(1) 1次/2 d(1)摘除两侧卵巢后注射苯甲酸雌二醇(1) 0.3 mg·kg-1 (1) 15 d(1) 1次/d(1)不定时强迫游泳5min后注射苯甲酸雌二醇、不定时强迫游泳5min后注射黄体酮(1)苯甲酸雌二醇0.5 mg·kg-1 (1)黄体酮0.5 mg·kg-1 (1)苯甲酸雌二醇21 d(1)黄体酮5 d(1) 1次/d(1)连续、不定时的强迫游泳5-10 min(1) —— 30 d(1) 5次/6 d(1)束缚和强迫游泳(1) —— 30 d(1) 1次/d(1)
3.2.2 注射方式 包括肌肉注射(154篇,占比77.4%)、腹腔注射(35篇,占比17.6%)和皮下注射(10篇,占比5.0%)。
3.2.3 血清中指标 详见表2。造模后血清中的E2、PRL、FSH上升,P、T下降,LH无显著性变化。MDA、VEGF、bFGF、ACTH、TC、TG、CORT、LDL-C、ER、PR、p53、Oct4、GnRH、5-HT、aFas、TNF-a均上升,SOD、CD3+、CD4+、CD8+、IL-2、TAC均下降,HDL-C、T3、T4无显著性变化。当体内雌激素水平绝对或相对增加,孕激素水平呈绝对或相对减少时,乳腺受到雌激素的长期刺激,导致乳腺导管和小叶增生,同时促进组织水、钠潴留,进一步引起小叶间质水肿[4]且乳腺实质由于缺乏孕激素的调节和保护而增生过度和复旧不全,从而引起乳腺导管上皮和纤维组织不同程度的增生和末梢腺管或腺泡形成囊肿,该病的发生即是以这种增生和复旧的紊乱为基础的[5]。有研究显示,VEGF和bFGF被认为是乳腺癌特异性最强的两种血管因子,且在炎性乳腺癌细胞中VEGF和COX-2的表达显著高于正常乳腺细胞[6~7]。

表2 大鼠乳腺增生模型血清中测试指标及其变化情况
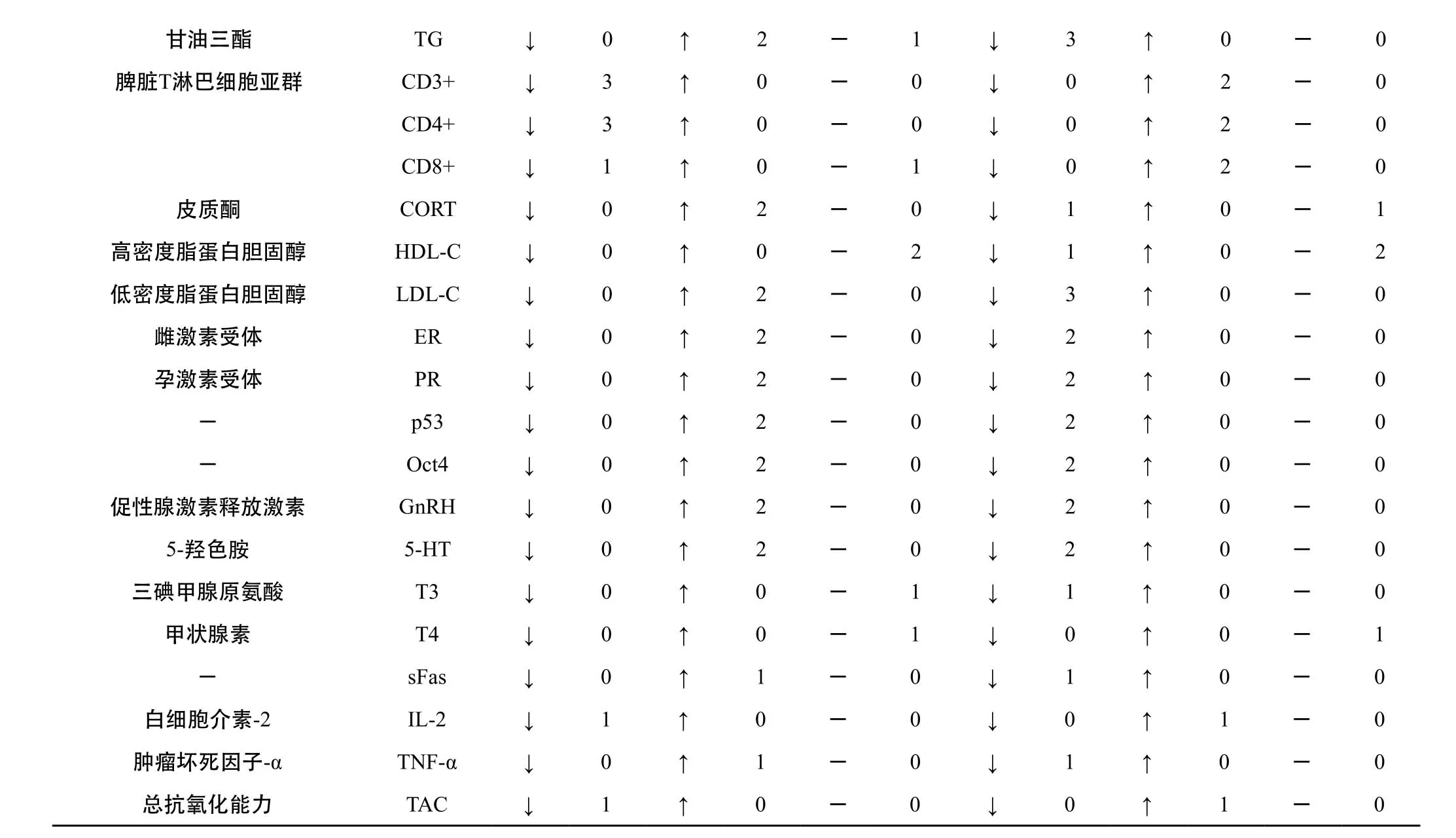
注:↓、↑、-分别表示明显下降、明显上升、无明显变化,后同。
3.2.4 乳腺组织指标 详见表3-7。基于Elisa、IHC(免疫组化)、Western blot和RT-PCR等方法的研究结果表明,E2、ER、PR、VEGF、bFGF、ERα、PCNA、MTS、collagen-Ⅰ、α-SMA、fibronectin、FasL、ERK、eNOS、GnRH、GnRH-R、bax、NFkB-p65、COX-2、AR、C-erbB-2、PGR、PRLR、PCNA、JNK、AKT、p53、Oct4、AP-2α、TGF-β1、miR-21端粒酶均上升,Fas、miR-29a/b均下降,FⅧ无明显变化。ER、PR的过量表达可使乳腺增生、乳腺癌的发生及发展加剧,ER信号对乳腺的生长、发育及细胞凋亡有调控效应的作用[8~9]。

表3 乳腺增生动物模型乳腺组织中测试的指标(Elisa法)

表4 乳腺增生动物模型乳腺组织中测试的指标(IHC法)

Ⅰ型胶原 collagen-Ⅰ ↓ 0 ↑ 1 - 0 ↓ 1 ↑ 0 - 0 α-平滑肌肌动蛋白 α-SMA ↓ 0 ↑ 1 - 0 ↓ 1 ↑ 0 - 0纤维连接蛋白 fibronectin ↓ 0 ↑ 1 - 0 ↓ 1 ↑ 0 - 0上皮细胞钙粘蛋白 E-cadherin ↓ 1 ↑ 0 - 0 ↓ 0 ↑ 1 - 0-Fas ↓1↑0-0↓0↑1-0-FasL ↓0↑1-0↓1↑0-0细胞外信号调节激酶 ERK ↓ 0 ↑ 1 - 0 ↓ 1 ↑ 0 - 0内皮型一氧化氮合酶 eNOS ↓ 0 ↑ 1 - 0 ↓ 1 ↑ 0 - 0促性腺激素释放激素受体 GnRHR ↓ 0 ↑ 1 - 0 ↓ 1 ↑ 0 - 0-FⅧ ↓0↑0- 1↓0↑0- 0细胞凋亡促进因子 bax ↓ 0 ↑ 1 - 0 ↓ 1 ↑ 0 - 0-NFkB-p65↓0↑1-0↓1↑0-0环氧合酶-2 COX-2 ↓ 0 ↑ 1 - 0 ↓ 1 ↑ 0 - 0雄激素受体 AR ↓ 0 ↑ 1 - 0 ↓ 1 ↑ 0 - 0-C-erbB-2↓0↑1-0↓1↑0-0
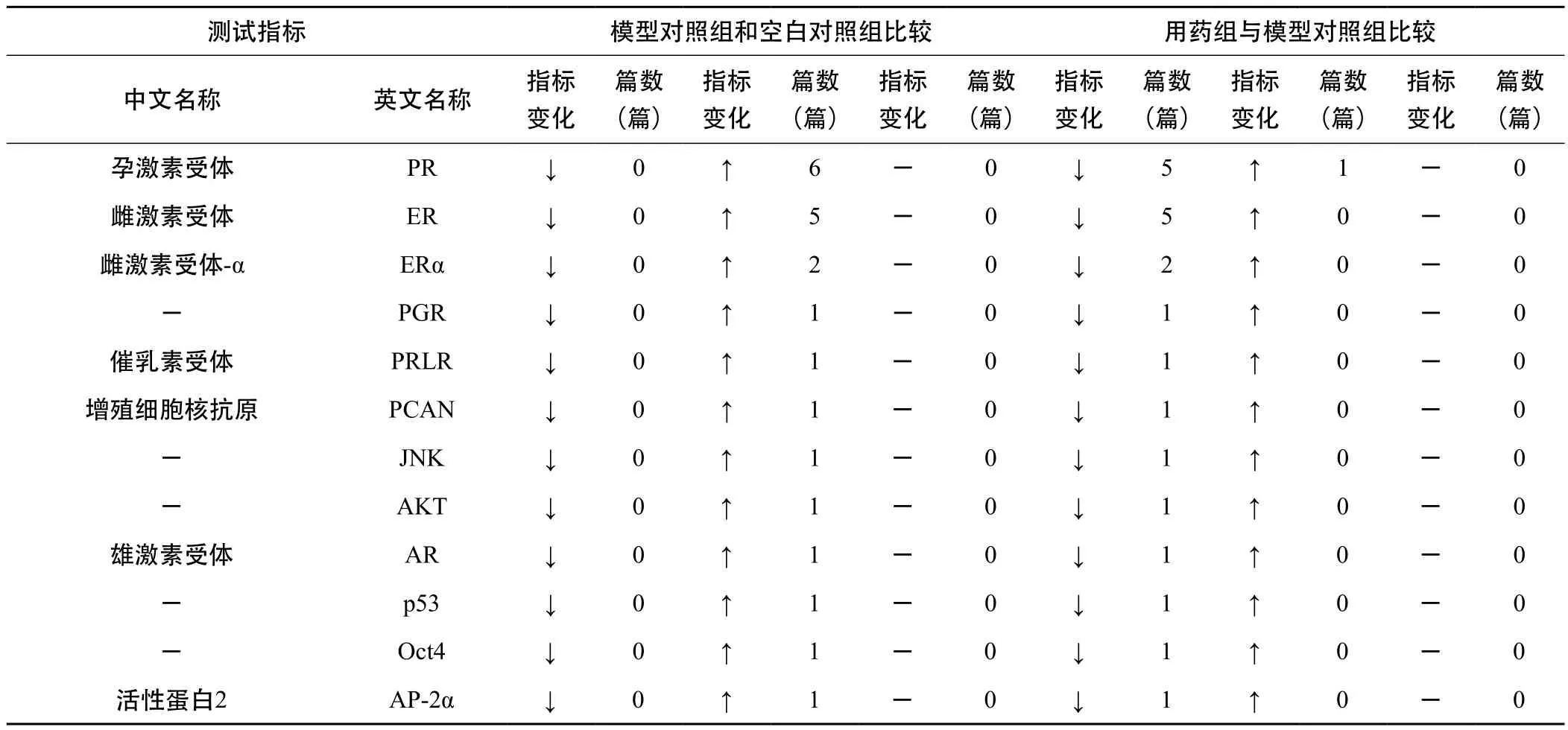
表5 乳腺增生动物模型乳腺组织中测试的指标(Western blot法)

表6 乳腺增生动物模型乳腺组织中测试的指标(原位杂交法)
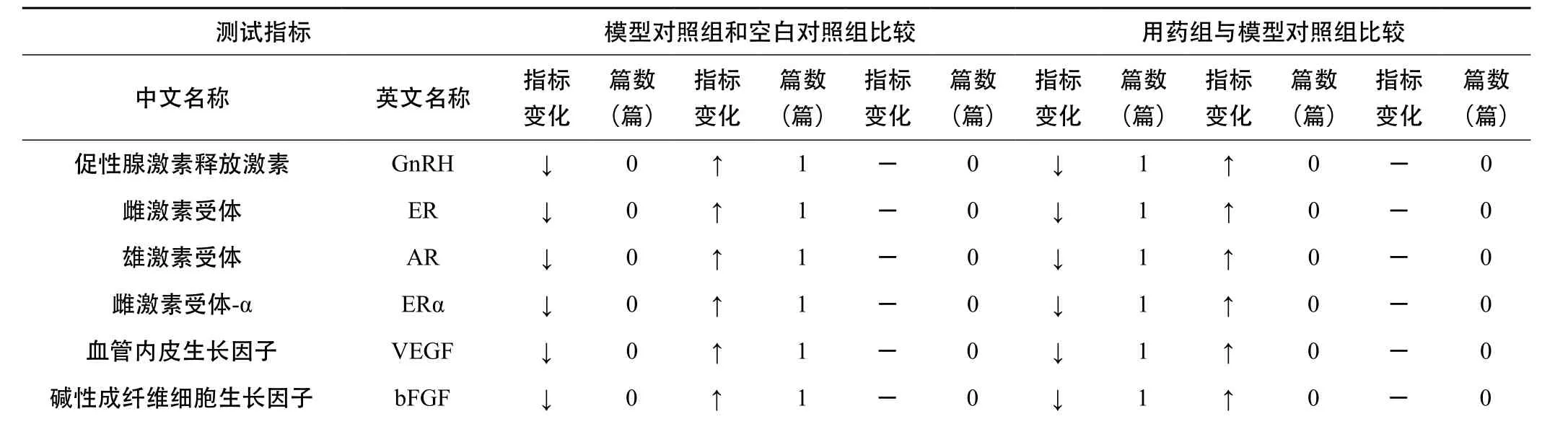
表7 乳腺增生动物模型乳腺组织中测试的指标(荧光定量PCR法)
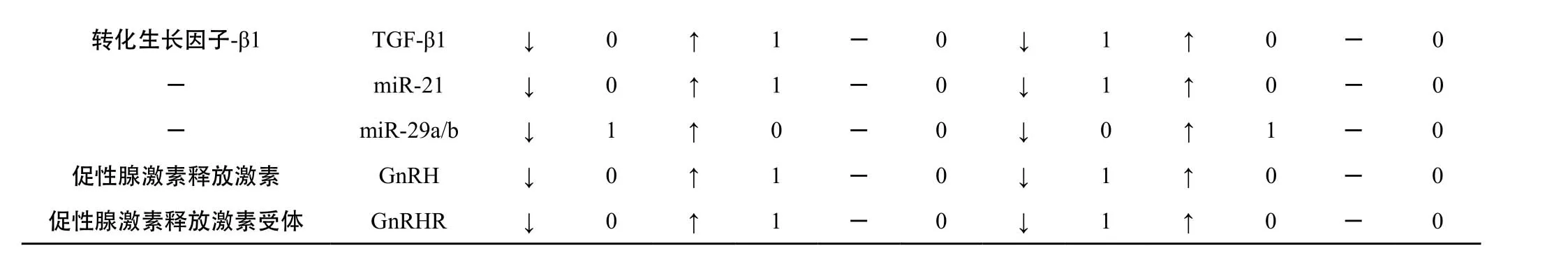
转化生长因子-β1 TGF-β1 ↓ 0 ↑ 1 - 0 ↓ 1 ↑ 0 - 0-miR-21↓0↑1-0↓1↑0-0-miR-29a/b↓1↑0-0↓0↑1-0促性腺激素释放激素 GnRH ↓ 0 ↑ 1 - 0 ↓ 1 ↑ 0 - 0促性腺激素释放激素受体 GnRHR ↓ 0 ↑ 1 - 0 ↓ 1 ↑ 0 - 0
3.2.5 乳腺组织的病理变化 乳腺导管扩张伴微囊形成且分枝增多,导管壁略有增厚,周围纤维组织增生明显,细胞较为活跃,间质有少量以小淋巴细胞为主的炎性细胞浸润,管腔内可见脱落的上皮细胞及大量分泌物,上皮细胞多层,皮肤基底细胞增生成团块状;乳腺小叶单位数目增多密集,小叶形态欠规则,叶内腺泡增多;腺泡大小不等,数目增多,形态不规则,甚至变形,部分结构混乱,可见融合倾向,上皮细胞呈高柱状形成复层或乳头状突起,排列比较疏松,大小变化明显,局灶性实性巢状增生,腺泡内有粉色渗出物,腺泡间结缔组织减少,以至于腺体呈“背靠背”现象。小叶和腺泡间质纤维组织增多。也可根据导管、腺泡和小叶的病变程度进行分级,以期定量参考。
3.2.6 观察指标
3.2.3.1 乳头形态学变化 肉眼观察大多数大鼠乳房直径和乳头高度均增大,乳头接近大米粒大小且突出皮毛,脱毛后可见红肿,颜色暗红,触之较硬且坚挺,部分伴有乳晕形成。
3.2.3.2 大鼠行为学变化 大鼠竖毛,皮毛欠光泽,脱毛、精神不振、易激惹,反应迟钝,食量减少或亢进,粪便时稀软,身体严重消瘦或体重增长迅速,进食、排便、活动减少或增加。神情痴呆,郁郁寡欢。
3.2.7 其他指标 脏器系数(胸腺、脾脏、子宫和卵巢)和血液流变学。
3.3 药物防治
3.3.1 给药方案 采用治疗性给药的方式(136篇,占比64.59%),即造模完成后再给药治疗;预防性给药的方式(59篇,占比28.23%)包括造模同时给药(44篇,占比21.05%)和造模中期给药(15篇,占比7.18%)。给药方式为灌胃给药,给药周期为29±13天,与临床长期给药的情况类似。
3.3.2 阳性对照药主要为他莫昔芬,中药制剂主要有乳癖消、乳康片、乳增宁等。他莫昔芬是一种非甾体类的抗雌激素药物,其作用机制为与E2竞争靶细胞(ER),形成稳定复合物,降低E2与靶细胞结合,进而降低E2的生物学效应[10~11]。西药起效快、效果稳定,但不良反应多。中药见效缓慢,作用机制不清但安全性高。
3.3.3中药复方 202篇文章中使用中药复方150个,如健乳宁[12]、复方美登木片[13]、回乳抑增一号[14]、乳结平胶囊[15]、西黄丸[16]、消瘀通络散[17]、M-Ⅰ号[9]、桂枝茯苓胶囊[18]、回阳玉龙膏[19]和抗乳增片[20]等。
3.3.4 常用中药材 150个中药复方中共涉及中药材170种,常见者依次为(括号内为使用频率)柴胡(31.03%),当归(28.08%),香附(2 4.6 3%),丹参(1 5.2 7%),白芍(14.78%),鹿角(13.79%),郁金(12.81%),延胡索(11.33%),夏枯草(10.84%),浙贝母(10.84%),莪术(10.34%),茯苓(10.34%),青皮(9.85%)等。
3.3.5 有效性评价指标 经药物干预后,血清中E2、PRL、FSH、MDA、VEGF、bFGF、ACTH、TC、TG、CORT、LDL-C、ER、PR、p53、Oct4、GnRH、5-HT、T3等均下降,P、T、SOD、CD3+、CD4+、CD8+、sFas等均升高,LH、FSH、HDL-C、T4无明显变化。均有利于防治乳腺增生的形成。
3.3.6 乳腺组织病理学 经药物干预后,大多数乳腺导管细长且分枝少,腔内残留少许分泌物,上皮细胞呈立方形且层数减少,管腔扩张减轻。小叶数量及结节减少,体积减小。腺泡恢复正常且数量减少,直径、体积减小,分布均匀,腺泡扩张被明显压制,腺腔内有少量或无分泌现象,上皮细胞为单层立方上皮。间质纤维结缔组织增生明显减轻。部分可接近正常的乳腺腺泡结构。
3.3.7 作用机制指标 经药物干预后,乳腺组织中ER、ERα、PR、AR、VEGF、bFGF、p16、p53、Oct4、FasL、端粒酶、ERK、eNOS、GnRH、GnRHR、bax、NFkB-p65、COX-2、C-erbB-2、AP-2α、TGF-β1、miR-21等均下降,Fas、miR-29a/b等均上升。
4 讨论
现代医学研究表明,乳腺增生与内分泌紊乱、卵巢功能失调及血管内皮因子有关,其发病机制可能为通过神经内分泌网络系统综合调节下丘脑-垂体-卵巢轴和下丘脑-垂体-肾上腺轴[21]。评价指标主要涵盖内分泌激素、肝脾肾功能及各类因子等方面,因此,治疗乳腺增生病的关键是恢复内分泌网络系统的正常功能,防止乳腺增生。
中医则从肝脾肾论治乳腺增生症。乳腺增生属于“乳癖”、“乳中结核”范畴且与精神因素有关。本病发病之本为肝、脾、肾不足,表现为肝郁气滞而血行不畅、冲任失调、肝肾不足及思虑伤脾而痰浊内生互阻伤乳络[14,22]。王雪压[23]的乳核散结汤是依据行气解郁,活血通络,软坚散结的功效组方而成。吴旭辉[24]以乳腺Ⅰ号治疗冲任失调型乳腺增生,而苏东玮[25]以桂枝茯苓胶囊治疗痰凝血瘀型乳腺增生症,均有好的疗效。对乳房的生理病理影响最大的是肝的藏血与疏调气机[26]。本文挖掘的上述常用中药材均归肝经,可有效的治疗肝失疏泄,气机郁阻所致的胁痛、情志抑郁等症,常配伍疏肝行气药;亦可治疗肝郁血虚,脾失健运,妇女月经不调,乳房胀痛等,常配伍养血柔肝键脾药。
[1]李才,任立群.病理模型与实验病理学[M].北京:人民卫生出版社,2008:462.
[2]王玉兰.健康知识教育联合生活习惯护理在体检发现乳腺增生患者护理中的应用价值[J].西部中医药,2014,27(2):122.
[3]王雄,吴金虎,陈永刚,等.回乳抑增Ⅰ号对实验性乳腺增生大鼠的作用及其机制研究[J].中国实验方剂学杂志,2013,19(13):274.
[4]周朝晖,刘鸿雁,安晓芳,等.安乳消痛丸对乳腺增生模型大鼠的影响[J].西部中医药,2016,29(4):26.
[5]杨素清,王玉玺.消核止痛饮对乳腺增生病性激素调节作用的临床研究[J].中医药信息,2004,21(2):52.
[6]Hu De ,fan.tp.suppression of vegf induced angiogenesis by the proteintyrosine kinase lavendustin a.br J pharmacol,1995,114:262.
[7]Bir SC, Kolluru GK, Fang K, et al.Redox balance dynamic ally regulates vascular growth and remodeling.Semin Cell Dev Biol, 2012, 23:745.
[8]林妮,邱玉文,何贡云,等.荔枝核皂苷对大鼠乳腺增生的作用及对雌激素信号通路的影响[J].中药材,2015,38(4):798.
[9]王忠超,李敏,张彬,等.蒙药乳腺-Ⅰ号对乳腺增生大鼠抗氧化能力、乳腺组织雌激素受体和孕激素受体表达的影响[J].吉林大学学报(医学版),2012,38(6):1052.
[10]刘一飞.蒙药那木达奇对大鼠乳腺増生模型的药效学实验研究[D].内蒙古:内蒙古民族大学,2013.
[11]洪和平,程伏林.三苯氧胺不同用药方法治疗乳腺腺病[J].中国综合临床,2004,20(1):59.
[12]韦永芳,黄霖,杨辉,等.健乳灵治疗大鼠乳腺增生的病理观察[J].广州医学院学报,2005,33(1):33.
[13]余成浩,李文军,王帅,等.复方美登木片防治大鼠乳腺增生的研究[J].中药药理与临床,2012,28(2):137.
[14]郭皓,吴金虎,陈永刚,等.复方”回乳抑增一号”治疗乳腺增生病的组方优化[J].中国实验方剂学杂志,2015,21(19):133.
[15]胡建楣,陈凤仪.乳结平胶囊对治疗大鼠乳腺增生病雌激素作用的实验研究[J].中药材,2008,31(10):1554.
[16]陈洁.西黄丸治疗大鼠乳腺增生病的实验研究及作用机理探讨[D].吉林:延边大学医学部,2007.
[17]张拴成,肖红玲,王丽娜,等.消瘀通络散对乳腺增生大鼠乳头的动态变化、血清雌二醇、雌激素受体表达水平及病理组织形态的影响[J].浙江中医药大学学报,2012,36(4):417.
[18]朱萱萱,张忠华,邱召娟,等.桂枝茯苓胶囊治疗乳腺增生大鼠的实验研究[J].现代中西医结合杂志,2006,15(5):571.
[19]彭成浩,刘国文,杨俊省.回阳玉龙膏对乳腺增生大鼠的治疗作用[J].中国肿瘤外科杂志,2013,5(6):371.
[20]周会,龙子江,王靓,等.抗乳增片对乳腺增生模型大鼠脏器系数及乳腺组织ER、PR表达的影响[J].实用中医内科杂志,2009,23(8):22.
[21]宋婷,童钟,李中平,等.四逆散、二仙汤及其合剂对慢性应激合并乳腺增生模型大鼠的影响[J].南京中医药大学学报,2014,30(1):57.
[22]王灿,苗明三.乳络通胶囊对大鼠乳腺增生模型的影响[J].中药药理与临床,2014,30(2):128.
[23]王雪压.乳核散结汤治疗女性乳腺增生病65例[J].湖北中医杂志,2012,34(6): 37.
[24]吴旭辉,邱霞,李亚玲.乳腺Ⅰ号治疗乳腺增生病160例[J].中国中医药科技,2011,18(3):255.
[25]苏东玮,盛湲,施俊义.桂枝茯苓胶囊治疗乳腺囊性增生病疗效观察[J].现代中西医结合杂志,2010,19(2):192.
[26]吴惠燕.当归芍药散加味对乳腺增生大鼠ERK基因表达的影响研究[D].福建:福建中医药大学,2015.
