二氢丹参酮Ⅰ联合氨苄西林对生物膜阳性MRSE耐药基因表达的影响
2018-06-13易玉玲雍江堰祖瑞铃李燕
易玉玲,雍江堰,祖瑞铃,李燕
临床难治的耐甲氧西林表皮葡萄球菌(methicillin resistant S.epidermidis,MRSE)主要耐药机制与mecA基因编码产生的新青霉素结合蛋白2a(penicillin binding protein 2a,PBP2a)有关,且具有生物膜形成能力的MRSE可能会因为生物膜内营养供给、氧浓度、渗透压等内环境的改变,导致其耐药基因被激活或发生基因水平的转移,造成耐药增强而增加临床治疗难度[1~2]。因此,研究可以抑制生物膜阳性MRSE的药物或方法十分必要。
已有研究表明中药及其活性单体成分与抗生素联用后对细菌生物膜的抑制作用增强,并且可能会逆转MRS的耐药性[3]。活血化瘀药物丹参,其有效成分丹参酮类化合物具有抗菌、抗炎作用,但目前研究其抑制生物膜的临床研究和应用较少。在本课题组前期实验中,我们发现二氢丹参酮与氨苄西林联用能协同抑制MRSE浮游菌与生物膜细菌,故本研究以MRSE耐药基因为靶点,研究药物对生物膜阳性的MRSE mecA、PBP2a表达的影响,初步探讨丹参活性单体与抗生素联用对MRSE耐药逆转的可能性,为防治生物膜阳性MRSE感染寻找新的思路。
1 材料与方法
1.1 材料
1.1.1 实验菌株 SE生物膜阳性参考菌株SE1457(复旦大学瞿涤教授惠赠),生物膜阳性临床菌株SE15569、SE21021、SE21306、SE26508和SE30291[4~5]:经鉴定均对苯唑西林耐药,即苯唑西林对每株菌的 MIC≥ 4 µg·mL-1,判断为MRSE。
1.1.2 主要试剂、药物及仪器 二氢丹参酮Ⅰ对照品(成都普菲德生物技术有限公司);氨苄西林标准品(中国食品药品检定研究院)。MHB、TSB培养基(青岛海博生物科技有限公司);细胞增殖及细胞毒性测试试剂盒XTT(南京凯基生物科技发展有限公司);Trizol Reagent(Invitrogen);M-MLV First Strand cDNA Synthesis Kit(Omega);TransStart Green qPCR SuperMIX(北京全式金公司)。PCR仪(BIO-RAD);酶标仪(上海科华实验系统有限公司);微量核酸蛋白分析仪(THERMO);荧光定量PCR仪(德国耶拿公司)。
1.2 方法
1.2.1 MRSE临床菌株中mecA阳性株的筛选
1.2.1.1 引物设计 NCBI查询SE mecA基因的序列并设计引物,由上海生工合成,引物扩增序列和产物片段大小见表1。

表1 mecA基因特异性引物序列
1.2.1.2 MecA基因的扩增 将5株MRSE临床菌株于血平板上复苏,挑取SE菌落于LB培养基中,37℃振荡培养过夜。吸取菌液于无菌EP管中,离心后弃上清,加入适量TE溶液,强烈振荡洗涤菌体,离心后收集菌体。加入TE溶液悬浮菌体,加入溶菌酶至终浓度2 µg·mL-1,充分混匀,37℃孵育后,加入10%SDS溶液于37℃裂解,然后加入蛋白酶K于70℃消化,100℃煮沸后离心,收集上清液即为DNA模板。
PCR反应按照博迈德2×Taq PCR MasterMix说明书进行操作。 PCR反应条件设置:94℃预变性3 min,94℃变性30s,52℃退火30 min,72℃延伸30 s,共30个循环,72℃继续反应5 min。PCR产物经2%琼脂糖凝胶电泳鉴定。
1.2.2 qRT-PCR检测药物对生物膜阳性MRSE mecA基因表达的影响
1.2.2.1 生物膜的建立 先用TSB培养基复苏-20℃保存的菌株摇床震荡1h,血平板37℃、24h传代2次后,再配制成浓度为1×106CFU·mL-1的菌悬液,在无菌6孔板内培养24 h SE生物膜。每孔加入3mL液处理,分为2 µg·mL-1二氢丹参酮Ⅰ+ 2 µg·mL-1氨苄西林联用组、2 µg·mL-1氢丹参酮Ⅰ组、2 µg·mL-1氨苄西林组,另设置64 µg·mL-1万古霉素作为阳性药物干预组、不加药的对照组,37℃培养24 h。
1.2.2.2 qRT-PCR检测mecAmRNA 参照Trizol Reagent说明书采用Trizol法提取SE生物膜RNA,然后取RNA样品液1μL,利用Thermo微量核酸蛋白分析仪测定其浓度。按照Omega的逆转录试剂盒将RNA逆转录为cDNA,-70℃保存。按照TransStart Green qPCR SuperMIX试剂盒检测生物膜形成相关基因的表达,荧光定量PCR反应条件设置:第一步94℃预变性30s,第二步94℃变性5s,第三步52℃退火15s,第四步72℃延伸10s,40个循环,并于每个循环的延伸阶段收集荧光信号;60-95℃做溶解曲线,以16SrRNA为内参基因,采用2-ΔΔct法计算各目的基因的相对定量。
1.2.3 ELISA检测药物对MRSE的PBP2a表达的影响 参照1.2.2.1方法,在6孔板中加入无菌玻片建立生物膜。培养结束后用液氮碾磨玻片并收集粉末,按照通用蛋白裂解液说明书进行蛋白质提取,取适量裂解液稀释PSMF为1mM。加入EP管中、混匀,置于冰上裂解后,离心取上清液。按照BCA蛋白定量试剂盒说明书进行蛋白质浓度测定,配置BCA工作液,制作蛋白质标准曲线,将蛋白加入样品孔中,每孔加入BCA工作液,37℃避光孵育,酶标仪测定A570,并根据标准品的吸光度和浓度绘制标准曲线。按照 ELISA试剂盒说明书检测PBP2a蛋白的表达,根据蛋白质浓度结果将每组蛋白模板稀释至相同浓度,设置标准品孔、样本孔和空白孔。除空白孔外每孔加入HRP标记的检测抗体,用封板膜封住反应孔,37℃孵育,洗涤5次,每孔加入底物A、B,37℃避光孵育后加反应终止液50μL,酶标仪检测A450,并根据标准品的吸光度和浓度绘制标准曲线。
1.3 统计学分析
各实验组之间的差异性比较,通过SPSS21.0统计学软件进行单因素方差分析(o n e-w a y ANOVA),每个药物组设置8个复孔,整个实验重复3次,实验结果以均数±标准差表示,以P<0.05为具有统计学差异。
2 结果
2.1 mecA基因阳性菌株的筛选结果
根据电泳结果,5株临床MRSE中mecA基因阳性的菌株为SE21021、SE26508和SE30291,扩增mecA基因的电泳图如图1所示。

图 1 SE26508、 SE21021 、SE30291 mecA基因扩增电泳图
2.2 二氢丹参酮Ⅰ与氨苄西林联用对生物膜阳性MRSE的mecA基因表达的影响
药物干预MRSE中mecA基因的表达情况见图2
对于SE21021,与二氢丹参酮Ⅰ单用和万古霉素组相比,2 μg·mL-1二氢丹参酮Ⅰ与2 μg·mL-1氨苄西林联用能明显降低mecA的表达且有统计学意义(P<0.05);与氨苄西林单用组相比,联用组也能降低mecA的表达,但无统计学意义(P>0.05)。对于SE26508,各组药物均促进mecA基因的表达(P<0.05),但是联用组mecA基因的表达低于氨苄西林单用组、二氢丹参酮Ⅰ单用组和万古霉素组,其差异均有统计学意义(P<0.05)。对于SE30291,联用组、氨苄西林单用组和二氢丹参酮Ⅰ单用组均降低了mecA表达,但差异无统计学意义(P>0.05),万古霉素则促进了mecA基因的表达(P<0.05),因而联用组比万古霉素的抑制作用好且有统计学意义(P<0.05)。
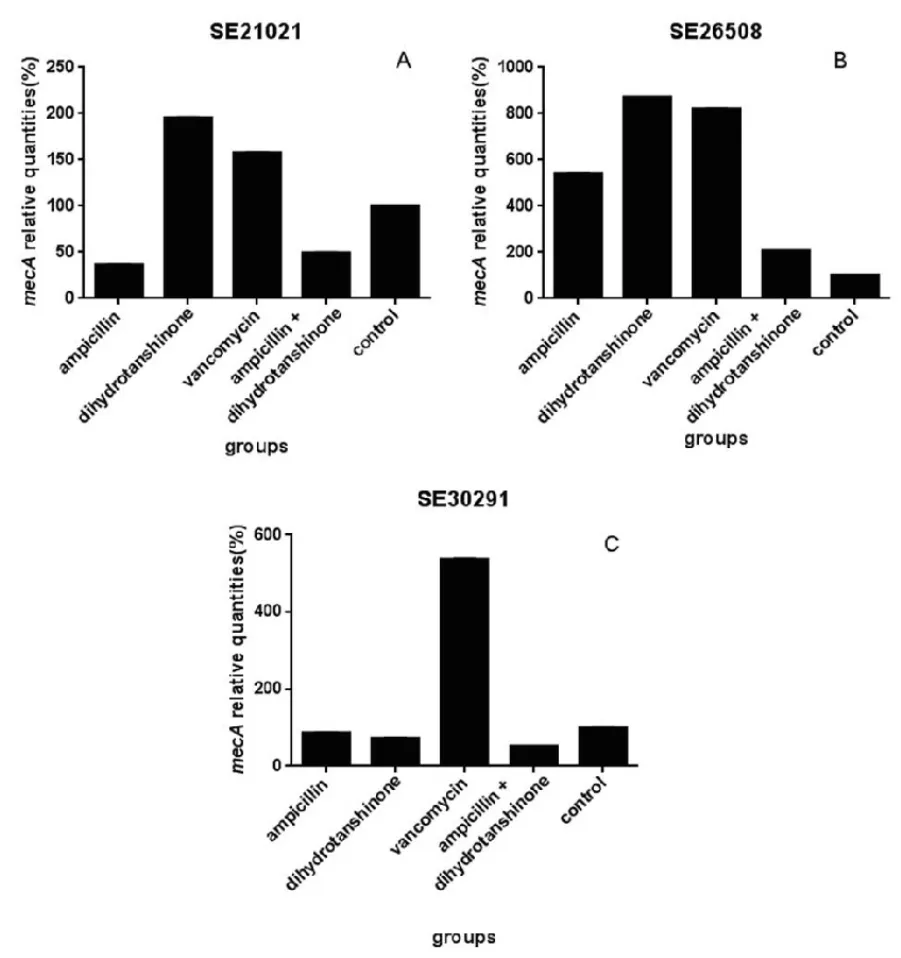
图2 药物干预后临床菌株生物膜中mecA基因相对表达情况
2.3 二氢丹参酮Ⅰ与氨苄西林联用对生物膜阳性MRSE的PBP2a蛋白表达的影响
ELISA测定PBP2a蛋白含量的标准曲线如图3所示,x轴代表标准品浓度(ng·μL-1),y轴代表吸光度,得到浓度与吸光度之间的线性关系为y = 0.0012x+ 0.0321,R² = 0.9979,根据标准曲线计算得到各组的PBP2a的表达量如图4所示。
从图4中可以看出,对于三株MRSE尽管已经使用了浓度已相对较高(64 μg·mL-1)的万古霉素,但是万古霉素对它们的抑制作用并不理想。对于SE21021,各组药物均抑制了PBP2a的表达(P<0.05),且联用组的PBP2a蛋白(301.50 ng·μL-1±13.26)比氨苄西林单用组(329.82 ng·μL-1±2.15)、万古霉素组(360.26 ng·μL-1±9.26)都低(P<0.05),但比二氢丹参酮Ⅰ单用组(294.48 ng·μL-1±2.07)高(P>0.05)。对于SE26508,除万古霉素组,其他各组药物均抑制了PBP2a的表达,但只有氨苄西林单用组(187.47 ng·μL-1±3.74)具有统计学意义(P<0.05);联用组PBP2a(224.27 ng·μL-1±10.53)的表达低于万古霉素组(250.90 ng·μL-1±8.21)且具有统计学意义(P<0.05),高于氨苄西林单用组、二氢丹参酮Ⅰ单用组(218.27 ng·μL-1±8.89)但差异无统计学意义(P>0.05)。对于SE30291,各组药物均抑制了PBP2a的表达,除了万古霉素组,其余组均无统计学意义(P>0.05);联用组的PBP2a蛋白(220.56 ng·μL-1±11.29)比氨苄西林单用组(329.82 ng·μL-1±2.15)、万古霉素组(213.44 ng·μL-1±5.74)都高,差异无统计学意义(P>0.05),但是比二氢丹参酮Ⅰ单用组(232.35 ng·μL-1±7.00)低,差异无统计学意义(P>0.05)。
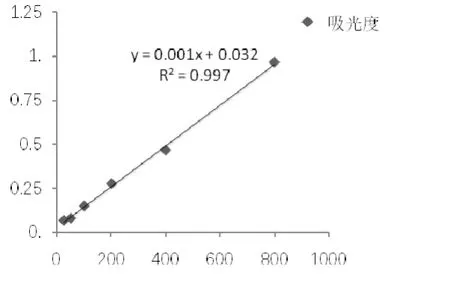
图3 PBP2a定量标准曲线
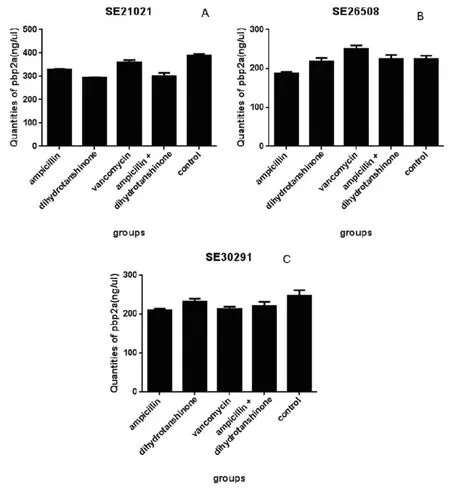
图4 药物干预后临床菌株生物膜中PBP2a蛋白定量结果
3 讨论
MRSE是临床重要的多重耐药菌之一,其耐药机制主要与mecA基因编码产生新的青霉素结合蛋白-PBP2a有关。转肽酶PBP2a与β-内酰胺类抗生素的亲和力极低,当正常的PBPs被β-内酰胺类药物结合而失去活性时,PBP2a能代替其功能,促进肽聚糖合成,维持SE的生长,从而导致其对β-内酰胺类等多种临床常用抗生素耐药。而生物膜内环境的改变可激活耐药基因的表达,甚至影响基因表达谱,发生基因水平转移,其中少数细菌的耐药性会传递给其他细菌[6],导致SE生物膜内mecA基因携带细菌越来越多,从而增加对β-内酰胺类抗生素的耐药性。因此研究可以抑制生物膜阳性MRSE的药物或方法可以有效控制临床MRSE的传播。
针对MRS的治疗,一篇发表在Nature Chemical Biology上的文章指出哌拉西林、美罗培南、他唑巴坦组合使用可以协同抑制MRSA,并破坏细菌细胞壁。在小鼠感染模型中,三药联用方案与利奈唑胺同样有效,因此可见β-内酰胺类抗生素与其他抗生素联用是可以恢复对MRSA的抑制作用[7]。另外有些研究[8~9]还发现从天然药物中提取的有效成分与β-内酰胺类抗生素联用可以协同抑制MRS,如Carolina等[8]发现从八宝树中提取的成分F-10可以协同β-内酰胺类抗生素通过降低PBP2a的表达来抑制MRSA,段德军[9]等人发现丹参酮与氨苄西林、头孢唑啉联用可以增强对MRSA的抑制作用,同时还可以增强MRSA对万古霉素的敏感性。
本课题组前期研究中,我们发现二氢丹参酮与氨苄西林联用具有对MRSE浮游菌与生物膜细菌的协同抑菌作用,故本研究以MRSE耐药基因为靶点,分析药物对生物膜阳性的MRSE mecA、PBP2a表达的影响,初步探讨丹参活性单体与抗生素联用对MRSE耐药逆转的可能性。其结果显示:对于SE21021,氨苄西林和二氢丹参酮Ⅰ联用可以抑制mecA基因的表达,降低PBP2a蛋白的含量,并且与氨苄西林单用相比能降低PBP2a蛋白的表达,这说明联用可能具有一定的逆转作用。对于SE30291,药物联用后具有抑制mecA基因表达的作用,并且抑制幅度大于氨苄西林单用组,但PBP2a蛋白的表达却比氨苄西林单用高。对于SE26508,联用之后反而促进了mecA的表达。说明联用后不能100%的抑制所有菌株mecA的表达。同时,我们发现药物对mecA和PBP2a蛋白表达的抑制存在着不一致的现象:在SE26508,药物联用后促进了mecA的表达,但降低了PBP2a的表达,其可能的原因是:尽管mecA是PBP2a的编码基因,但mecA的其他转录调控机制会影响PBP2a的合成。有研究证实[10]mecA转录形式包括组成型、诱导型与延迟诱导型。mecRI-mecI系统调控组成型转录方式,其调控mecA基因的表达水平与PBP2a蛋白表达成正相关。而blaRI-blaI系统控制诱导型与延迟诱导型转录方式,PBP2a的合成需要β-内酰胺类抗生素的诱导刺激下产生,因而mecA基因与PBP2a蛋白表达水平并非完全一致。
综上,由于本次实验选择的菌株数较少,且使用同一浓度药物作用的效果也不尽相同,因此尚不能得出二氢丹参酮Ⅰ和氨苄西林联用对MRSE具有耐药逆转的作用,需加大菌株数量、增加生物膜形成前后耐药基因表达水平和耐药表型检测以进一步探求和验证。
[1]Heilmann C, Hussain M, Peters G,et al.Evidence for autolysinmediated primary attachment of Staphylococcus epidermidis to a polystyrene surface [J].Molecular Microbiology, 1997,24(5): 1013.
[2]Henning Büttner, Dietrich Mack, Holger Rohde.Structural basis of Staphylococcus epidermidis biofilm formation:mechanisms and molecular interactions [J].Frontiers in Cellular and Infection Microbiology, 2015,5:4.
[3]崔新洁,夏瑾,邵铁娟等.中药抗耐甲氧西林金黄色葡萄球菌生物膜研究进展 [J].中国中医药信息杂志.2017,24(2):132.
[4]李燕,李冬冬,宋瑱,等.4种方法检测表皮葡萄球菌生物膜形成能力的应用价值探讨[J].中国实验诊断学.2011,15(3):424.
[5]李燕,李冬冬,陶传敏,等.表皮葡萄球菌生物膜形成及相关基因的检测及评价[J].中华医院感染学杂志.2010,20(4):473.
[6]Lewis K.Riddle of biofilm resistance[J].Antimicrob Agents Chemother, 2001, 45(4): 999.
[7]Patrick RG, Mitchell WP, Renee B,et al.Synergistic,collaterally sensitive β-lactam combinations suppress resistance in MRSA[J].Nature Chemical Biology,2015,11:855.
[8]Carolina S, Ee Leen P, Kuan-Hon L,et al.Inhibition of penicillin-binding protein 2a(PBP2a) in methicillin resistant Staphylococcusaureus (MRSA) by combination of ampicillin and abioactive fraction from Duabanga grandiflora[J].BMC Complementary and Alternative Medicine ,2015,15:178.
[9]段德军.丹参酮与万古霉素联合应用对MRSA的抑制作用[J].实用全科医学,2008,6(4);363.
[10]陆克乔.滇重楼正丁醇提取物抗白念珠菌生物膜作用及机制研究[D].安徽:安徽中医药大学, 2016.
