体外模拟SAH状况下IL-6对大鼠蛛网膜细胞极化状态的影响
2018-06-13陈功陈祥朱丹丹王自谱张小洁信照亮
陈功 陈祥 朱丹丹 王自谱 张小洁 信照亮
迟发性脑缺血(DCI)是蛛网膜下腔出血(SAH)最重要的并发症,与蛛网膜下腔内发生的非特异性炎症密切相关。研究发现,蛛网膜细胞作为蛛网膜下腔中固有的巨噬细胞,具有抗原提呈能力,能够参与启动SAH后的炎症反应[1-2]。Kai等[3]报道,SAH 时脑脊液(CSF)中凝血酶的水平与出血严重程度、SAH病情的发展和脑血管痉挛密切相关。凝血酶已成为实验性SAH的常用诱导剂。近年来人们逐渐认识到,在不同环境中的巨噬细胞可以发生不同性质的活化,成为具有不同活化表型和功能特征的亚群。蛛网膜细胞具有单核巨噬细胞的类似功能,被认为是蛛网膜下腔中的固有巨噬细胞,能够参与SAH后蛛网膜下腔中的炎症反应。因此,研究蛛网膜细胞的极化能力有助于阐明蛛网膜下腔细胞免疫功能低下和SAH后炎症的发生机制。有研究报道认为,IL-6是SAH后CSF中主要的促炎因子[4],但IL-6是否可以影响蛛网膜细胞的M1/M2状态,未见报道。本实验采用体外培养的大鼠蛛网膜细胞,经外周巨噬细胞极化诱导因子GM-CSF或M-CSF分别刺激后,采用ELISA法检测极化相关因子IL-6、IL-12p40(M1极化标志性因子)、IL-10(M2极化标志性因子)的变化,观察是否可以诱导蛛网膜细胞发生极化;然后用凝血酶作为激活剂活化蛛网膜细胞在体外模拟SAH状况,再采用不同剂量IL-6刺激活化的蛛网膜细胞和正常(非活化)蛛网膜细胞,实时荧光定量PCR(qRT-PCR)法观察CD68(单核-巨噬细胞标志物)、CK8+18(蛛网膜细胞标志物)、IL-12p40、IL-23(M1 极化标志性因子)、精氨酸酶-1(Arg-I)(M2极化标志性因子)的RNA(相对)表达水平,以研究IL-6对大鼠蛛网膜细胞极化状态的影响和量效关系。
1 材料和方法
1.1 材料 1~2d的SD大乳鼠(西安交通大学医学院实验动物中心提供)40只,体重5~6g。仪器:激光扫描共聚焦显微镜,10、200、1 000μl无菌无酶微量吸头,200μl、1.8ml无菌无酶微量离心管,实时定量PCR仪,紫外分光光度计,普通高速离心机,高速冷冻离心机,低速离心机,漩涡混匀器。试剂:胎牛血清(FBS)、PBS、4%多聚甲醛、0.2%Trition、5%牛血清白蛋白(BSA,西安依科生物有限公司)、DMEM/F12培养基、重组人粒细胞集落刺激因子(GM-CSF)、重组人巨噬细胞集落刺激因子(M-CSF)、重组人IL-6、凝血酶、小鼠抗人Cytokeratin8&18(CK8+18)单克隆抗体(英国Abcam公司)、兔抗Vimentin多克隆抗体、兔抗人CD68多克隆抗体(北京博奥森生物有限公司)、羊抗小鼠FITC(英国Abcam公司)、羊抗兔FITC(北京中杉金桥生物科技有限公司)、DAPI细胞染色液(中国碧云天公司)、氯仿、异丙醇、75%乙醇、焦磷酸二乙酯(DEPC)、反转录试剂盒、RT-PCR试剂盒。
1.2 大鼠蛛网膜细胞培养 参照蛛网膜细胞培养的方法[1]。将SD大乳鼠乙醇消毒后移入操作台断头处死,用剪刀将头部皮肤钝性剥离,再从后囟沿矢状缝及人字缝剪开颅骨,剥离颅骨后取蛛网膜层,PBS冲洗后剪碎,置于FBS中浸泡5min,移入培养瓶,取0.1~0.2ml完全培养液滴在组织块表面,置于培养箱12h待组织块贴壁后,再补加培养液2ml。2~3d换液1次,7~14d后可见细胞铺满培养瓶底总面积的70%~80%,即可传代至12孔板中。用移液器吸取0.1ml细胞悬液,轻轻滴加在盖玻片上,勿使细胞悬液从盖玻片溢出。把12孔培养板移至培养箱中。24h后,待大部分细胞贴壁向每孔补加1ml完全培养基。每3d换液1次,当细胞爬满盖玻片的50%~60%时取出盖玻片,立即制片。
1.3 培养蛛网膜细胞的鉴定(ICC检测) CK8+18和Vimentin作为蛛网膜细胞的标志物已在许多研究得到应用;Vimentin、CD68是组织内和成熟巨噬细胞的标志物。传代培养蛛网膜细胞,4%多聚甲醛固定30min,PBS冲洗;0.2%Trition作用10min,冲洗;BSA封闭FC段受体,4℃条件下作用90min。再加200μl一抗:包括小鼠抗人CK8+18单克隆抗体,兔抗CD68多克隆抗体,4℃过夜。PBS冲洗3遍,每遍5min后分别向每张玻片加200μl二抗:羊抗小鼠FITC,羊抗兔FITC或Cy3标记山羊抗兔IgG(上海翊圣生物科技有限公司),37℃,45min,PBS冲洗5遍,3min/次,分别向每张玻片加入200μl DAPI作用3min,PBS冲洗,甘油封片。在荧光显微镜(日本Nikon公司)下,观察培养细胞CK8+18、Vimentin、CD68的表达情况,以鉴定蛛网膜细胞。
1.4 SAH状况下蛛网膜细胞极化状态的观察
1.4.1 极化诱导因子GM-CSF和M-CSF对蛛网膜细胞的极化诱导 在体外,人M1和M2均可由CD14单核细胞在不同细胞因子诱导下获得:在完全培养液中加入重组GM-CSF可获得M1,而加入M-CSF可获得M2[5]。待12孔培养板中的蛛网膜细胞爬满盖玻片总面积的50%~60%时,弃去细胞上清液,用PBS洗3遍,5min/次,参照Fleetwood等[6]的方法,分别向每孔加入1ml的 GM-CSF(0、500U/ml)、1ml M-CSF(0、100ng/ml)。在刺激后的第6天取出爬片并制片,用ELISA法检测上清液中IL-6、IL-12p40和IL-10表达水平以观察其是否可以发生极化。
1.4.2 凝血酶刺激模拟SAH对蛛网膜细胞极化状态的影响 凝血酶已成为实验性SAH的常用诱导剂[3]。参照吴碧华等[7]的方法,分别向每孔加入凝血酶(0、10、50U/ml),分别在刺激后的第3天取出爬片并制片作ICC 检测 IL-1、TNF-α(M1极化标志因子)、CD163、Arg-1(M2极化标志因子)。
1.4.3 IL-6刺激模拟SAH状况对蛛网膜细胞极化状态影响 SAH后患者CSF中IL-6水平为100~600pg/ml[8-9];IL-6水平为270~300pg/ml时与迟发性脑缺血和颅内高压的发生率相关,而血管痉挛组则高达到450~600pg/ml[8]。因此,笔者选取 100、300、600pg/ml作为低、中、高剂量组。对照组(为正常蛛网膜细胞)和实验组(为最佳剂量凝血酶刺激3d后的蛛网膜细胞),根据胡晓芳和刘保国等[8-9]所报道的中国成年SAH患者CSF中IL-6水平,分别向每孔加入 IL-6 0、100、300、600pg/ml,分别在刺激后的第1、3、7、14天取出爬片并制片做ICC检测。
1.4.4 qRT-PCR测定 引物见表1。按实验设计留取并保存上清液和实验的细胞。每批实验分别设置3个复孔。所得数值为3者的均值。

表1 引物表
1.4.4.1 蛛网膜细胞总mRNA提取 每孔加入1ml Trizol,反复吹打,室温静置 5min,加入氯仿 200μl,剧烈震荡,离心后取上层水相,加500μl异丙醇,离心后去上清液,加入1ml 75%乙醇洗涤,离心后弃上清液,干燥后加入50μl DEPC-80℃保存。
1.4.4.2 反转录合成cDNA 去除基因组DNA反应后,先加入 8μl的 RNase Free dH2O 和 8μl的 5×PrimeScript Buffer 2,混匀后,再添加2μl RT Primer Mix和2μl的PrimeScript RT Enzyme Mix I,得到 40μl的反应体系,轻轻混匀后,37℃作用 15min,85℃ 作用5s。
1.4.4.3 以cDNA为模板扩增特异基因片段的RT-PCR反应 以 cDNA为模板扩增 CD68、IL-12、IL-23和Arg-I的基因编码片段,以大鼠β-actin为内参照,条件如下:94℃预变性 30s;95℃变性 5s,60℃退火 30s,40个循环;延伸10min。采用△△CT数学模式对结果进行分析。
1.5 统计学处理 应用Grahpad Prism 5.0或SPSS17.0统计软件,计量资料用表示,两组间比较采用Student′s t检验,多组间比较采用多组独立样本秩和检验或方差分析,采用线性相关分析确定其相关性,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠蛛网膜细胞培养及鉴定 体外培养大鼠蛛网膜细胞,细胞呈多角形;ICC可见,95%以上的细胞CK8+18、Vimentin表达阳性,呈丝状分布于细胞质内,细胞核内未见表达;95%以上的细胞CD68表达阳性,呈丝状分布于细胞质内,细胞核内未见表达(图1,见插页)。
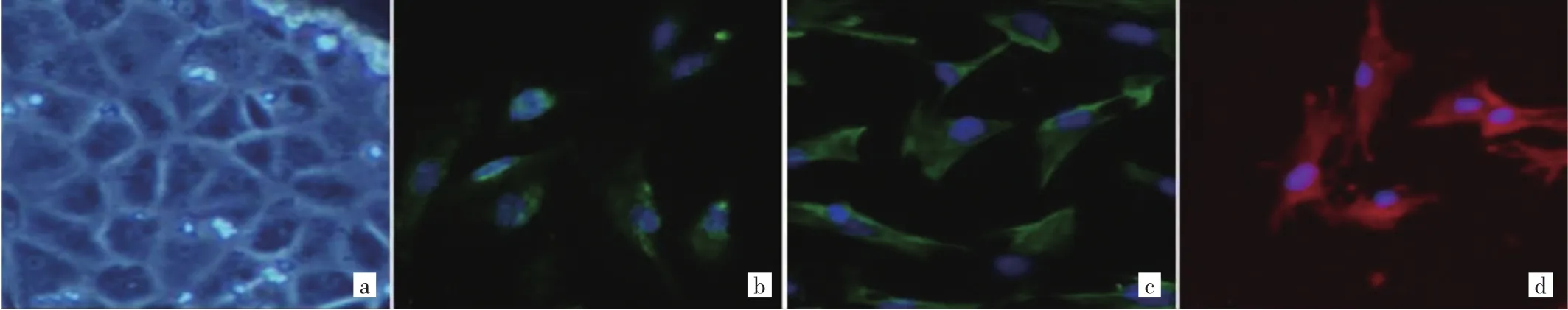
图1 体外培养大鼠蛛网膜细胞图(a:倒置显微镜,将蛛网膜组织块接种至培养瓶1~2d,可见组织块边缘有细胞游走出来,×100;b:ICC染色,细胞CK8+18表达阳性,×200;c:ICC染色,细胞Vimentin表达阳性,×200;d:免疫荧光染色,细胞CD68表达阳性,×200)
2.2 极化诱导剂GM-CSF和M-CSF对蛛网膜细胞的极化诱导状况 500U/mlGM-CSF组IL-6和IL-12p40水平显著性增高,而100U/ml M-CSF刺激组无显著性变化,见图2-3;两组IL-10水平均低于试剂盒检测下限。可见,在GM-CSF和M-CSF分别刺激下,蛛网膜细胞仅发生了M1型极化而没有发生M2极化,与外周单核巨噬细胞的反应不同。

图2 GM-CSF刺激蛛网膜细胞6d后M1极化因子IL-6水平变化

图3 GM-CSF刺激蛛网膜细胞6d后M1极化因子IL-12p40水平变化
2.3 凝血酶刺激模拟SAH对蛛网膜细胞极化状态的影响 采用10U/ml及50U/ml凝血酶分别刺激蛛网膜细胞3d后,50U/ml刺激组细胞IL-1、Arg-I和 CD163 mRNA相对表达水平较10U/ml刺激组显著性升高,TNF-α无明显变化,见图4,提示50U/ml凝血酶是较好的刺激浓度。

图4 凝血酶刺激蛛网膜细胞,IL-1、Arg-I、CD163、TNF-α相对表达水平
2.4 IL-6刺激模拟SAH状况对蛛网膜细胞极化状态的影响
2.4.1 对照组 不同浓度的IL-6刺激正常的蛛网膜细胞,经100pg/ml的IL-6刺激后,CD68相对表达量在各时间组间比较无统计学差异(P>0.05)。其中经300、600pg/ml的IL-6分别刺激后,CD68表达的时间模式,各时间组之间比较差异无统计学意义(P<0.05):当IL-6为600pg/ml时,CD68在1d达到最高,在7d最低;当IL-6为300pg/ml时,CD68在3d达到最高,在14d最低(图5)。蛛网膜细胞的巨噬样特征呈IL-6刺激剂量大出现和消退早的时间模式。
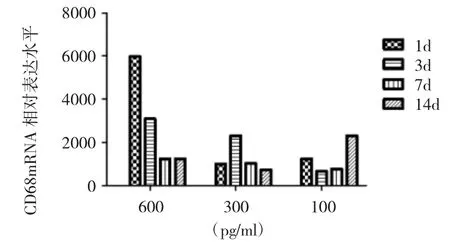
图5 不同浓度的IL-6刺激正常蛛网膜细胞CD68表达情况
IL-6刺激正常蛛网膜细胞14d时M1极化因子IL-23和IL-12p40表达水平增高,IL-23表达水平显著提高,IL-12p40在高剂量时表达最低,刺激剂量为300pg/ml时IL-12p40表达水平最高(图6);M2极化因子Arg-Ⅰ表达在14d时增高,且Arg-Ⅰ表达水平随刺激剂量的增加而降低(图7),提示,IL-6刺激使得正常蛛网膜细胞发生极化需要很长时间,且不同的极化因子与刺激剂量的关系不同。
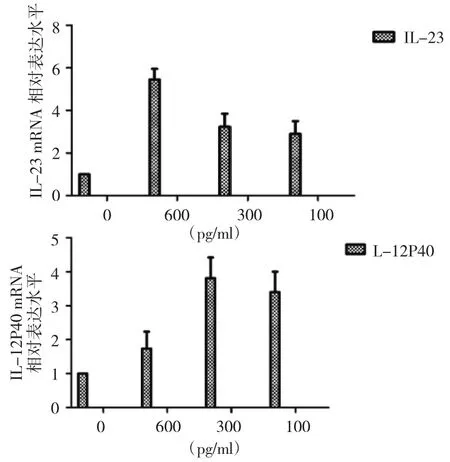
图6 不同浓度的IL-6刺激正常蛛网膜细胞14d后,M1极化因子IL-23和IL-12p40相对表达水平
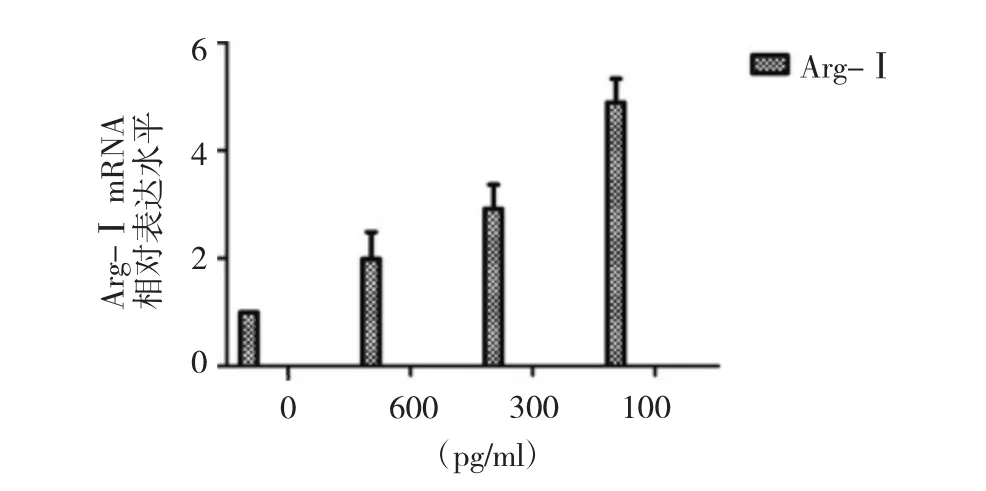
图7 不同浓度IL-6刺激正常蛛网膜细胞14d后,Arg-Ⅰ相对表达水平
2.4.2 实验组 经100pg/ml的IL-6刺激后,CD68相对表达水平在第1天达到最高,第7天最低,各组之间无统计学差异(P>0.05);经 600、300pg/ml的 IL-6分别刺激后,从第3天开始,随着刺激天数的增加,CD68相对表达水平减少,各组之间有差异统计学意义(P<0.05)(图 8)。活化的 Ar细胞,经 300~600pg/ml的 IL-6刺激下,根据CD68相对表达水平,1~3d时Ar细胞的巨噬样特征最为明显,抗原提呈能力可能增强,而在7~14d,其细胞巨噬样特征逐渐减弱,抗原提呈能力可能随之减弱。
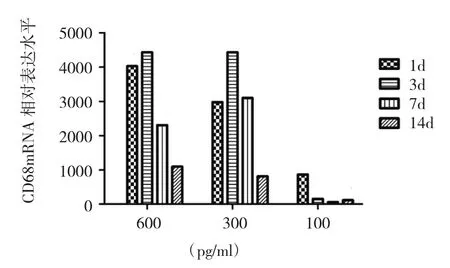
图8 不同浓度IL-6刺激凝血酶活化的蛛网膜细胞CD68相对表达水平
先用50U/ml凝血酶激活蛛网膜细胞3d后加入IL-6刺激。可见在1、3、7、14d蛛网膜细胞M1极化因子IL-23相对表达水平均显著性增高,在最大刺激量时,3d和7d时增高幅度非常大(图9);而M2极化因子Arg-I相对表达水平刺激3d后才显著性增高,且Arg-Ⅰ表达水平随刺激剂量的增加而降低(图10)。SAH状况下IL-6诱导极化的诱导的时间模式明显不同;可以早期全程诱导M1极化,而在3d才开始诱导M2型极化。
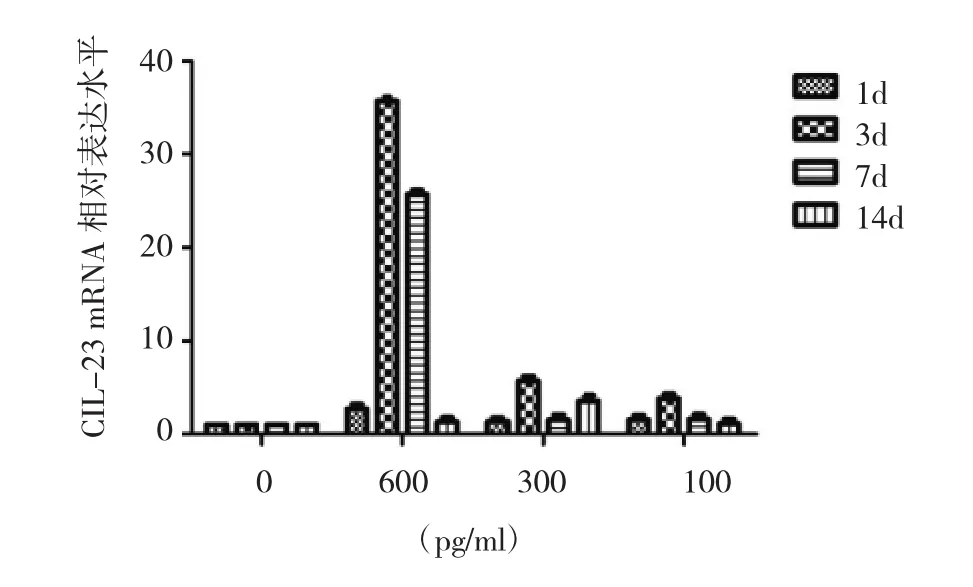
图9 不同浓度IL-6刺激凝血酶活化蛛网膜细胞1d、3d、7d和14d,M1极化因子IL-23相对表达水平
3 讨论
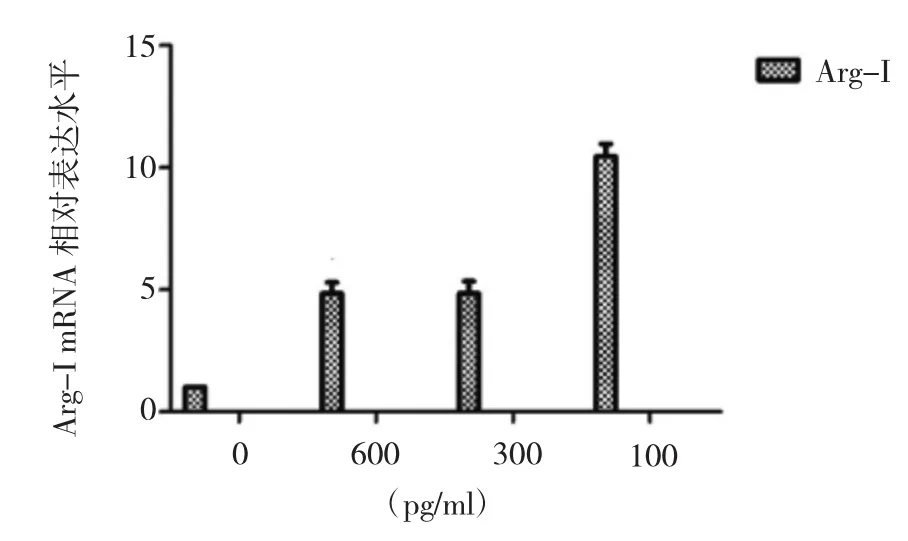
图10 不同浓度IL-6刺激凝血酶活化蛛网膜细胞3d后细胞M2极化因子Arg-I相对表达水平
大鼠蛛网膜细胞体外培养技术已日渐成熟,Lam等[10]发现大鼠蛛网膜细胞在结构和功能上均类似于人蛛网膜细胞。Janson等[11]成功诱导了大鼠永生化蛛网膜细胞,加之人蛛网膜细胞培养成功率不高等因素,本研究选择大鼠蛛网膜细胞作为实验细胞。许多研究将CK8+18、Vimentin作为蛛网膜细胞的标志物,将CD68作为组织内和成熟巨噬细胞的标志物;因此,我们采用上述标志物鉴定培养的细胞及其活化状态。
SA为人体防御功能薄弱的区域,体液免疫和细胞免疫功能均明显底下;静息状态下,蛛网膜细胞的浆内线粒体、粗面内质网、高尔基体和溶酶体与外周巨噬细胞相比均不发达,有反应能力低下的结构基础。在本实验中,经GM-CSF诱导后,细胞上清液中促炎因子IL-6和IL-12p40水平较未刺激组显著性增高;而经M-CSF刺激后,细胞上清中促炎因子IL-6和IL-12p40水平与对照组比无统计学意义;目前涉及抗炎因子在SAH中作用的相关报道较少,本实验中,IL-10水平低于试剂盒检测下限。提示蛛网膜细胞在GM-CSF的诱导下只发生了M1极化,未发生M2极化,与外周明显不同;这可能部分解释了SA中免疫功能低下的原因。Kooijman等[12]发现SAH后的48h,IL-10表达量只有上升趋势(P>0.05),而Aihara等[13]发现SAH后14d,IL-10表达量无明显变化。IL-10在SAH中的作用仍存争议。Murray等[14]发现发现单核巨噬细胞分泌IL-10部分依赖于MAP激酶级联JAK-STAT通路和MAP激酶级联激活通路。是否M-CSF刺激作用未能激活蛛网膜细胞分泌IL-10基因转录相关通路,需要进一步研究证明。
Kai等[3]报道,SAH时脑脊液中凝血酶的水平与出血严重程度、SAH病情的发展和脑血管痉挛密切相关,凝血酶已成为实验性SAH的常用诱导剂。凝血酶是一种重要的促炎因子,能上调多种炎症因子的表达,巨噬细胞表面表达凝血酶受体,可被凝血酶激活[15]。本实验采用10U/ml及50U/ml凝血酶分别刺激蛛网膜细胞,3d后发现,50U/ml凝血酶刺激组细胞 IL-1、Arg-I和CD163mRNA相对水平较10U/ml凝血酶组显著性升高;Galea等[16]检测到SAH患者CSF中CD163水平高于对照组,Fassbender等[17]发现SAH患者CSF中IL-1浓度显著性增高。故以50U/ml作为活化蛛网膜细胞的最佳浓度。
Schoch等[18]认为CSF中IL-6显著性增高则SAH患者预后不良,IL-6是CSF中与病情密切相关并能预测SAH预后的标志因子。IL-6主要由单核巨噬细胞产生,作为SAH后SA内主要的促炎因子,能够使单核细胞发生活化,并促进细胞表达黏附因子及多种炎症递质,还可促进内皮细胞释放第Ⅲ凝血因子,并参与启动凝血过程[19]。笔者根据SAH后不同阶段IL-6在CSF中的浓度[8-9],选取100pg/ml(低)、300pg/ml(中)和600pg/ml(高)剂量组;分别刺激正常蛛网膜细胞和经凝血酶刺激活化的蛛网膜细胞1、3、7、14d,发现IL-6的剂量影响CD68的表达,且对正常和活化蛛网膜细胞刺激结果一致。中高剂量IL-6刺激时蛛网膜细胞的巨噬样特征在1~3d最为明显,7~14d逐渐减弱。
经3种剂量的IL-6分别刺激正常蛛网膜细胞,1、3、7d后IL-23相对表达水平与未加入IL-6刺激组相比无统计学差异,而14d刺激组IL-23水平较未加入IL-6刺激组显著性升高,且随刺激剂量的增加而增加。刺激经凝血酶活化的蛛网膜细胞,1、3、7、14d,IL-23 表达水平均较未加入IL-6刺激组相比显著性升高。提示蛛网膜细胞(凝血酶刺激)的活化状态与发生M1极化改变密切相关;还发现,当高剂量IL-6刺激活化的蛛网膜细胞3~7d,IL-23表达水平达到最高。Schoch和Xie等[18,20]发现,SAH 发生 4~6d后,血性 CSF中 M1相关因子IL-6、TNF-α和IL-1β水平显著性高于对照组。在临床上,DCI多发生于SAH后的1~3d,7~14d是发病的高峰时间。提示,在IL-6可以很快诱导凝血酶活化蛛网膜细胞发生M1极化,且其时间模式与临床上发生DCI的时间模式基本一致。
Arg-I是免疫系统中的关键组分,由Th2细胞因子如IL-4、IL-10和IL-13诱导产生。王青山等[21]发现IL-6能在一定程度上抑制巨噬细胞由M1型向M2型转化。Kigerl等[22]发现小鼠脊髓损伤后 3~7d,Arg-I表达阳性的M2细胞增高。本实验发现IL-6刺激正常蛛网膜细胞,1、3、7、14d Arg-I相对表达水平与未加入 IL-6 刺激组相比均有升高,而刺激活化的蛛网膜细胞仅在第3天时Arg-I相对表达量与未加入IL-6刺激组相比有升高。Kroner等[23]也发现,脊髓损伤后1~15d内主要以M1为主,Arg-I表达阳性的M2细胞数仅在第4天达到高峰,提示IL-6可刺激正常蛛网膜细胞可发生M2极化改变。同时还发现,100pg/ml的IL-6刺激活化的蛛网膜细胞后Arg-I相对表达水平最高,故推测在低剂量促炎因子的作用下,细胞M2极化特征更为明显。在CSF中,iNOS与Arg竞争性消耗精氨酸,Yatsushige等[24]发现,SAH后CSF中iNOS表达增加,过高水平的NO则对细胞的代谢和生存不利。提示增加CSF中Arg-I的量以减少NO的产生,利用精氨酸Arg-I代谢途径以缓解SAH后并发症的发生可能是一个思路。
总之,蛛网膜细胞在GM-CSF的诱导下只发生了M1极化,未发生M2化,与外周明显不同。在SAH后的CSF微环境中,蛛网膜细胞经IL-6刺激后发生M1/M2极化的时间和表现模式多样,也与外周不同,与临床上变化多端的情况吻合。虽然单纯描述蛛网膜细胞的M1/M2极化状态改变,简化了SAH后SA内巨噬细胞相关的炎症反应,但是本研究还是为SAH后蛛网膜细胞极化改变提供了一个新的基本概念。
4 参考文献
[1]Xin ZL,Wu XK,Xu JR,et al.Arachnoid cell involvement in the mechanism of coagulation-initiated inflammation in the subarachnoid space after subarachnoid hemorrhage[J].Journal of Zhejiang University Science B,2010,11(7):516-523.
[2]Gordon S,Martinez FO.Alternative activation of macrophages:mechanism and functions[J].Immunity,2010,32(5):593-604.
[3]KaiY,Maeda Y,SasakiT,et al.Basic and translationalresearch on proteinase-activated receptors:the role of thrombin receptor in cerebral vasospasm in subarachnoid hemorrhage[J].Journal of pharmacologicalsciences,2008,108(4):426-432.
[4]Sarrafzadeh A,Schlenk F,Gericke C,et al.Relevance of cerebral interleukin-6 after aneurysmal subarachnoid hemorrhage[J].NeurocriticalCare,2010,13(3):339-346.
[5]Verreck FAW,Boer TD,Langenberg DML,et al.Phenotypic and functional profiling of human proinflammatory type-1 and anti-inflammatory type-2 macrophages in response to microbial antigens and IFN-γ and CD40L-mediated costimulation[J].J Leukoc Biol,2006,79(2):285-293.
[6]Fleetwood AJ,Lawrence T,Hamilton JA,et al.Granulocytemacrophage colony-stimulating factor(CSF)and macrophage CSF-dependent macrophage phenotypes display differences in cytokine profiles and transcription factor activities:Implications for CSF blockade in inflammation[J].Journal of Immunology,2007,178(8):5245-5252.
[7]吴碧华,江承平,许可,等.凝血酶诱导培养星形胶质细胞炎症细胞因子的表达[J].神经疾病与精神卫生,2008,8(2):132-135.
[8]胡晓芳,袁笑,王玉红,等.Il-6在蛛网膜下腔出血后脑血管痉挛发病机制中作用的研究[J].国际检验医学杂志,2012,33:2474-2477.
[9]刘保国,巩湘浩,何黎明,等.动脉瘤性蛛网膜下腔出血患者脑脊液il-1β、Il-6及tnfα检测及意义[J].医学临床研究,2012,29(3):404-406.
[10]Lam CH,Hansen EA,Hubel A.Arachnoid cells on culture plates and collagen scaffolds:phenotype and transport properties[J].Tissue engineering(Part A),2011,17(13-14):1759.
[11]Janson C,Romanova L,Hansen E,et al.Immortalization and functional characterization of rat arachnoid cell lines[J].Neuroscience,2011,177(2):23-34.
[12]Kooijman E,Nijboer CH,van Velthoven CT,et al.Long-term functional consequences and ongoing cerebral inflammation after subarachnoid hemorrhage in the rat[J].Plos One,2014,9(6):e90584.
[13]Yasuo Aihara,Hidetoshi Kasuya,Hideaki Onda,et al.Quantitative Analysis of Gene Expressions Related to Inflammation in Canine Spastic Artery After Subarachnoid Hemorrhage[J].Stroke,2001,32(1):212.
[14]Murray PJ.The JAK-STAT signaling pathway:input and output integration.[J].JournalofImmunology,2007,178(5):2623.
[15]张婷,王睿黎,马政文,等.凝血酶刺激单核/巨噬细胞产生IL-8增强卵巢癌细胞侵袭力的实验研究[J].现代妇产科进展,2009,18(10):734-738.
[16]Galea J,Cruickshank G,Teeling JL,et al.The intrathecalCD163-haptoglobin-hemoglobin scavenging system in subarachnoid hemorrhage[J].Journal of Neurochemistry,2012,121(5):785-792.
[17]Fassbender K,Hodapp B,RossolS,et al.Inflammatory cytokines in subarachnoid haemorrhage:association with abnormal blood flow velocities in basal cerebral arteries[J].Journal of Neurology Neurosurgery&Psychiatry,2001,70(4):534-537.
[18]Schoch B,Regel JP,Wichert M,et al.Analysis of intrathecal interleukin-6 as a potential predictive factor for vasospasm in subarachnoid hemorrhage[J].Neurosurgery,2007,60(5):828-836.
[19]邹志强,李涛,陈镇奇,等.凝血酶诱导人单核细胞分泌白细胞介素-6的分析[J].中国医学创新,2010,07(29):16-18.
[20]Xie X,Wu X,CuiJ,et al.Increase ICAM-1 and LFA-1 expression by cerebrospinal fluid of subarachnoid hemorrhage patients:involvement ofTNF-α[J].Brain Research,2013,1512:89-96.
[21]王青山,倪虹,魏晓丽,等.Il-6对m1型巨噬细胞向肿瘤相关m2型巨噬细胞转化过程的诱导作用[J].解放军医学杂志,2009,34(8):927-931.
[22]Kigerl KA,Gensel JC,Ankeny DP,et al.Identification of Two Distinct Macrophage Subsets with Divergent Effects Causing either Neurotoxicity or Regeneration in the Injured Mouse Spinal Cord[J].Journal of Neuroscience the Official Journal of the Society for Neuroscience,2009,29(43):13435.
[23]Kroner A,Greenhalgh AD,Zarruk JG,et al.TNF and increased intracellular iron alter macrophage polarization to a detrimental M1 phenotype in the injured spinal cord[J].Neuron,2014,83:1098-1116.
[24]Yatsushige H,Calvert JW,Cahill J,et al.Limited role of inducible nitric oxide synthase in blood-brain barrier function after experimental subarachnoid hemorrhage[J].Journal of Neurotrauma,2006,23(12):1874.
