晚期直肠癌放化疗对预后的影响因素分析
2018-06-13张泽修光宏王晓东
张泽,修光宏,王晓东
烟台市烟台山医院放疗科,山东 烟台264025
直肠癌是目前位居世界第3位的恶性肿瘤[1],在中国,其发病率位居第5位[2]。近年来,虽然在直肠癌的诊断和治疗方面取得了一些进展,但是结直肠癌患者的5年生存率仍不足50%,而在结直肠癌中,直肠癌所占比例超过60%[3]。目前,手术切除是治疗直肠癌的主要手段,但手术治疗很难彻底切除微小病灶,患者的术后复发率和转移率均较高。同时,有研究证明,单纯手术切除治疗仅在TNM 分期为 Tis、T1、T2,N0、N1,M0和分化较好的患者中疗效明确[4]。另有研究表明,术前进行放化疗能够有效降低肿瘤分期,提高手术切除率,进而减少肿瘤的复发,提高患者的生存率和生存质量[5]。而中国结直肠癌诊疗规范(2015年版)[6]也推荐TNM 分期为 T3~4或 N1~2距肛缘<12 cm 的直肠癌患者,需要术前行新辅助放化疗。但也有一些临床研究认为临床Ⅰ期(T1~2,N0,M0)直肠癌术前辅助放化疗对患者的预后无明显影响[7],对于晚期直肠癌患者辅助放化疗预后的具体影响因素也仍未明确。因此,本研究主要针对晚期直肠癌放化疗的预后及其相关风险因素进行分析,以期明确放化疗对晚期直肠癌患者的具体治疗效果,并可早期干预其影响患者预后的因素,最终延长患者的生存时间,提高临床治疗效果,现报道如下。
1 资料与方法
1.1 一般资料
收集2007年7月至2012年7月于烟台市烟台山医院就诊的218例直肠癌患者的临床资料。其中,男138例,女80例;年龄37~84岁,平均(53.45±5.31)岁;病理类型:高分化腺癌110例,中分化腺癌72例,低分化腺癌36例。纳入标准:①病理组织学检查确诊为直肠腺癌;②根据美国癌症联合委 员 会(American Joint Committee on Cancer,AJCC)/国际抗癌联盟(Union forⅠnternational Cancer Control,UⅠCC)直肠癌 TNM 分期系统分期为M0期;③行根治性手术治疗;④术前完成辅助放疗,放疗总剂量为45.0~50.4 Gy;⑤术前完成3个周期及3个周期以上的5-氟尿嘧啶(5-FU)辅助化疗方案;⑥临床资料完整,疾病史、家族史资料详实,术前1周内的体格检查、肿瘤标志物等检查资料完善;⑦规律随访5年。排除标准:①合并其他恶性肿瘤;②术前存在感染或感染证据不充分,但体温>38℃;③合并脑栓塞、心力衰竭、肝肾功能衰竭等严重内脏器官病变;④围手术期出现死亡。
1.2 观察指标
根据病例信息收集患者的年龄、性别等一般人口学特征资料;根据患者入院后的治疗经过及检查结果,收集患者的血红蛋白、临床分期、T分期、N分期、分化程度、肿瘤距肛门距离、癌胚抗原(carcinoembryonic antigen,CEA)、放射剂量和是否临床完全缓解(clinical complete response,cCR)等临床资料。患者术前行CT、MRⅠ、钡餐、PET-CT检查明确原发病灶、淋巴结转移和远处转移情况,根据患者的影像学检查结果明确肿瘤TNM分期。
1.3 治疗方法
1.3.1 放疗 总放疗剂量为45.0~50.4 Gy,中位放疗剂量为47 Gy,分25~28次完成。采用三维适形放 疗(three-dimensional conformal radiotherapy,3DCRT)、容积弧形调强放射治疗(volumetric modulated arc therapy,VMAT)技术完成放疗。3DCRT:患者采取俯卧位、腹板摆位,直线加速器(multileaf conllimator,MLC)技术,治疗计划系统(treatment planning system,TPS)为Pinnacle 8.0,8 MV与15 MV X线混合射线照射一后野、两侧野的三野等中心照射技术,剂量比为2∶1∶1。VMAT技术:患者采取俯卧位,OFRⅠT架摆位,MLC容积静态调强技术,TPS为Monaco,8 MV X线照射。临床靶体积(clinical target volume,CTV)依据CT、MRⅠ、超声结果勾画,CTV包括原发直肠肿瘤病灶两端的部分直肠、直肠周围组织、直肠系膜区、骶前淋巴引流、髂内淋巴引流、闭孔淋巴引流及真骨盆内髂总淋巴引流区。T4期患者向前侵犯膀胱时,则CTV包括髂外淋巴引流区。PTV定义为CTV外放8~10 mm(3DCRT)或6~8 mm(VMAT)。
1.3.2 化疗 化疗方案采用5-FU方案:氟尿嘧啶400 mg/m2,第1天静脉滴注,之后1200 mg/m2,每天1次,共2 d,持续静脉注射。同期化疗2~3个周期,辅助化疗2~8个周期。
1.3.3 手术治疗 辅助放化疗后间隔6~12周进行手术治疗。所有手术均由同一组医师完成,按照全直肠系膜切除术(total mesorectal excision,TME)手术原则实施根治性手术,直肠及其系膜游离至接近盆底直肠裂孔处,肠壁远切缘距离肿瘤≥2 cm,直肠系膜远切缘距离肿瘤≥5 cm或切除全直肠系膜。区域淋巴结要求清扫至第3站。保留肛门括约肌手术方式包括前切除术(AR)、结肠肛管吻合术(Parks术)、经腹直肠癌切除、近端造口、远端封闭手术(Hartmann术)、经前会阴超低位直肠前切除术(APPEAR术)。切除肛门括约肌手术方式包括经腹会阴联合切除术(APR)和内括约肌切除术(ⅠSR)。
1.4 随访
所有患者随访截止于2017年7月,收集患者的随访资料,包含随访时间、患者的一般情况以及疾病转归情况。原始资料参照患者的入院记录,并将末次随访记录作为随访结果。首次随访时间为直肠癌手术切除术后1个月,之后每隔3个月门诊随访1次。随访内容:CEA和糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)为每3个月1次,腹部或盆腔超声为每6个月1次,胸片为每6个月1次,胸腹或盆腔CT为每6个月1次,肠镜检查为1次;随访时间为2年。2年后的随访内容:CEA和CA19-9为每6个月1次,腹部或盆腔超声为每6个月1次,胸片为每年1次,胸腹或盆腔CT为每年1次,肠镜检查为每3年1次;随访时间为3年。终点事件:患者自入院时间起至随访时间止发生的不良预后事件。不良预后事件:患者因直肠癌复发、恶化、出现其他器官转移和因直肠癌及其并发症导致死亡的事件。不良预后率=发生不良预后事件的患者例数/总例数×100%。删失定义为参与研究的患者失访、拒绝访问、中途退出或死于其他与研究无关的原因。
1.5 统计学方法
采用SPSS 19.0软件对-数据进行统计分析。计量资料以均数±标准差(±s)表示。通过Kaplan-Meier法进行生存分析,并绘制生存曲线;将可能影响直肠癌患者预后的因素如患者年龄、临床分期、分化程度、距肛门距离等纳入单因素Cox回归分析;采用Cox比例风险回归模型分析预后影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 随访结果及直肠癌患者的生存曲线
截至随访结束,218例直肠癌患者中,删失患者14例(其中,失访患者11例,死于与研究无关原因的患者3例)。根据随访期间不良预后发生情况的不同,将204例患者分为预后不良组(n=107)和预后良好组(n=97)。预后不良组中,肿瘤复发患者8例,转移患者9例,死亡患者90例。Kaplan-Meier生存曲线显示,直肠癌患者发生不良预后事件的平均时间为(45.53±1.30)个月(95%CⅠ:42.99~48.07),中位生存时间为57.00个月(95%CⅠ:42.96~61.04)。患者的不良预后率为52.45%,3年累积生存率和5年累积生存率分别为72.08%和55.88%。(图1)
2.2 影响直肠癌患者根治性手术治疗预后的单因素分析

图1218 例直肠癌患者的生存曲线
将可能影响直肠癌患者根治性手术治疗预后的因素(一般资料、病理学特征、血清学指标等)逐个纳入Cox比例风险回归模型中进行单因素分析,结果显示:性别、年龄、血红蛋白、T分期、N分期、CEA水平对晚期直肠癌患者的预后无影响(P>0.05),而临床分期、分化程度、肿瘤距肛门距离、手术方式、cCR情况对晚期直肠癌患者的预后有影响(P<0.05)。(表1)
2.3 影响晚期直肠癌患者根治性手术治疗预后的多因素分析
对单因素分析中具有统计学意义的变量进行进一步的多因素Cox回归分析,结果显示:分化程度、肿瘤距肛门距离、手术方式对晚期直肠癌患者的预后无影响(P>0.05),临床分期、是否cCR是影响晚期直肠癌患者预后的独立危险因素(P<0.05)。(表2)
3 讨论
19世纪40年代至50年代,直肠癌曾是美国最常见的恶性肿瘤死亡病因,目前,其病死率位居美国癌症病死率的第3位[8]。直肠位于消化道的末端,虽然其长度仅占消化道总长度的2%左右,但直肠癌的发病率却位居消化道肿瘤的第3位[8]。虽然目前手术仍是直肠癌治疗的首选治疗方法,但越来越多的研究支持以手术为主的多学科综合治疗。Adam等[9]认为手术治疗前联合放化疗或单纯放疗能够改善患者的预后,相关临床荟萃研究结果与此观点一致[10]。此外,部分直肠癌患者合并严重系统性疾病,不能耐受手术治疗,另有一些低位直肠癌患者因无法保肛而放弃手术治疗。鉴于此类患者的存在,同时为提高直肠癌患者的生存质量,越来越多的医院和研究机构开展新辅助放化疗治疗直肠癌的研究[11]。
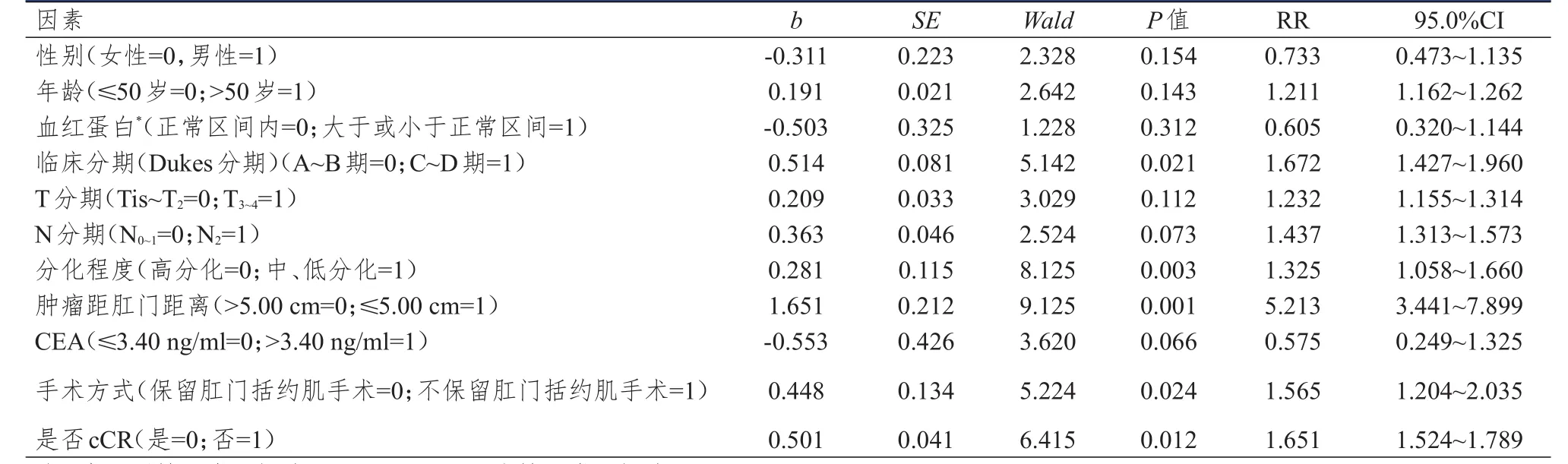
表1 影响直肠癌患者预后的Cox单因素分析

表2 影响直肠癌患者预后的多因素分析
流行病学研究表明直肠癌患者的5年生存率约为65%,其中0~Ⅰ期直肠癌患者的5年生存率约为90%,而发生淋巴结转移的Ⅲ期直肠癌患者的5年生存率仅为58%[12]。本研究中,204例患者均为在烟台市烟台山医院就诊的病例。患者的地理分布为本市及周边地区,男女比例为1.73∶1.00,且患者的一般资料与本地区直肠癌流行病学研究结果基本相符[13]。Kaplan-Meier生存曲线显示,患者发生不良预后事件的平均时间为(45.53±1.30)个月(95%CⅠ:42.99~48.07),中位生存时间为57.00个月(95%CⅠ:42.96~61.04)。随访统计的预后不良患者中,肿瘤复发患者8例,肿瘤转移患者9例,死亡患者90例,可见直肠癌患者术后因恶性肿瘤引起的死亡为患者预后不良的主要因素。
有研究报道,肿瘤分期、分化程度、距肛门距离是判断直肠癌患者预后的主要指标,血红蛋白、CEA等临床常用指标与直肠癌患者的预后具有一定的相关性[14]。因此,本研究将可能影响直肠癌患者预后的指标(年龄、肿瘤距肛门距离、CEA、是否cCR、血红蛋白、临床分期、T分期、N分期、分化程度、手术方式)纳入直肠癌患者预后判断的单因素分析中,结果显示:性别、年龄、血红蛋白、T分期、N分期、CEA水平对患者的预后无影响(P>0.05),而临床分期、分化程度、肿瘤距肛门距离、手术方式、是否cCR对患者的预后有影响(P<0.05),这一结论与Schreuders等[15]研究结果一致。
Duckes临床分期与肿瘤的TNM分期具有一定的相关性,在一定程度上反映肿瘤的分化程度,与肿瘤患者的预后有直接的关系。肿瘤距肛门的距离是决定手术是否切除肛门的重要依据,而能否进行保肛治疗不仅是患者最关心的问题,同时也是影响患者生存质量和预后的重要因素[16]。有研究表明,cCR能够在一定程度上预示患者的预后[17]。Squire等[18]研究证明放化疗后达到cCR的患者,其5年生存率和生存质量优于未达到cCR或未行放化疗辅助治疗的患者。为进一步探究以上因素与直肠癌患者预后的关系,并分析其产生影响的程度,本研究采用多因素Cox比例风险回归模型分析,结果显示:临床分期、是否cCR是影响直肠癌患者预后的独立危险因素(P<0.05),提示临床分期和cCR可能成为临床预测直肠癌患者预后新的、方便易行的检测指标。
本研究尚存在一定局限性:无严格限定的放疗方案、手术方式,缺乏各放疗方案及手术方式间的组间比较;纳入研究的影响因素较少;未进一步研究临床分期和cCR对直肠癌患者预后的预测价值。在后续的研究中,将纳入更多的病例和影响因素,增加不同放化疗的组间比较,以进一步明确不同放化疗方案对直肠癌患者预后的影响,并测定不同放化疗方案预测直肠癌患者预后的价值,为其广泛投入临床应用奠定基础。
综上所述,晚期直肠癌患者接受放化疗后可以在一定程度上改善患者的预后,临床分期、是否cCR为影响直肠癌患者预后的独立危险因素,对直肠癌患者的预后具有一定的提示作用。因此,今后可进行多中心、大样本、前瞻性的研究,以明确放化疗对晚期直肠癌患者的具体影响。
[1]Schreuders EH,Ruco A,Rabeneck L,et al.Colorectal cancer screening:a global overview of existing programmes[J].Gut,2015,64(10):1637-1649.
[2]Boutron MC,Wilpart M,Faivre J.Diet and colorectal cancer[J].Eur J Cancer Prev,1991,Suppl 2:13-20.
[3]Breugom AJ,van Gijn W,Muller EW,et al.Adjuvant chemotherapy for rectal cancer patients treated with preoperative(chemo)radiotherapy and total mesorectal excision:a Dutch Colorectal Cancer Group(DCCG)randomized phaseⅠⅠⅠtrial[J].Ann Oncol,2015,26(4):696-701.
[4]Shin JS,Suh KW,Oh SY.Preoperative neutrophil to lymphocyte ratio predicts survival in patients with T1-2N0 colorectal cancer[J].J Surg Oncol,2015,112(6):654-657.
[5]董秋霞,宋岩,王兴元,等.伊立替康和奥沙利铂联合氟尿嘧啶类药物一线治疗晚期结直肠癌的临床观察[J].癌症进展,2016,14(2):155-158.
[6]中华人民共和国卫生和计划生育委员会医政医管局.中国结直肠癌诊疗规范(2015版)[J].中华消化外科杂志,2015,14(10):783-799.
[7]Chen ZY,Raghav K,Lieu CH,et al.Cytokine profile and prognostic significance of high neutrophil-lymphocyte ratio in colorectal cancer[J].Br J Cancer,2015,112(6):1088-1097.
[8]Trombold J,Farmer R W,Mccafferty M.The impact of colorectal cancer screening in a veteran hospital population[J].American Surgeon,2013,79(3):296-300.
[9]Adam R,de Gramont A,Figueras J,et al.Managing synchronous liver metastases from colorectal cancer:a multidisciplinary international consensus[J].Cancer Treat Rev,2015,41(9):729-741.
[10]De Rosa M,Pace U,Rega D,et al.Genetics,diagnosis and management of colorectal cancer(Review)[J].Oncol Rep,34(3):1087-1096.
[11]Rombouts AJ,Koh CE,Young JM,et al.Does radiotherapy of the primary rectal cancer affect prognosis after pelvic exenteration for recurrent rectal cancer?[J].Dis Colon Rectum,2015,58(1):65-73.
[12]Andersen B,Clemmesen T,Sprechler M,et al.Anastomotic recurrences and five-year survival rate after low anterior resection for cure in 128 patients with rectal cancer[J].Scand J Gastroenterol,1971,6(5):449-451.
[13]闫涛,苏俐,张星光.结直肠癌流行病学特征及其危险因素[J].疾病监测与控制,2015,9(4):241-243.
[14]Ⅰsella C,Terrasi A,Bellomo SE,et al.Stromal contribution to the colorectal cancer transcriptome[J].Nat Genet,2015,47(4):312-319.
[15]Schreuders EH,Ruco A,Rabeneck L,et al.Colorectal cancer screening:a global overview of existing programmes[J].Gut,2015,64(10):1637-1649.
[16]Hiratsuka T,Akagi T,Nakajima K,et al.Short-and longterm outcomes of neoadjuvant-synchronus S-1+radiotherapy for locally advanced rectal cancer:Multicenter phaseⅠⅠstudy[J].J Clin Oncol,2016,34(4_suppl):720.
[17]Simkens LH,van Tinteren H,May A,et al.Maintenance treatment with capecitabine and bevacizumab in metastatic colorectal cancer(CAⅠRO3):a phase 3 randomised controlled trial of the Dutch Colorectal Cancer Group[J].Lancet,2015,385(9980):1843-1852.
[18]Squire T,Buchanan G,Rangiah D,et al.Does chronomodulated radiotherapy improve pathological response in locally advanced rectal cancer?[J].ChronobiolⅠnt,2017,34(4):492-503.
