下调EZH 2基因对胃癌细胞株SGC7901增殖作用的影响
2018-06-13万倩邓野李弦王丹杨继元
万倩,邓野,李弦,王丹,杨继元#
1长江大学附属第一医院肿瘤科,湖北 荆州434000
2荆州市第一人民医院中心实验室,湖北 荆州434000
胃癌是常见的恶性肿瘤,在中国发病率居恶性肿瘤的第3位[1]。中国胃癌防治的现状是“一高三低”:发病、病死率高,早期诊断率低,手术根治率低,5年生存率低。尽管近年来胃癌的病死率有所下降,但仍严重威胁着人类的生命健康。中国胃癌患者往往因非特异性的消化道症状导致早期就诊率低,大多数患者确诊时已是晚期,错过最佳手术时机,因此在基因层面研究在胃癌发生、发展、增殖中起调控作用的基因是必要的。zeste基因增强子同源物 2(enhancer of zeste homolog 2,EZH2)是PcG基因家族中PRC2复合物的催化活性亚单位,与果蝇基因同源,它定位于人染色体7q35位置上[2],通过催化组蛋白H3第27位赖氨酸三甲基化(H3K27m3)参与表观遗传学和基因表达的调控[3]。多项研究显示,EZH2基因在许多肿瘤中都存在着过表达,并与肿瘤的生物学行为有关,如胃癌[4]、乳腺癌[5]等。这使其可能成为一个重要的早期诊断、评价预后的分子指标,更有可能成为肿瘤的靶向治疗的新靶点。本研究以靶向干扰下调EZH2基因的表达后,观察EZH2基因对胃癌细胞发生、发展、增殖调控的影响。
1 材料与方法
1.1 材料与试剂
SGC7901细胞、RPMⅠ1640培养基、含乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)胰蛋白酶、青霉素-链霉素均购自武汉普诺赛生命科技有限公司;胎牛血清购自四季青公司;磷酸盐缓冲液(PBS)由荆州市第一人民医院中心实验室保存;Lipo6000TM转染试剂、二甲基亚砜(dimethyl sulfoxide,DMSO)、RⅠPA裂解液、BCA蛋白浓度测定试剂盒、CCK-8试剂盒、焦碳酸乙二酯(diethyl pyrocarbonate,DEPC)、Tween-20、SDS-PAGE蛋白上样缓冲液、Beyo ECLPlus化学发光检测试剂、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)、四甲基乙二胺(tetramethylethylenediamine,TEMED)、Tris-HCL、过硫酸铵(ammonium persulfate,AP)、苯甲磺酰氟(phenylmethylsulfonylfluoride,PMSF)、30%Acr-Bis、RNAeasy™动物总RNA抽提试剂盒(离心柱式)、聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)、BeyoFast SYBR Green qPCR Mix、cDNA第一链合成试剂盒、蛋白分子量标准品、增强型CCK-8试剂盒均购自碧云天生物技术公司;三羟甲基氨基甲烷[Tris(hydroxymethyl)aminomethane,Tris]、甘氨酸、异丙醇购自上海阿拉丁生化科技股份有限公司;EZH2siRNA、EZH2引物、GAPDH引物均由百奥迈科生物技术公司合成,详见表1;兔抗人EZH2多克隆抗体、HRP标记的羊抗兔多克隆抗体购自美国GeneTex公司,兔抗β-actin多克隆抗体、抗体稀释液购自武汉安特捷生物技术有限公司。

表1 EZH 2干扰RNA序列片段
1.2 实验方法
1.2.1 细胞培养 将SGC7901细胞接种在有RPMⅠ1640培养基(含有10%胎牛血清、1%青霉素-链霉素双抗)的培养瓶中,于37℃、5%CO2恒温饱和湿度培养箱中培养2~3 d后,倒置显微镜下观察细胞呈致密单层后,用0.25%胰蛋白酶消化传代。
1.2.2 细胞转染 根据Genebank提供的EZH2基因序列(ⅠD:2146),使用在线设计软件,通过基因序列比对,合成3条特异性EZH2siRNA。取对数生长期胃癌SGC7901细胞,以每孔1×105个接种于六孔板中,当细胞汇合率达到55%~65%时按照Lipo6000TM转染试剂说明书进行转染步骤对上述3对EZH2siRNA片段(EZH2siRNA-1、EZH2siRNA-2、EZH2siRNA-3)进行转染,同时设立阴性对照组(转染非特异性siRNA片段)和空白对照组(不转染siRNA片段)。每孔siRNA为100 pmol,Lipo6000TM转染试剂用量为5 μl,转染后置入培养箱,6 h后换液,继续培养24~72 h后收集细胞。
1.2.3 细胞总RNA的抽提及qRT-PCR检测 将转染后48 h的各组细胞按照RNA抽提试剂盒和逆转录试剂盒说明书进行RNA的抽提和逆转录。紫外分光光度计检测RNA的纯度和浓度(OD260/OD280),置于-80℃冰箱保存。将总RNA逆转录为cDNA,以各组cDNA为模板对EZH2基因和内参GAPDH进行实时荧光定量PCR反应,优化实时定量多聚酶链式反应(real-time quantitative polymerase chain reaction,qRT-PCR)反应体系及条件,qRT-PCR反应体 系 为 20 μl,其 中 Beyo Fast SYBR Green qPCR Mix 10 μl、上下游引物各 0.5 μl、模板 2 μl、灭菌水7.2 μl,反应条件为95 ℃预变性5 min,95 ℃ 15 s,56℃15 s,72℃15 s,40个循环扩增后进行高分辨溶解曲线,每组设3个复孔。EZH2引物序列上游:5'-GCCAGACTGGGAAGAAATCTG-3',下 游 :5'-TGTGTTGGAAAATCCAAGTCA-3'。GAPDH上游:5'-GAAGGTGAAGGTCGGAGT-3',下游:5'-GAAGATGGTGATGGGATTTC-3'。实验结果采用 2-△△Ct法计算各组EZH2mRNA表达水平的相对值,选取干扰效果最好的EZH2siRNA片段进行后续实验。
1.2.4 蛋白质印迹法 取EZH2siRNA组、阴性对照组和空白对照组共3种细胞,将细胞用RⅠPA裂解液和PMSF处理,冰上孵育30 min,4℃12 000 rpm离心15 min,得上清蛋白。用BCA蛋白浓度测定试剂盒检测蛋白浓度。根据蛋白大小灌制10%分离胶和5%浓缩胶,每泳道上样20 μl,电泳后湿转法至PVDF膜,根据蛋白大小将膜剪开,用含5%脱脂奶粉的TBST液(封闭液)封闭PVDF膜,室温摇床封闭1 h后,将PVDF膜浸在一抗兔抗人EZH2多克隆抗体(1∶1000)中4℃孵育过夜,对照孵育一抗兔抗β-actin多克隆抗体(1∶5000),TBST 洗涤PVDF膜3次,每次10 min,再将PVDF膜浸在用封闭液稀释的HRP标记的羊抗兔二抗(1∶5000)中,室温摇床孵育1 h后用TBST洗膜3次,每次10 min,通过增强型化学荧光显色(enhanced chemiluminescence,ECL)法进行显影。
1.2.5 CCK- 8法检测细胞增殖能力 将传代4~6代的细胞用0.25%胰蛋白酶消化后计数,按每孔加入100 μl 2000个细胞的浓度接种96孔板,置37℃,5%CO2培养箱中培养18 h。更新培养基后培养2 h,设置空白对照组(有细胞培养液和CCK-8溶液而无细胞)、阴性对照组(有细胞和CCK-8溶液而未转染混合物)、siRNA组(有细胞、CCK-8溶液及转染混合物),每组设3个复孔,分别于转染后24、48、72、96 h每孔加入CCK-8溶液10 μl,在细胞培养箱内继续孵育1 h,酶标仪检测450 nm处吸光度OD值。每组细胞测3个孔,取平均值,绘制细胞生长曲线。所有实验均重复3次。
1.3 统计学方法
采用SPSS 18.0统-计软件进行数据分析,计量资料以均数±标准差(±s)表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 转染后EZH 2 mRNA的表达水平
胃癌细胞SGC7901转染EZH2siRNA后,经实时荧光定量PCR仪检测EZH2mRNA的表达,结果显示,以空白对照组为内参,siRNA-1组、siRNA-2组、siRNA-3组EZH2mRNA的相对表达量分别为(0.41±0.19)、(0.22±0.15)、(0.47±0.28),均低于阴性对照组的(1.11±0.38),差异均有统计学意义(P=0.008、0.002、0.011),其中siRNA-2组EZH2mRNA相对表达量最低,即EZH2siRNA-2组干扰效果最强,用于后续实验。阴性对照组与空白对照组比较,差异无统计学意义(P=0.458)。(图1)
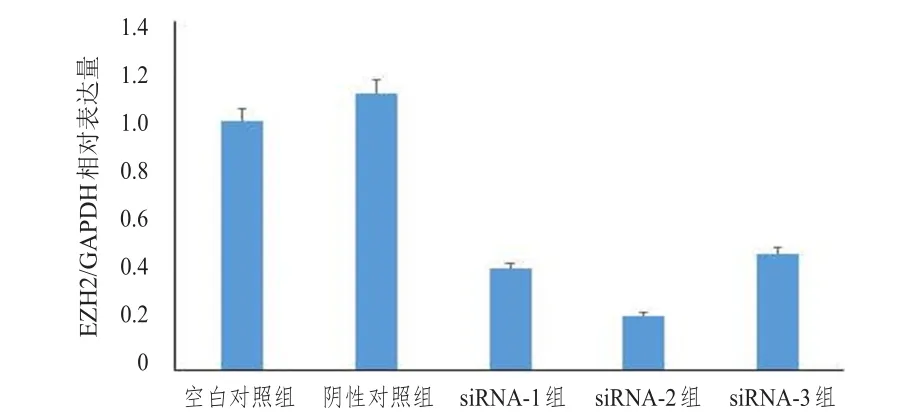
图1 各组胃癌SGC7901细胞转染siRNA后EZH 2 mRNA的相对表达量
2.2 转染后EZH 2蛋白表达水平
SGC7901胃癌细胞转染最佳干扰RNA片段后,经Western blot法检测EZH2蛋白相对表达量,结果显示,空白对照组、阴性对照组和siRNA干扰组的EZH2蛋白相对表达量分别为(0.362±0.026)、(0.398±0.036)、(0.036±0.017),3组比较,差异有统计学意义(F=157.745,P<0.01)。(图2)
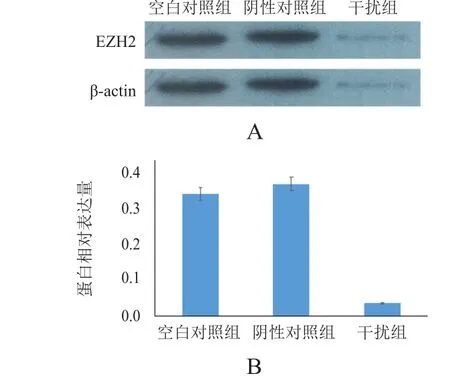
图2 胃癌SGC7901细胞转染后EZH 2蛋白表达水平
2.3 下调EZH 2基因对胃癌细胞SGC7901增殖的影响
采用CCK-8法检测下调EZH2表达后SGC7901细胞的增殖能力。相比于空白对照组和阴性对照组,siRNA组SGC7901细胞的增殖能力减弱,差异均有统计学意义(P<0.05)。(表2、图3)
表2 SGC7901细胞转染siRNA后随时间变化的细胞增殖力(OD450,±s)
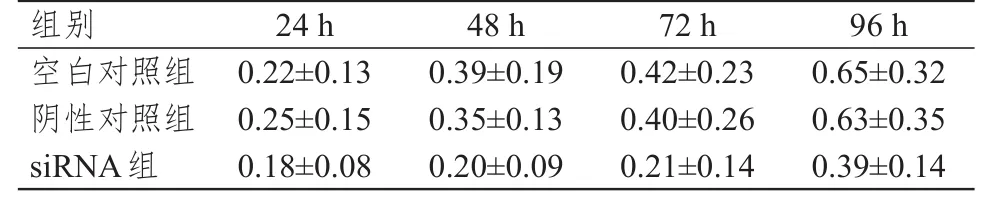
表2 SGC7901细胞转染siRNA后随时间变化的细胞增殖力(OD450,±s)
组别空白对照组阴性对照组siRNA组24 h 0.22±0.13 0.25±0.15 0.18±0.08 48 h 0.39±0.19 0.35±0.13 0.20±0.09 72 h 0.42±0.23 0.40±0.26 0.21±0.14 96 h 0.65±0.32 0.63±0.35 0.39±0.14

图3 SGC7901细胞转染EZH 2 siRNA后的细胞增殖能力
3 讨论
胃癌进展是多因素、多阶段及多基因变异的综合病变过程,主要是由端粒酶激活、抑癌基因失活和癌基因激活等引发[6]。Chen等[7]研究显示胃癌组织中的EZH2阳性表达率为56.6%,且与肿瘤体积、浸润层次、淋巴结转移、血行转移及临床恶性程度呈正相关,表明EZH2基因在胃癌的发生发展中有重要作用。另外,He等[8]对117例胃癌组织及其相应的正常组织中EZH2蛋白的水平进行了分析,结果显示:在70.1%的胃癌组织中,EZH2的表达阳性,而正常的胃黏膜上皮细胞中,只有5.4%是EZH2表达阳性,且EZH2高表达患者的平均总生存期(25.2个月)和无病生存期(20.2个月)均短于EZH2低表达的患者(40.5、35.9个月)。该结果说明EZH2可作为胃癌患者预后效果的预测和评估指标。
有研究表明,EZH2表达下调抑制细胞增殖是通过Wnt/β-catenin通路来实现的,在人肾癌ACHN细胞中下调EZH2基因表达抑制细胞增殖和侵袭的同时Wnt3a和β-catenin蛋白的表达也下调,相反Wnt/β-catenin通路阻滞药糖原合成酶激酶-3β(GSK-3β)的表达会显著提高[9],但在胃癌中的研究甚少。
本研究着重从细胞层面探讨了EZH2对胃癌细胞系SGC7901的细胞增殖调控作用。通过对细胞进行siRNA转染,以实现对细胞的EZH2基因沉默,并通过荧光定量PCR以及蛋白质印迹实验,证实了EZH2的基因下调。在此基础上,siRNA组的SGC7901细胞,其增殖能力较对照组下降,这也与以往的研究结果一致[9-12]。上述实验证据说明,EZH2的基因下调抑制了SGC7901胃癌细胞系的细胞增殖,EZH2基因在胃癌的发生发展中有着重要意义,为胃癌基因治疗提供一定的理论基础,但其作用通路及机制还有待进一步研究。
[1]陈万青,郑荣寿,张思维,等.2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016,25(1):1-10.
[2]Hillier LW,Fulton RS,Fulton LA,et al.The DNA sequence of human chromosome 7[J].Nature,2003,424(6945):157-164.
[3]Simon JA,Lange CA.Roles of the EZH2 histone methyltransferase in cancer epigenetics[J].Mutat Res,2008,647(1-2):21-29.
[4]Fu HL,Ma Y,Lu LG,et al.TET1 exerts its tumor suppressor function by interacting with p53-EZH2 pathway in gastric cancer[J].J Biomed Nanotechnol,2014,10(7):1217-1230.
[5]Mu Z,Li H,Fernandez SV,et al.EZH2 knockdown suppresses the growth and invasion of human inflammatory breast cancer cells[J].J Exp Clin Cancer Res,2013,32:70.
[6]Xin Y,Li XL,Wang YP,et al.Relationship between phenotypes of cell-function differentiation and pathobiological behavior of gastric carcinomas[J].World J Gastroenterol,2001,7(1):53-59.
[7]Chen H,Gu X,SuⅠH,et al.Polycomb protein Ezh2 regulates pancreatic beta-cellⅠnk4a/Arf expression and regeneration in diabetes mellitus[J].Genes Dev,2009,23(8):975-985.
[8]He LJ,Cai MY,Xu GL,et al.Prognostic significance of overexpression of EZH2 and H3k27me3 proteins in gastric cancer[J].Asian Pac J Cancer Prev,2012,13(7):3173-3178.
[9]Yuan JB,Yang LY,Tang ZY,et al.Down-regulation of EZH2 by RNA interference inhibits proliferation and invasion of ACHN cells via the Wnt/β-catenin pathway[J].Asian Pac J Cancer Prev,2012,13(12):6197-6201.
[10]Xia H,Yu CH,Zhang Y,et al.EZH2 silencing with RNAi enhances irradiation-induced inhibition of human lung cancer growth in vitro and in vivo[J].Oncol Lett,2012,4(1):135-140.
[11]Geng J,Li X,Zhou Z,et al.EZH2 promotes tumor progression via regulating VEGF-A/AKT signaling in nonsmall cell lung cancer[J].Cancer Lett,2015,359(2):275-287.
[12]Jiang T,Wang Y,Zhou F,et al.Prognostic value of high EZH2 expression in patients with different types of cancer:a systematic review with meta-analysis[J].Oncotarget,2016,7(4):4584-4597.
