干扰小RNA沉默CAV 1表达对人绒毛膜癌JEG- 3细胞侵袭、迁移能力的影响及其作用机制研究
2018-06-13陈静鸽周斌王川红程玉敏周新华李新敏王陈英乔文菲
陈静鸽,周斌,王川红,程玉敏,周新华,李新敏,王陈英,乔文菲
郑州市妇幼保健院1住院部,2病理科,3检验科,郑州450000
4新乡医学院医学系,河南 新乡453000
妊娠性滋养细胞肿瘤在中国的发病率较高,是一种发生于胎盘绒毛滋养细胞的恶性肿瘤,其中以绒毛膜癌最为常见[1]。正常滋养细胞具有侵入血管和组织的能力,当该类细胞发生病变成为肿瘤时,则具有更强的浸润、破坏和转移能力[2]。近年来,随着现代技术的进步,绒毛膜癌的病死率明显降低,采用有效的化疗药物治疗是其常用的治疗方法。但由于绒毛膜癌细胞具有较强的侵袭能力,易发生早期转移,故预后极差[3]。因此,研究如何抑制绒毛膜癌细胞的侵袭和迁移能力成为临床上迫切需要解决的问题。小窝蛋白-1(caveolin-1,CAV1)是一种细胞支架蛋白,参与细胞的增殖、分化、信号转导、侵袭、迁移等过程[4]。近年来的报道表明,CAV1对多种肿瘤如甲状腺癌[5]、食管癌[6]、子宫内膜癌[7]等的发生发展具有重要作用,但CAV1在绒毛膜癌中的作用尚不完全清楚,因此本文通过RNA干扰(RNA interference,RNAi)技术下调人绒毛膜癌JEG-3细胞中CAV1的相对表达量,旨在探究其对人绒毛膜癌JEG-3细胞侵袭、迁移能力的影响及其作用机制,现报道如下。
1 材料与方法
1.1 主要试剂与仪器
人绒毛膜癌细胞系JEG-3购自中国科学院动物研究所,培养基(RPMⅠ-1640)、胰蛋白酶均购自美国Hyclon公司,胎牛血清购自杭州四季青公司,青霉素、链霉素均购自河北省华北制药有限公司,LipofectamineTM2000脂质体转染试剂购自美国Ⅰnvitrogen公司,Transwell侵袭、迁移小室购自美国Corning Costar公司,化学合成干扰小RNA(small interfering RNA,siRNA)购自上海吉玛公司,CAV1抗体购自美国Santa Cruz公司,丝氨酸/苏氨酸蛋白激酶(serine/threonine kinase,AKT)抗体、雷帕霉素靶蛋白(mechanistic target of rapamycin,MTOR)抗体、p70核糖体蛋白S6激酶(p70 ribosomal protein S6 kinase,p70S6K)抗体、磷酸化 AKT(p-AKT)抗体、磷酸化MTOR(p-MTOR)抗体、磷酸化p70S6K(p-p70S6K)抗体均购自美国Cell Signaling Technology公司,β-肌动蛋白(β-actin)抗体购自北京中杉金桥技术有限公司,HRP标记山羊抗兔ⅠgG购自武汉博士德公司。微量加样枪购自德国Eppendorf公司,倒置显微镜购自日本Nikon公司,酶标仪购自美国Bio-Tek公司,细胞培养箱购自美国Thermo公司。
1.2 方法
1.2.1 细胞培养 将JEG-3细胞冻存管置于37℃水浴箱中快速溶化,1500 r/min离心5 min,加入5 ml培养基重悬细胞,在5%CO2,37℃培养箱中培养。待细胞密度达到80%左右,弃去培养基,加入0.25%胰酶消化细胞,按1∶3的比例进行传代,每隔2 d传代一次。
1.2.2 细胞转染0.25%胰酶消化对数生长期JEG-3细胞,以2×105/孔细胞接种于6孔板上,培养于37℃培养箱中,待细胞融合度达到80%左右进行转染。实验共分为3组:对照组,只加入LipofectamineTM2000,不进行转染;阴性组:转染siRNA-NC;siRNA-CAV1组:转染siRNA-CAV1。将细胞培养基更换为无血清培养基。将4 μg siRNA-NC及 4 μg siRNA-CAV1 分别加至 250 μl无血清培养基中进行稀释,将5 μl LipofectamineTM2000加至50 μl无血清培养基中进行稀释,将稀释后的混合物轻轻混匀,37℃静置20 min,形成siRNA-CAV1-LipofectamineTM2000复合物,将复合物加入6孔板中,培养6 h,将培养基更换为含10%胎牛血清的培养基,培养24 h后收集细胞。蛋白质印迹法(Western blot)检测转染效率。
1.2.3 实时定量PCR 采用实时定量PCR(qRTPCR)检测转染细胞中CAV1mRNA的水平。利用Primer 5.0软件设计CAV1基因的引物序列,上游序列为5'-ATGTCTGGGGGCAAATAC-3',下游序列为5'-TTATATTTCTTTCTGCAAGTTG-3',由上海生物工程技术有限公司进行合成,转染细胞经培养箱培养后,加入1 ml TRⅠzon细胞裂解液提取2×107个细胞中的总RNA,去除基因组DNA,采用反转录试剂盒合成cDNA,以GAPDH为参照,进行扩增。反应体系为25 μl,扩增条件为94℃10 min预变性,94℃ 10 s,58 ℃/60℃ 15 s,72 ℃ 30 s,共40个循环。使用2-ΔΔCt方法计算CAV1mRNA的表达水平。实验重复3次。
1.2.4 细胞侵袭能力检测 采用Transwell法检测JEG-3细胞侵袭能力。0.25%胰酶消化对数生长期JEG-3细胞,加入无血清培养基调整Matrigel胶浓度为 1.7 μg/μl,将稀释好的 Matrigel胶均匀铺在Transwell小室上室膜中,37℃通风4~5 h,备用。以每孔4×104个细胞接种于小室上室中,下室中加入600 μl新鲜的完全培养基作为趋化因子,Transwell小室置于24孔板中,37℃培养箱中培养18 h后,采用无菌棉签轻轻擦去小室膜上的细胞,4%的多聚甲醛固定30 min,苏木精染色40 min,磷酸盐缓冲液(phosphate buffer saline,PBS)漂洗后置于倒置显微镜中观察,随机选取5个视野,取平均值,每孔3个复孔。
1.2.5 细胞迁移能力检测 采用Transwell法检测细胞迁移能力。实验方法同“1.2.4”,但在接种细胞前无需在Transwell小室上室中铺Matrigel胶。倒置显微镜下计算迁移细胞数目。
1.2.6 Western blot检测AKT/MTOR/p70 S 6 K信号通路蛋白的表达 加入2 ml PBS漂洗细胞2次,离心收集细胞,加入一定体积的RⅠPA细胞裂解液,在冰上裂解30 min,收集上清(上清即为所提取的总蛋白)。采用BAC法进行蛋白质定量。将蛋白质样品按4∶1的比例加入5×上样缓冲液,置于100℃中加热10 min。配置8%的分离胶,每孔加入40 μg样品蛋白,80 V电泳直至蛋白质条带完全分离。切下目的蛋白凝胶,在300 mA电流下将目的蛋白转移至PVDF膜上,内参β-actin的转膜时间为70 min,其他蛋白质的转膜时间为180 min。转膜后将PVDF膜浸润在5%脱脂牛奶中封闭1 h。加入各蛋白质一抗,4℃下过夜结合,TBST清洗3次,每次10 min,加入二抗,室温孵育60 min,TBST清洗3次后加入化学发光剂,暗室中曝光至条带明显,以β-actin为内参,Quantity One分析 CAV1、AKT、MTOR、p70S6K、p-AKT、p-MTOR、p-p70S6K蛋白质的灰度值。
1.3 统计学分析
采用SPSS 21.0软-件对数据进行分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 CAV 1 mRNA和蛋白相对表达量的比较
采用qRT-PCR和Western blot法分别检测转染后JEG-3细胞中CAV1mRNA和蛋白的相对表达量,结果显示:siRNA-CAV1组、阴性组、对照组JEG-3细胞中CAV1mRNA和蛋白的相对表达量比较,差异均有统计学意义(P<0.01);siRNA-CAV1组JEG-3细胞中CAV1蛋白和mRNA的相对表达量均较对照组降低,差异均有统计学意义(P<0.05);阴性组JEG-3细胞中CAV1蛋白和mRNA的相对表达量与对照组比较,差异均无统计学意义(P>0.05)。(表1)
表1 不同组别JEG- 3细胞中CAV 1 mRNA及蛋白相对表达量的比较( n= 3,±s)
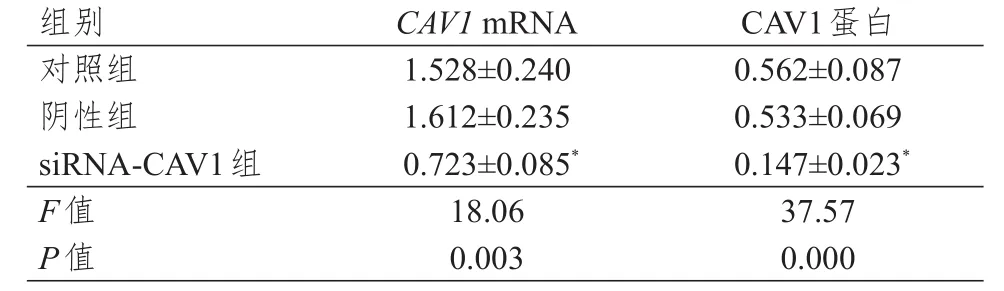
表1 不同组别JEG- 3细胞中CAV 1 mRNA及蛋白相对表达量的比较( n= 3,±s)
注:*与对照组比较,P<0.05
组别对照组阴性组siRNA-CAV1组F值P值1.528±0.240 1.612±0.235 0.723±0.085*18.06 0.003 0.562±0.087 0.533±0.069 0.147±0.023*37.57 0.000 CAV1 mRNA CAV1蛋白
2.2 干预CAV 1表达对细胞侵袭能力的影响
siRNA-CAV1组、阴性组、对照组JEG-3细胞的侵袭数目比较,差异有统计学意义(P<0.01)。与对照组相比,siRNA-CAV1组JEG-3细胞的侵袭数目减少,差异有统计学意义(P<0.05);阴性组与对照组JEG-3细胞的侵袭数目比较,差异无统计学意义(P>0.05)。(表2)
2.3 干预CAV 1表达对细胞迁移能力的影响
siRNA-CAV1组、阴性组、对照组JEG-3细胞的迁移数目比较,差异有统计学意义(P<0.01)。与对照组相比,siRNA-CAV1组JEG-3细胞的迁移数目减少,差异有统计学意义(P<0.05);阴性组与对照组JEG-3细胞的迁移细胞数目比较,差异无统计学意义(P>0.05)。(表3)
表2 不同组别JEG- 3细胞侵袭数目的比较( n= 3,±s)

表2 不同组别JEG- 3细胞侵袭数目的比较( n= 3,±s)
注:*与对照组比较,P<0.05
组别对照组阴性组siRNA-CAV1组F值P值236.67±28.64 241.37±25.77 123.49±23.86*19.53 0.002侵袭数目
表3 不同组别JEG- 3细胞迁移数目的比较( n= 3,±s)

表3 不同组别JEG- 3细胞迁移数目的比较( n= 3,±s)
注:*与对照组比较,P<0.05
组别对照组阴性组siRNA-CAV1组F值P值135.27±23.67 142.60±28.64 63.86±7.21*11.89 0.008迁移数目
2.4 干预CAV 1表达对AKT/MTOR/p70S6K信号通路蛋白的影响
siRNA-CAV1组、阴性组、对照组JEG-3细胞中AKT、p-AKT、MTOR、p-MTOR、p70S6K、p-p70S6K蛋白的表达水平比较,差异均有统计学意义(P<0.01);siRNA-CAV1组JEG-3细胞中AKT、p-AKT、MTOR、p-MTOR、p70S6K、p-p70S6K蛋白的表达水平均低于对照组,差异均有统计学意义(P<0.05);阴性组与对照组JEG-3细胞中AKT、p-AKT、MTOR、p-MTOR、p70S6K、p-p70S6K蛋白的表达水平比较,差异均无统计学意义(P>0.05)。(表4)
3 讨论
既往研究表明,绒毛膜癌细胞的侵袭、迁移过程受多种因素的影响,是一个复杂的过程[8]。绒毛膜癌是一种恶性肿瘤,严重威胁着人类的健康。绒毛膜癌细胞具有较高的侵袭和迁移能力,在绒毛膜癌早期可以通过血液运输转移至全身,严重影响绒毛膜癌的治疗效果,其中脑转移最为常见,也是绒毛膜癌病死率较高的原因之一。因此,研究基因在绒毛膜癌侵袭、迁移中的作用机制,为绒毛膜癌的基因治疗提供新的思路已成为目前研究的热点之一。RNAi技术是通过化学合成、体外转录、降解核酸内切酶等方式特异性沉默靶基因的技术,具有瞬时转染沉默的效应,目前RNAi技术已成为研究基因功能的有效工具。CAV1是一种细胞膜中重要的支架蛋白,分子量为21~24 kD,对细胞内信号转导、脂类代谢、细胞生长及细胞的侵袭和迁移等方面具有重要意义[9]。相关研究表明,CAV1参与多种肿瘤的发生、发展过程,比如肺癌、乳腺癌及前列腺癌[10-12]。近年来的研究表明,CAV1既可以作为一个抑癌因子参与肿瘤的演进过程,又可以作为一个原癌基因促进肿瘤的发生发展[13]。相关研究证实,乳腺癌中CAV1的表达水平与肿瘤细胞的增殖、自噬以及患者预后有关[14]。为了探究CAV1在绒毛膜癌细胞侵袭、迁移中的作用,本研究通过siRNA介导的RNAi技术干扰CAV1在绒毛膜癌JEG-3细胞中的表达,研究其对细胞侵袭、迁移能力的影响,结果显示下调绒毛膜癌中CAV1的表达水平可以抑制细胞的侵袭和迁移能力。
表4 不同组别JEG- 3细胞AKT/MTOR/p70 S 6 K信号通路相关蛋白表达水平的比较( n= 3,±s)
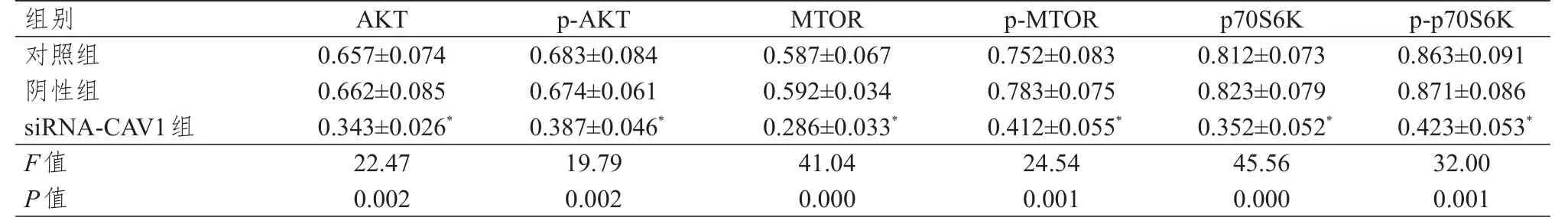
表4 不同组别JEG- 3细胞AKT/MTOR/p70 S 6 K信号通路相关蛋白表达水平的比较( n= 3,±s)
注:*与对照组比较,P<0.05
组别对照组阴性组siRNA-CAV1组F值P值0.657±0.074 0.662±0.085 0.343±0.026*22.47 0.002 0.683±0.084 0.674±0.061 0.387±0.046*19.79 0.002 0.587±0.067 0.592±0.034 0.286±0.033*41.04 0.000 0.752±0.083 0.783±0.075 0.412±0.055*24.54 0.001 0.812±0.073 0.823±0.079 0.352±0.052*45.56 0.000 0.863±0.091 0.871±0.086 0.423±0.053*32.00 0.001 AKT p-AKT MTOR p-MTOR p70S6K p-p70S6K
AKT介导的信号通路与细胞的增殖、分化、侵袭关系较为密切,可调控肿瘤细胞周期蛋白和细胞蛋白的合成,对肿瘤的血管生成具有重要作用[15]。该通路的激活可以促进细胞增殖,抑制细胞凋亡,促进细胞有丝分裂的进行,参与多种肿瘤的发生、发展过程[16]。AKT主要通过N端的PH结构域与3,4,5-三磷酸磷脂酰肌醇结合,同时通过磷脂酰依赖性激酶激活丝氨酸和苏氨酸而被活化,从而激活下游靶基因MTOR,进而介导下游重要的信号转导因子p70S6K磷酸化,最终调控肿瘤细胞的生长、分化、周期、侵袭等[17]。MTOR参与细胞的有丝分裂进程,主要调控G1期和S期蛋白的合成,MTOR磷酸化被抑制可阻滞细胞周期,从而诱导细胞凋亡[18]。p70S6K是MTOR信号通路下游的一个重要的靶基因,可被MTOR激活形成p-p70S6K,调控核糖体蛋白的合成和mRNA的转录翻译,促进肿瘤细胞的分化、增殖[19]。大量的研究表明,多种基因表达量的变化均可通过调控AKT/MTOR信号通路参与乳腺癌、肝癌、肺癌等肿瘤细胞的生长、分化、侵袭、凋亡[20]。研究表明,MTOR信号通路阻断药雷帕霉素可以抑制绒毛膜癌细胞的增殖,诱导其凋亡,降低细胞的侵袭能力[21]。目前关于AKT/MTOR信号通路对绒毛膜癌细胞增殖、侵袭、迁移、凋亡的研究不多,本实验通过Western blot检测经siRNA特异性干扰CAV1表达的绒毛膜癌细胞中AKT、MTOR、p70S6K以及磷酸化水平发现,AKT、MTOR、p70S6K、p-AKT、p-MTOR、p-p70S6K的表达量明显降低,表明干扰CAV1对绒毛膜癌细胞侵袭、迁移能力的抑制作用与AKT/MTOR/p70S6K信号通路有关。
综上所述,RNAi技术下调绒毛膜癌JEG-3细胞中CAV1的表达水平可抑制细胞的侵袭及迁移能力,诱导细胞凋亡,其作用机制与AKT/MTOR/p70S6K信号通路有关,为绒毛膜癌的基因治疗提供了新的靶点。
[1]Stichelbout M,Devisme L,Franquet-Ansart H,et al.SALL4 expression in gestational trophoblastic tumors:a useful tool to distinguish choriocarcinoma from placental site trophoblastic tumor and epithelioid trophoblastic tumor[J].Hum Pathol,2016,54:121-126.
[2]Liu S,Fan C,Feng F,et al.Prognosis of gestational choriocarcinoma diagnosed incidentally during laparoscopy for a presumed cornual pregnancy:a report of five cases[J].Cancer Biol Med,2017,14(2):191-193.
[3]Sekiya Y,Yamamoto E,Niimi K,et al.c-rel promotes invasion of choriocarcinoma cells via PⅠ3K/AKT signaling[J].Oncology,2017,92(5):299-310.
[4]袁碧英,易斌,鲁开智.Caveolin-1在肿瘤中的作用机制的研究进展[J].中国医学创新,2014,11(6):129-131.
[5]赵乐,唐萃,杨磊,等.Caveolin-1、GPR30和Vimentin在甲状腺乳头状癌组织中的表达及意义[J].中国免疫学杂志,2015,31(11):1510-1514.
[6]范玉宏,周海丰,侯占富,等.Caveolin-1和β-catenin在食管鳞癌中的表达及临床意义[J].山西医科大学学报,2017,48(7):706-710.
[7]韩燕燕,朱俊宝,李淑华.Caveolin-1在子宫内膜癌组织中的表达及临床意义[J].中国癌症防治杂志,2017,9(3):201-204.
[8]Wang Y,Xue K,Guan Y,et al.Long non-coding RNA LⅠNC00261 suppresses cell proliferation and invasion and promotes cell apoptosis in human choriocarcinoma[J].Oncol Res,2017,25(5):733-741.
[9]Mi L,Zhu F,Yang X,et al.The metastatic suppressor NDRG1 inhibits EMT,migration and invasion through interaction and promotion of caveolin-1 ubiquitylation in human colorectal cancer cells[J].Oncogene,2017,36(30):4323-4335.
[10]Caiola E,Marrazzo E,Alesci S,et al.ΔNp73beta induces caveolin-1 in human non-small cell lung cancer cell line H1299[J].Tumor Biol,2016,37(2):2015-2021.
[11]Joglekar M,Elbazanti WO,Weitzman MD,et al.Caveolin-1 mediates inflammatory breast cancer cell invasion via the Akt1 pathway and RhoC GTPase[J].J Cell Biochem,2017,118(5):1273.
[12]Mahmood J,Murti SC,Zaveri SR,et al.Caveolin-1:a novel prognostic biomarker for radioresistance in non-small cell lung carcinoma(NSCLC)and prostate cancer[J].Ⅰnt J Radiat Oncol Biol Phys,2016,96(2):E589-E590.
[13]李庆伟,周莹,逄越.Caveolin-1结构、功能及其与肿瘤的关系[J].辽宁师范大学学报(自然科学版),2017,40(2):232-238.
[14]石小玉,肖亮,熊丽霞,等.Caveolin-1 siRNA对与乳腺癌细胞共培养的成纤维细胞自噬体表达影响的研究[J].中国细胞生物学学报,2015,37(2):212-220.
[15]Wang Z,Li Y,Banerjee S,et al.Down-regulation of notch-1 and jagged-1 inhibits prostate cancer cell growth,migration and invasion,and induces apoptosis via inactivation of Akt,mTOR,and NF-B signaling pathways(retraction of vol 109,pg 726,2010)[J].J Cell Biochem,2016,117(8):1960.
[16]Qian B,Yao Y,Liu C,et al.SU6668 modulates prostate cancer progression by downregulating MTDH/AKT signaling pathway[J].Ⅰnt J Oncol,2017,50(5):1601-1611.
[17]Liang Q,Luo Z,Zeng J,et al.Zika virus NS4A and NS4B proteins deregulate Akt-mTOR signaling in human fetal neural stem cells to inhibit neurogenesis and induce autophagy[J].Cell Stem Cell,2016,19(5):663-671.
[18]Allen E,Miéville P,Warren CM,et al.Metabolic symbiosis enables adaptive resistance to anti-angiogenic therapy that is dependent on mTOR signaling[J].Cell Rep,2016,15(6):1144-1160.
[19]Renard J,Loureiro M,Rosen LG,et al.Cannabidiol counteracts amphetamine-induced neuronal and behavioral sensitization of the mesolimbic dopamine pathway through a novel mTOR/p70S6 kinase signaling pathway[J].J Neurosci,2016,36(18):5160-5169.
[20]Yip PY.Phosphatidylinositol 3-kinase-AKT-mammalian target of rapamycin(PⅠ3K-Akt-mTOR)signaling pathway in non-small cell lung cancer[J].Transl Lung Cancer Res,2015,4(2):165-176.
[21]Zhang Y,Hu X,Gao G,et al.Autophagy protects against oxidized low density lipoprotein-mediated inflammation associated with preeclampsia[J].Placenta,2016,48:136-143.
