甘露糖化羧甲基壳聚糖与依替膦酸复合物纳米粒靶向结合M 2型巨噬细胞的实验研究
2018-06-13黄燕蒋鸥文庆莲刘宇林盛何玉吴敬波孟凡智马成
黄燕,蒋鸥#,文庆莲,刘宇,林盛,何玉,吴敬波,孟凡智,马成
1西南医科大学附属医院肿瘤科,四川泸州646000
2西南医科大学附属内江市第二人民医院肿瘤中心,四川内江641100
肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)即肿瘤微环境内聚集着大量的巨噬细胞。TAM可以粗略地分为M1型巨噬细胞和M2型巨噬细胞。M1型巨噬细胞具有吞噬、清除异物及抗肿瘤的作用,而M2型巨噬细胞主要发挥免疫抑制的功能,对肿瘤的发生、发展和浸润具有促进作用[1]。外周单核细胞在肿瘤细胞分泌的催化因子的作用下,迁移至肿瘤微环境中,并分化成M2型巨噬细胞[2],M2型巨噬细胞是肿瘤微环境中主要的炎性细胞成分。M2型巨噬细胞的特点为高表达甘露糖受体,而其他细胞一般不表达或呈低表达[3]。研究发现,采用抗甘露糖受体的单克隆抗体封闭M2型巨噬细胞表达的甘露糖受体后,能够加强肿瘤的抗原呈递作用,强化肿瘤免疫应答[4];同时可以减少病灶的淋巴结转移[5]。由此推断,M2型巨噬细胞表面的甘露糖受体可作为肿瘤靶向治疗的靶点[6]。本研究通过缩合反应将甘露糖基接枝于壳聚糖上,利用壳聚糖与依替膦酸之间发生的离子交联反应,构建纳米粒。观察纳米粒与多种细胞,尤其是M2型巨噬细胞的结合能力,为后期的基础实验提供依据,现报道如下。
1 材料与方法
1.1 材料
2-吗啉乙磺酸(2-morpholinoethanesulfonic acid,MES)、羟甲基壳聚糖(carboxymethyl chitin,CMC)、1(-3-二甲氨基丙基)-3乙基碳二亚胺盐酸盐[1-Ethyl-3(-3-dimethylaminopropyl)carbodiimide,EDC]、佛 波 酯(phorbol-12-myristate-13-acetate,PMA)、N-羟基丁二酰亚胺(N-Hydroxy succinimide,NHS)、脂多糖(lipopolysaccharide,LPS)和异硫氰酸荧光素(fluorescein isothiocyanate isomerⅠ,FⅠTC)均购自美国Sigma公司;Bruker超导脉冲傅立叶变换核磁共振波谱仪购自瑞士Bruker公司;依替膦酸二钠购自南京森贝伽生物科技有限公司;电镜购自荷兰SEⅠ公司;U937细胞由四川大学华西科技园提供;γ-干扰素(interferon-γ,ⅠFN-γ)、白细胞介素-4(interleukin-4,ⅠL-4)和白细胞介素-13(interleukin-13,ⅠL-13)均购自上海拜力生物科技有限公司;SW620人结肠癌细胞和A549人肺癌细胞均由西南医科大学附属医院肿瘤学实验室提供;成纤维细胞由西南交通大学生物材料学与分子实验室提供;细胞膜红色荧光探针(1,1'-dioctadecyl-3,3,3',3'-tetramethylindocarbocyanine perchlorate,DiⅠ)购自江苏凯基生物技术股份有限公司;Bx-51荧光显微镜购自奥林巴斯公司;荧光酶标仪购自美国Thermo Scientific公司。
1.2 研究方法
1.2.1 合成甘露糖化壳聚糖 参考相关文献的方法合成甘露糖化壳聚糖[7],并对方法进行了一定的改良。取MES 6 g溶于300 ml的蒸馏水,应用氢氧化钠调整PH值为5.2,配置浓度为20 mg/ml的MES溶液;分别取CMC和对氨基苯酚甘露糖100 mg溶解于100 ml的MES溶液,搅拌至清澈透明液体;再将704 mg的EDC及70 mg的NHS加入到上述液体中混合搅拌,30℃搅拌至液体干涸;将50 ml的MES溶液加入干涸合成物,室温搅拌至完全溶解,利用滤纸及过滤器过滤产物,清洗沉淀3次,收集液体加入截留分子量为800的透析袋中,清水透析7 d清除小分子物质;将所得液体冷冻干燥,得到产物甘露糖化壳聚糖。
对氨基苯酚甘露糖的苯环上有4个处于对称位置的氢,在核磁共振氢谱的δ=7.5~7.6 ppm处出现波峰,而羧甲基壳聚糖的氢均在5 ppm以下。采用Bruker超导脉冲傅立叶变换核磁共振波谱仪检测反应物的氢谱图,判断甘露糖是否成功接枝在壳聚糖上。
1.2.2 构建纳米粒 将上述产物溶于蒸馏水,配置成甘露糖化壳聚糖溶液,浓度为4 mg/ml,搅拌至清澈透明液体,调整PH值为6;取依替膦酸二钠溶于蒸馏水中,调整PH值为6,配置成依替膦酸二钠溶液,浓度为2 mg/ml。将依替膦酸溶液逐滴滴加于甘露糖化壳聚糖溶液中,室温搅拌15 min,得到纳米产物。
将上述产物放入透析袋(截留分子量为800)中,于清水透析24 h,透析后所得的溶液再进行冷冻干燥2 d。产物即为甘露糖修饰壳聚糖与依替膦酸复合物纳米粒(mannose modified chitosan and etidronic acid complex nanoparticlesmannose modified chitosan and etidronic acid complex nanoparticles,MCMC)。电镜下直接观察纳米粒的形态及粒径。
1.2.3 制作体外细胞摄取纳米粒的模型 取对数期生长期的U937细胞5×105/ml加入6孔板中,每孔2 ml,每孔加入佛波酯200 ng/ml,诱导6 h后,诱导成巨噬细胞(称M0型巨噬细胞),再加入LPS(100 ng/ml)及 ⅠFN-γ(20 ng/ml)继续诱导 66 h(共72 h),向M1型巨噬细胞方向诱导;U937细胞用佛波酯200 ng/ml诱导6 h后再加入20 ng/ml的ⅠL-4及20 ng/ml的ⅠL-13,继续诱导66 h(共72 h),向M2型巨噬细胞方向诱导。
将诱导的M1型巨噬细胞、M2型巨噬细胞、SW620人结肠癌细胞和A549人肺癌细胞和成纤维细胞分别接种至6孔培养板中,细胞数为1×106/孔,于培养箱中培养至对数生长期后,每组均加入纳米粒(每100 μl细胞悬液加入20 ng)培育3 h。每组设置3个复孔,实验重复3次。
1.2.4 荧光显微镜观察细胞摄取纳米粒情况MCMC配置成浓度为1 mg/ml的悬浮液,搅拌均匀后加入FⅠTC荧光剂,质量比为1∶50,在避光的条件下室温搅拌4~6 h。将搅拌完成后的颗粒悬浮液在清水中透析2~3 d(全程避光)。透析完成后即得到标记成功的颗粒,肉眼可见绿色。FTⅠC激发波长为495 nm,发射波长为519 nm,细胞如果吞噬纳米粒,在胞质内可呈现绿色荧光。
细胞膜红色荧光染料DiⅠ可将细胞膜染为红色(激发波长为549 nm,发射波长为565 nm),可区别于FⅠTC对纳米颗粒的绿色荧光。每个培养板加入DiⅠ,培养3 min,用培养基洗涤染色介质2次。将各组贴壁细胞刮离、收集后封片,在Bx-51荧光显微镜下先于同一视野内调整至DiⅠ染剂激发波,使细胞膜呈现橙红色荧光,再调整激发波长为495 nm,使纳米颗粒的绿色荧光显现。然后将两张图片经计算机软件进行图像融合后观察同一视野内细胞摄取纳米颗粒能力的情况。
1.2.5 测定各组细胞摄取纳米粒的量 按1.2.3的步骤培养细胞,收集各组培养板细胞,每组设置3个复孔,实验重复3次。收集每组中培养板复孔的细胞,弃培养基,用磷酸盐缓冲液(PBS)洗涤贴壁细胞3次,用1 ml的PBS混匀细胞,分别加入96孔板各孔中,各组细胞用未加纳米粒的同种细胞作为对照,使用荧光酶标仪检测激发波长为485 nm、发射波长为538 nm的FⅠTC的荧光强度,荧光酶标仪检测的结果以相对荧光值(relative fluorescence unit,RFU)表示。
1.3 统计学方法
采用SPSS 17.0软件-对数据进行统计分析,计量资料以均数±标准差(±s)表示,5种细胞摄取纳米粒的RFU之间的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 纳米颗粒合成结果检测
通过电镜观察纳米颗粒,呈圆形或类圆形,大小约为100 nm,详见图1。通过600 MHz核磁共振氢谱检测发现,在7.56 ppm处出现了明显的波峰,表明壳聚糖成功接枝于甘露糖。
2.2 各种细胞对纳米颗粒的摄取情况

图1 8万倍电镜下的纳米颗粒
DiⅠ未与细胞膜脂质双分子层结合前不发光,结合后呈现红色荧光,可标记细胞膜,而FⅠTC可与纳米药物MCMC结合后发黄绿色荧光,因此,在荧光显微镜下能够清晰地显示MCMC与细胞的关系。如图2所示,M1型巨噬细胞的红色荧光对应处未观察到绿色荧光出现,说明M1型巨噬细胞对MCMC未见肉眼可分辨的吞噬;其他3种细胞的情况与M1型巨噬细胞类似。M2型巨噬细胞因大量吞噬了纳米颗粒,显示明亮的绿色荧光,绿色荧光与红色荧光所表明的细胞位置一一对应,并且图像融合后荧光颜色明显变化。(图2)
2.3 纳米颗粒在各种细胞中的RFU值
采用荧光酶标仪检测M1型巨噬细胞、M2型巨噬细胞、人结肠癌细胞SW620、人肺癌细胞A549和成纤维细胞这5种细胞的RFU值,分别为(3.59±0.23)、(18.80±0.47)、(3.45±0.05)、(3.39±0.17)和(3.41±0.29)。单因素方差分析结果显示,5种细胞的RFU值比较,差异有统计学意义(F=13606.0,P<0.01),其中,M2型巨噬细胞的RFU值最高,而其他细胞之间的RFU值相近。
3 讨论
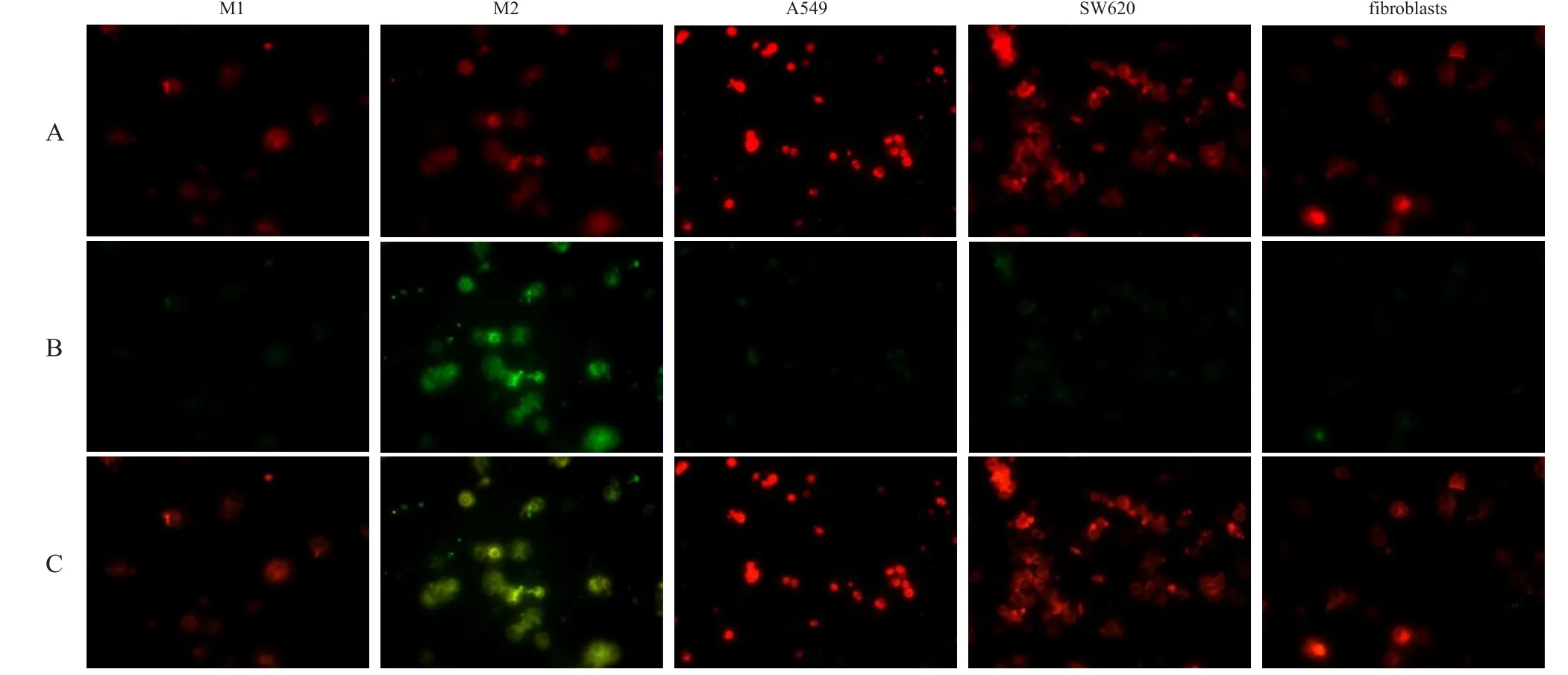
图2 5种细胞对纳米粒的摄取情况
恶性肿瘤常常伴有炎性浸润,与肿瘤的发展有着密切的关系[8]。M2型巨噬细胞是肿瘤微环境中的主要炎性细胞[9]。M2型巨噬细胞分泌血管内皮生长因子A(vascular endothelial growth factor-A,VEGF-A)、表皮生长因子(epidermal growth factor,EGF)和趋化因子CXCL8等多种细胞因子促进肿瘤细胞的增殖和浸润[10]。另外,M2型巨噬细胞高表达 ⅠL-10,低表达 ⅠL-12,以及转化生长因子β(transforming growth factor-β,TGF-β)和趋化因子表达CCL22(CC chemokines 22,CCL22)上调,驱动肿瘤病灶内的免疫抑制微环境的形成[11],说明了M2型巨噬细胞具有免疫调节的作用,可通过调节免疫应答和免疫逃逸促进肿瘤的进展。M2型巨噬细胞还参与调节自身微环境的代谢,与干细胞相互作用,促进肿瘤的发展[12-14]。Zhang等[15]研究发现,巨噬细胞可以影响化疗效果以及肿瘤的复发。M2型巨噬细胞在肿瘤的进展中发挥着重大的推动作用。目前已经有以M2型巨噬细胞作为靶点的抗肿瘤研究[16],所以通过靶向作用M2型巨噬细胞,阻止肿瘤的进展,是一种可能的抗肿瘤途径。
本研究显示,该纳米粒对M2型巨噬细胞具有明显的靶向性结合能力,而对成纤维细胞无此作用,说明纳米粒对正常细胞的影响较小;M2型巨噬细胞高表达的甘露糖受体能够与甘露糖高效结合,制备的纳米粒携带甘露糖残基,因此,靶向性结合应该源于这种配体与受体的特异性结合。M1型巨噬细胞本身具有吞噬异物的能力,但在本研究中未观察到M1型巨噬细胞的荧光强度明显高于成纤维细胞、人结肠癌细胞SW620和人肺癌细胞A549,可能与共孵育的时间较短有关。本研究通过依替膦酸与壳聚糖构建纳米颗粒,主要在酸性环境下,利用依替膦酸带负电荷的羧基与壳聚糖带正电荷的氨基,通过离子交联反应形成纳米颗粒,通过调节反应条件可形成不同大小或直径的纳米颗粒。依替膦酸属于双磷酸盐,其抗骨转移作用被广泛运用,体外数据已经证实双磷酸盐对乳腺癌、肺癌、肾癌等实体肿瘤细胞具有一定的抗肿瘤作用[17-20],但其在骨以外的组织浓度极低,血浆半衰期短,不能达到有效血药浓度,因此在实体瘤的治疗上难以发挥疗效。将依替膦酸作为纳米粒的组成部分,有望解决依替膦酸半衰期过短的缺点,为进一步进行体内试验奠定实验基础。纳米粒中的双磷酸盐可以在肿瘤病灶内及周围释放达到较高的药物浓度,从而发挥其抗肿瘤的效应,这种推测需要后期通过基础实验进一步验证。
另外,纳米粒直径可影响其到达肿瘤组织的纳米粒浓度,所以纳米粒直径的选择显得尤为重要。肾小球内皮细胞间隙在40~60 nm,制备的纳米粒过小则会被过滤;而肝脾血窦的血管内皮细胞间隙为200~500 nm,纳米粒过大则会被截留,导致Kupffer细胞被吞噬;因此,通过调整实验条件,制备直径为100 nm左右的纳米粒,以便得到半衰期较长的纳米药物,方便后续的动物实验使用。
本研究证实了经甘露糖修饰的壳聚糖构建纳米颗粒能够靶向结合M2型巨噬细胞,由于M2型巨噬细胞是肿瘤微环境中的主要炎性细胞,因此,本实验制备的纳米粒药物为进一步探讨靶向肿瘤微环境,从而开展抗肿瘤的研究奠定了实验基础。
[1]Qian BZ,Pollard JW.Macrophage diversity enhances tumor progression and metastasis[J].Cell,2010,141(1):39-51.
[2]CarasⅠ,Tucureanu C,Lerescu L,et al.Ⅰnfluence of tumor cell culture supernatants on macrophage functional polarization:in vitro models of macrophage-tumor environment interaction[J].Tumori,2011,97(5):647-654.
[3]Otter M,Zocková P,Kuiper J,et al.Ⅰsolation and characterization of the mannose receptor from human liver potentially involved in the plasma clearance of tissue-type plasminogen activator[J].Hepatology,1992,16(1):54-59.
[4]Ramakrishna V,Treml JF,Vitale L,et al.Mannose receptor targeting of tumor antigen pmel17 to human dendritic cells directs anti-melanoma T cell responses via multiple HLA molecules[J].JⅠmmunol,2004,172(5):2845-2852.
[5]Ⅰrjala H,Alanen K,Grénman R,et al.Mannose receptor(MR)and common lymphatic endothelial and vascular endothelial receptor(CLEVER)-1 direct the binding of cancer cells to the lymph vessel endothelium[J].Cancer Res,2003,63(15):4671-4676.
[6]Peng Y,Yao W,Wang B,et al.Mannosylated chitosan nanoparticles based macrophage-targeting gene delivery system enhanced cellular uptake and improved transfection efficiency[J].J Nanosci Nanotechnol,2015,15(4):2619-2627.
[7]石艳,张惠斌,宗莉.靶向甘露糖受体的载体甘露糖化壳聚糖的全合成及其细胞毒性评价[J].药物生物技术,2009(3):207-211.
[8]Sansone P,Bromberg J.Environment,inflammation,and cancer[J].Curr Opin Genet Dev,2011,21(1):80-85.
[9]Lewis CE,Pollard JW.Distinct role of macrophages in different tumor microenvironments[J].Cancer Res,2006,66(2):605-612.
[10]Lee MM,Chui RK,TamⅠY,et al.CCR1-mediated STAT3 tyrosine phosphorylation and CXCL8 expression in THP-1 macrophage-like cells involve pertussis toxin-insensitive Gα(14/16)signaling and ⅠL-6 release[J].J Ⅰmmunol,2012,189(11):5266-5276.
[11]Yang P,Li QJ,Feng Y,et al.TGF-β-miR-34a-CCL22 signaling-induced Treg cell recruitment promotes venous metastases of HBV-positive hepatocellular carcinoma[J].Cancer Cell,2012,22(3):291-303.
[12]Biswas SK,Mantovani A.Orchestration of metabolism by macrophages[J].Cell Metabolism,2012,15(4):432.
[13]Boscá L,González-Ramos S,Prieto P,et al.Metabolic signatures linked to macrophage polarization:from glucose metabolism to oxidative phosphorylation[J].Biochem Soc Trans,2015,43(4):740-744.
[14]Mantovani A.MSCs,macrophages,and cancer:a dangerous ménage-à-trois[J].Cell Stem Cell,2012,11(6):730-732.
[15]Zhang X,Meng A,Wang H,et al.High serum macrophage inflammatory protein-3α is associated with the early recurrence or metastasis of non-small cell lung cancer following primary pulmonary resection[J].Oncol Lett,2014,8(2):948-952.
[16]Peng Y,Yao W,Wang B,et al.Mannosylated chitosan nanoparticles based macrophage-targeting gene delivery system enhanced cellular uptake and improved transfection efficiency[J].J Nanosci Nanotechnol,2015,15(4):2619-2627.
[17]Gallo M,De Luca A,Lamura L,et al.Zoledronic acid blocks the interaction between mesenchymal stem cells and breast cancer cells:implications for adjuvant therapy of breast cancer[J].Ann Oncol,2012,23(3):597-604.
[18]Nevillewebbe HL,Gnant M,Coleman RE.Potential anticancer properties of bisphosphonates[J].Semin Oncol,2010,37 Suppl 1:S53-65.
[19]Keizman D,Ⅰsh-Shalom M,Maimon N,et al.Are bisphosphonates an indispensable tool in the era of targeted therapy for renal cell carcinoma and bone metastases?[J].World J Urol,2014,32(1):39-45.
[20]Sewing L,Steinberg F,Schmidt H,et al.The bisphosphonate zoledronic acid inhibits the growth of HCT-116 colon carcinoma cells and induces tumor cell apoptosis[J].Apoptosis,2008,13(6):782-789.
