宫颈癌组织FoxM 1蛋白的表达特点及其与病理学特征、预后的相关性
2018-06-13郭丽梅戴守勇
郭丽梅,戴守勇
上海市浦东医院1妇产科,2普外科,上海201399
临床上宫颈癌的病情进展能够增加患者盆腔内脏器转移的风险,导致患者生存预后的恶化。流行病学研究显示,宫颈癌的发病率为(225~674)/10万,同时在经济欠发达地区或具有高危型HPV感染的患者中,宫颈癌的发病率可持续上升[1]。基因转录水平或细胞生物学相关因子的改变,能够促进癌细胞的细胞核增殖、细胞异型性的改变。叉头转录因子(fork transcription factor,FoxM1)的表达浓度的改变,能够增加癌细胞DNA核转录基因的激活,促进癌细胞肿瘤相关信号通路的上调,增加癌细胞浸润或者转移的风险[2-3]。已证实FoxM1能够在甲状腺癌、视网膜母细胞瘤或乳腺癌等恶性肿瘤的发生过程中发挥重要的作用,认为高表达的FoxM1是促进患者临床分期进展、导致治疗远期预后恶化的重要因子,但在宫颈癌中的分析研究不足。为了进一步探讨FoxM1的表达与宫颈癌的关系,从而为宫颈癌的诊断和治疗提供理论基础,本次研究选取手术后宫颈癌组织标本90例,探讨FoxM1的表达与宫颈癌患者临床特征及预后的关系。
1 资料与方法
1.1 一般资料
选取2010年1月至2012年8月上海市浦东医院病理科收集的手术后宫颈癌组织标本90例(宫颈癌组)及正常宫颈组织45例(对照组)。纳入标准:①宫颈癌患者的诊断标准参考相关标准[3];②患者年龄19~65岁;③均为上海市浦东医院手术后宫颈癌组织标本;④手术前患者均未接受放化疗、免疫治疗;⑤患者接受了术后随访。排除标准:①转移性宫颈癌;②具有放化疗史、免疫治疗史;③未能接受术后随访。宫颈癌组,年龄36~65岁,平均(52.0±9.8)岁;鳞癌76例,腺癌14例;依据国际妇产科联盟(FⅠGO)分期:Ⅰ期59例,Ⅱ期31例;分化程度:高分化33例,中分化32例,低分化25例;淋巴结转移15例。对照组,年龄41~65岁,平均(53.0±10.6)岁。两组患者的年龄、性别比较,差异均无统计学意义(P>0.05)。
1.2 指标检测方法
所有组织标本经石蜡包埋后作连续切片,厚度约为4 mm,采用免疫组化链霉卵白素-生物素复合体法(strep avidin-biotin complex,SABC)染色,二氨基联苯胺(diamionben zidene,DAB)显色。FoxM1蛋白抗体、PV6000通用型二抗、SP试剂盒和DAB显色盒均购自北京中杉金桥生物技术开发公司。以阳性片及磷酸盐缓冲液代替一抗分别作为阳性及阴性对照,高倍显微镜下观察FoxM1蛋白的表达情况,具体染色步骤严格按照SP试剂盒说明书进行操作。
1.3 结果判定标准
免疫组化结果判定[5]:FoxM1蛋白的阳性着色表达于细胞质、细胞核,呈黄色、棕黄色、褐色表达。①根据着色强度:无色为0分,淡黄色为1分,棕黄色为2分,褐色、黑色为3分;②根据阳性细胞比例:阳性细胞数目所占比例≤10%为1分,11%~50%为2分,51%~75%为3分,>75%为4分。两种积分相乘总分<3分为阴性,≥3分为阳性。总分<3分为“-”表达,3~5分为“+”表达,6~9分为“++”表达,>9分为“+++”表达。
1.4 统计学方法
采用SPSS 16.0统-计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验;计数资料以率(%)表示,组间比较采用χ2检验;生存分析采用Kaplan-Meier法,组间比较采用Log-rank法;以P<0.05为差异有统计学意义。
2 结果
2.1 FoxM 1蛋白表达情况的比较
宫颈癌组织中的FoxM1蛋白阳性表达率为74.44%(67/90),明显高于对照组的8.89%(4/45),差异有统计学意义(χ2=51.709,P<0.01)。(表1)

表1 两组标本中FoxM 1蛋白的表达情况
2.2 宫颈癌组织标本中FoxM 1蛋白表达情况与临床特征的关系
宫颈癌组织中的FoxM1蛋白阳性表达率与患者的FⅠGO分期、肿瘤分化程度、发生肌层浸润有关(P<0.05),与年龄、是否发生淋巴结转移、是否发生脉管侵犯、是否累及阴道残端无关(P>0.05)。(表2)
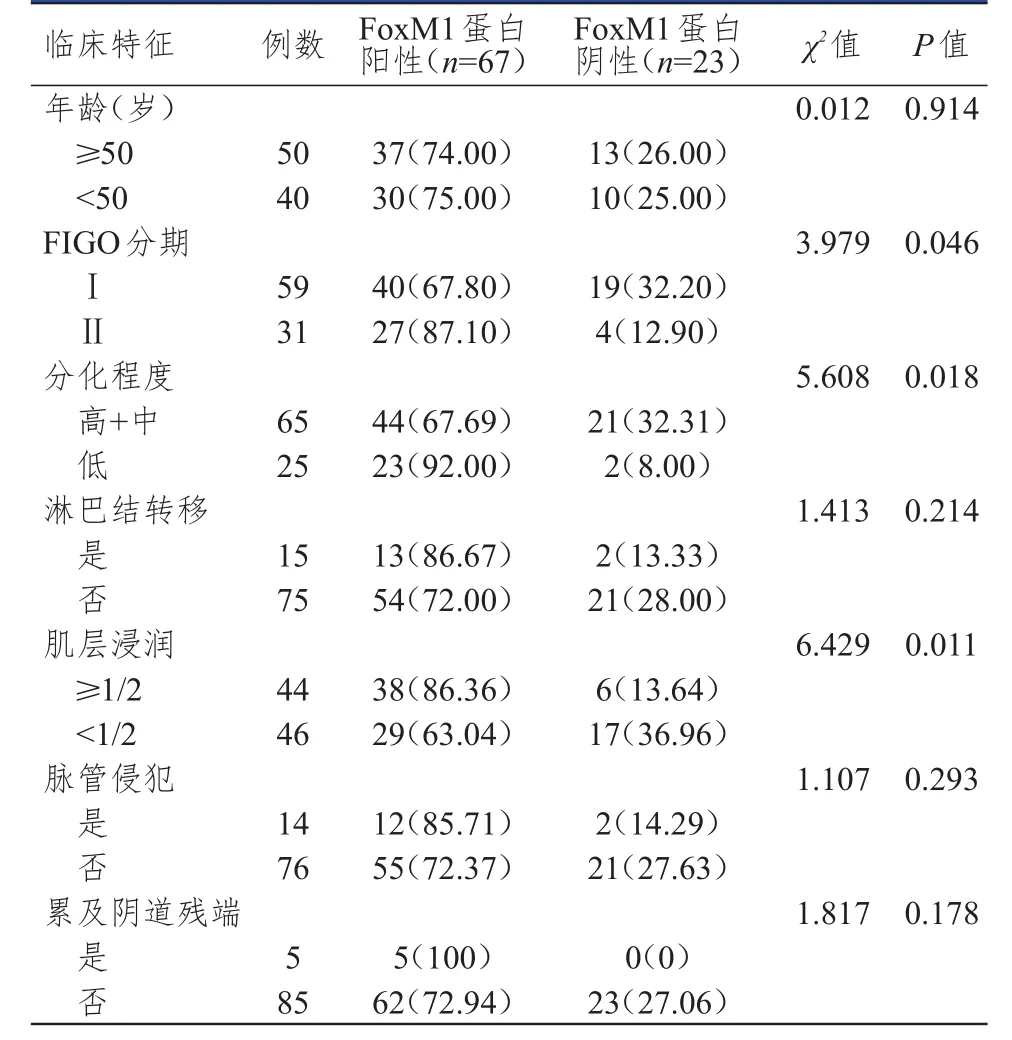
表2 宫颈癌组织标本中FoxM 1蛋白表达情况与临床特征的关系[ n(%)]
2.3 宫颈癌组织标本中FoxM 1蛋白表达情况与患者预后的关系
FoxM1蛋白阳性表达的宫颈癌患者的5年生存率为44.44%,与阴性表达患者的68.18%比较,差异无统计学意义(P>0.05),详见表3;FoxM1蛋白阳性表达的宫颈癌患者的生存时间短于阴性表达患者,差异有统计学意义(P<0.05),详见图1。

表3 宫颈癌组织标本中FoxM 1蛋白表达情况与患者预后的关系[ n(%)]

图1 宫颈癌组织标本中FoxM 1蛋白表达阳性及阴性患者的生存曲线
3 讨论
过早的性生活、多次人工流产、HPV感染等因素,均可以促进宫颈癌的发生。宫颈癌的治疗预后并不理想,长期的临床随访研究显示,宫颈癌患者的治疗预后特别是5年生存率不足35%,治疗后的病死率或中位生存时间等预后指标均无明显改善[4-5]。免疫靶向治疗或生物学治疗方式,已越来越成为临床上恶性肿瘤的重要辅助治疗方式。而通过对于宫颈癌恶性肿瘤的发生发展的分子机制研究,能够为临床上宫颈癌的免疫靶向治疗提供新的靶点,同时能够为宫颈癌的高危人群随访提供血清学指标。
FoxM1蛋白结构上包含了多个糖蛋白结合配体,同时包含了数个丝氨酸结构,其对于体内氧化应激性蛋白酶的激活作用,能够促进患者体内肿瘤微环境的改变,导致癌细胞的持续性增殖[6-7]。FoxM1在癌细胞内的过度富集,能够在癌细胞的转录调控方面增加p16或p53等癌基因的转录上游启动子的转录活性,促进肿瘤相关蛋白的高翻译,影响细胞周期非依赖性蛋白激酶的活性,导致癌细胞中G1/S期比例明显上升,而G0期细胞比例明显下降[8-9]。近年来相关方面的研究表明,FoxM1蛋白主要表达于胎儿体内的肝肾组织、平滑肌组织及部分神经间质成分中,在成人体内的分化成熟组织中的阳性表达率较低[10-11]。FoxM1蛋白能够导致乳腺癌、神经视网膜瘤放化疗治疗敏感性的下降,增加乳腺癌等患者的治疗后复发率,同时虽然部分研究揭示了FoxM1蛋白与宫颈癌患者病理特征的关系,但对于其与患者临床预后的关系研究不足。
本次研究通过免疫组化分析研究发现,在宫颈癌肿瘤组织中可以发现FoxM1蛋白的高表达,其阳性表达率明显高于正常宫颈上皮组织,提示了FoxM1蛋白可能参与了宫颈癌的病情进展过程中,可能能够影响癌细胞的基因调控、癌细胞的生物学特征,促进癌细胞的凋亡抑制等过程[12-13]:①FoxM1蛋白的高表达能够影响到细胞内AKT或者MAPK等信号通路的激活,促进癌细胞对邻近正常宫颈上皮细胞的浸润;②FoxM1蛋白能够促进宫颈上皮间质成分中金属蛋白酶的激活,促进细胞间质成分的分解,从而为宫颈癌细胞的扩散提供基础。刘波等[14]在研究了部分宫颈鳞癌患者体内的相关生物学因子谱的表达变化后发现,相比于宫颈癌旁组织,FoxM1蛋白在宫颈癌肿瘤组织中的阳性表达率可平均上升25%以上,且患者的治疗预后越差,治疗后的无瘤生存期越短,FoxM1蛋白的阳性表达率越高。在探讨其与宫颈癌患者临床特征的关系过程中发现,FoxM1蛋白的表达与宫颈癌患者的FⅠGO分期、肿瘤分化程度、发生肌层浸润等临床特征有密切关系,提示FoxM1蛋白能够明显促进患者的病情进展,这主要考虑与FoxM1蛋白对癌细胞分化成熟诱导因子的表达影响,促进宫颈上皮细胞对于基底膜组织、宫颈癌旁组织的浸润有关,但本次研究并未发现FoxM1蛋白的表达对宫颈癌患者的淋巴结转移或脉管浸润的影响,这可能与其对于癌细胞黏附能力的影响不足有关。在探讨FoxM1蛋白与宫颈癌患者临床预后关系的过程中发现,FoxM1蛋白阳性表达的宫颈癌患者,其远期生存预后较差,临床上可以通过评估FoxM1蛋白的表达为宫颈癌患者的远期生存预后的预测提供参考。
本次研究的创新性在于探讨了FoxM1蛋白的表达与宫颈癌患者远期生存预后的关系。综上所述,FoxM1蛋白在宫颈癌组织中高表达,同时与宫颈癌患者的临床分期等病理特征及生存预后有关。
[1]吴乾凤,高国兰,孔为民.Ⅰ~ⅡA2期宫颈癌淋巴结转移高危因素及对预后的影响[J].中国妇产科临床杂志,2016,17(5):407-409.
[2]Kameda Y.Signaling molecules and transcription factors involved in the development of the sympathetic nervous system,with special emphasis on the superior cervical ganglion[J].Cell Tissue Res,2014,357(3):527-548.
[3]Wang N,Xu Z,Wang K,et al.Construction and analysis of regulatory genetic networks in cervical cancer based on involved microRNAs,target genes,transcription factors and host genes[J].Oncol Lett,2014,7(4):1279-1283.
[4]欧燕兰,张琳,张秀,等.宫颈癌患者预后预测列线图的建立[J].中华肿瘤防治杂志,2015,22(16):1303-1307.
[5]付璐璐,谷春会,张静文,等.宫颈癌病理诊断的免疫组化技术的最新研究进展[J].中国妇幼保健,2014,29(36):6176-6178.
[6]Snodgrass SJ,Cleland JA,Haskins R,et al.The clinical utility of cervical range of motion in diagnosis,prognosis,and evaluating the effects of manipulation:a systematic review[J].Physiotherapy,2014,100(4):290-304.
[7]Qian Q,Yang J,Cao D,et al.Analysis of treatment modalities and prognosis on microinvasive cervical cancer:a 10-year cohort study in China[J].J Gynecol Oncol,2014,25(4):293-300.
[8]石俊强,王建礼,王国芳,等.转录因子性别决定区Y框18对子宫颈癌HeLa细胞增殖、迁移和侵袭的影响[J].肿瘤研究与临床,2017,29(6):370-373.
[9]宋佳伦,杨琦.转录因子扭曲基因表达异常在早期子宫颈癌发病中的意义及对预后的影响[J].中国妇幼健康研究,2016,27(9):1066-1068.
[10]阴春霞,贾云霄,曲红光,等.Foxp3在宫颈癌中的表达及临床意义[J].中国实验诊断学,2017,21(3):495-497.
[11]张娟,伍娇娇.宫颈癌预后相关分子标志物的研究进展[J].中国临床研究,2014,27(5):622-623.
[12]黄红芳.转录因子Foxd3、Sox2在宫颈上皮内瘤样病变中的表达临床意义[J].现代仪器与医疗,2015,21(3):77-78;92.
[13]金云峰,奚庆华,黄国琴,等.转录因子FOXO1在宫颈癌中的表达及意义[J].江苏医药,2016,42(13):1456-1459;封3.
[14]刘波,黄世峰,袁虹.FOXM1转录因子在人宫颈癌组织中的表达及其临床意义[J].重庆医学,2014,43(24):3143-3145;3148.
