125 I粒子植入治疗结肠癌肝转移患者的临床研究
2018-06-13叶世富周永祥首峰张景俊陈炀
叶世富,周永祥,首峰,张景俊,陈炀
四川省简阳市人民医院肿瘤科,四川 简阳641400
结肠癌常易发生肝转移,影响患者预后[1]。有研究显示,无论是早期结肠癌患者,还是中晚期结肠癌患者,均存在一定比例的肝转移,且越到中晚期,肝转移率越高[2]。有研究显示,肝转移是导致结肠癌患者死亡的重要因素[3]。手术是临床治疗结肠癌肝转移的最佳治疗方法,但手术治疗具有严格的适应证,多数患者因不满足该要求无法进行手术治疗[4]。随着微创技术的发展,125Ⅰ粒子植入技术逐渐被应用于临床结肠癌肝转移患者的治疗,且以其局部疗效可靠和不良反应小获得医患的认可[5]。本研究将125Ⅰ粒子植入技术应用于结肠癌肝转移患者的治疗,患者获益率相对较高,现总结如下。
1 对象与方法
1.1 研究对象
选取2013年1月至2017年6月于四川省简阳市人民医院接受治疗的80例结肠癌肝转移患者。纳入标准:①经病理检查诊断为结肠癌,并经CT或MRⅠ检查诊断为肝转移;②行结肠癌根治术治疗;③预期生存期≥90 d;④肝功能Child-Pugh分级为A、B级;⑤KPS评分≥70分;⑥对本研究知情同意。排除标准:①对本研究所用药物不能耐受;②伴有肝肾功能不全(依据2015年肝功能Child-Pugh分级标准,肝功能评价为B级及以上;依据2012年美国chronic kidney disease标准,评价为肾功能不全2级及以上);③伴有内分泌系统疾病;④伴有自身免疫系统疾病;⑤伴有其他脏器恶性肿瘤;⑥有其他部位转移;⑦依从性差。将纳入的80例结肠癌肝转移患者按照随机数字表法分为植入组与对照组,每组40例。植入组40例患者中,男26例,女14例;年龄为55~66岁,平均为(58.18±5.89)岁。对照组40例患者中,男22例,女18例;年龄为56~65岁,平均为(58.27±6.03)岁。两组患者的性别、年龄等临床特征比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。本研究符合伦理学要求,并经四川省简阳市人民医院伦理学委员会批准备案。
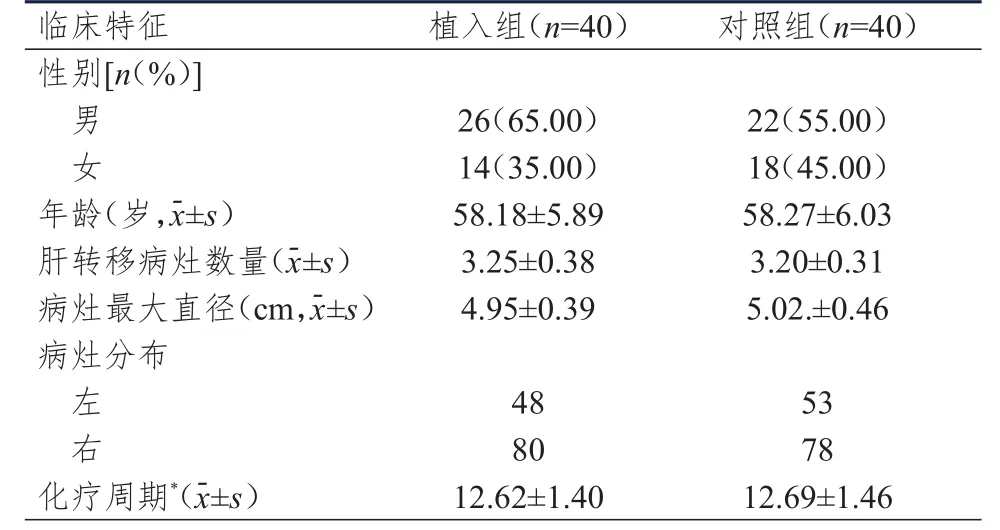
表1 两组患者的临床特征
1.2 治疗方法
1.2.1 单纯化疗 对照组患者采用单纯化疗,选择FOLFⅠRⅠ方案,即第1天,伊立替康180 mg/m2,亚叶酸钙400 mg/m2,静脉滴注30~90 min;第1天,氟尿嘧啶400 mg/m2,静脉推注,之后氟尿嘧啶400 mg/m2,静脉滴注1.5~2.0 d。14 d为1个治疗周期。
1.2.2125I粒子植入治疗+化疗 植入组患者采用125Ⅰ粒子植入治疗+化疗。125Ⅰ粒子植入治疗的设备和药品包括植入枪、植入针、计算机TPS系统和125Ⅰ粒子(6711-99型;半衰期:60.2 d;活度:25.9~33.3 MBq;穿透力:1.70 cm)等。计算机三维重建病灶影像,掌握病灶位置及其周围组织情况,确定处方剂量和靶区范围,并按照患者的情况制定治疗方案。局麻后于CT引导下将125Ⅰ粒子经皮穿刺植入,先植入肿瘤中心平面,植入针间隔1 cm,CT精确定位,植入针穿刺病灶远侧边缘,成功穿刺后回抽,确认无血液回流后每隔1.0~1.5 cm植入1颗125Ⅰ粒子,125Ⅰ粒子与大血管的距离≥1.0 cm。植入后行CT检查,确保无遗漏。术后常规处理,若患者无异常表现,于术后第7天化疗,化疗方案与对照组相同。
1.3 疗效评价标准
化疗2个周期后,根据2009年RECⅠST标准评价疗效:完全缓解(CR),病灶未见强化的时间>4周或病灶完全消失;部分缓解(PR),病灶范围减小≥30%,时间≥4周;稳定(SD),病灶范围增大≤20%或减小<30%;疾病进展(PD),病灶范围增大>20%,或出现新病灶。客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%。
1.4 观察指标
观察治疗前后两组患者的血清基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、癌胚抗原(carcinoembryonic antigen,CEA)、甲胎蛋白(alpha-fetoprotein,AFP)水平;CD4+、CD8+、CD4+/CD8+、白细胞介素-6(interleukin-6,ⅠL-6)、白细胞介素-17(interleukin-17,ⅠL-17)免疫指标水平和不良反应的发生情况。采用放射免疫分析法检测CEA水平,化学发光酶免疫法检测AFP水平,流式细胞术检测T细胞因子CD4+、CD8+、CD4+/CD8+水平,酶联免疫吸附法检测 MMP-2、MMP-9、ⅠL-6、ⅠL-17水平。上述检测均参考试剂盒说明书操作。
1.5 统计学方法
采用SPSS 19.0统计软件分析数据,计量资料以均数±标准差(±s)表示,组内比较采用配对t检验,组间比较采用独立样本t检验;计数资料以率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 MMP- 2、MMP- 9、CEA、AFP治疗前后差值比较
植入组患者的血清MMP-2、MMP-9、CEA、AFP治疗前后的差值均明显大于对照组,差异均有统计学意义(P<0.01)。(表2)
表2 两组患者血清MMP- 2、MMP- 9、CEA、AFP治疗前后差值比较(±s)

表2 两组患者血清MMP- 2、MMP- 9、CEA、AFP治疗前后差值比较(±s)
组别植入组(n=40)对照组(n=40)t值P值MMP-2(µg/L)108.40±11.60 62.86±6.95 21.227 0.000 MMP-9(µg/L)108.90±9.80 57.50±5.91 28.379 0.000 CEA(ng/ml)144.00±13.80 94.13±9.97 18.504 0.000 AFP(µg/L)255.10±25.80 187.90±19.80 13.060 0.000
2.2 免疫指标治疗前后差值比较
植入组患者的 CD4+、CD4+/CD8+、CD8+、ⅠL-6、ⅠL-17治疗前后的差值均明显大于对照组,差异均有统计学意义(P<0.01)。(表3)
表3 两组患者免疫指标治疗前后差值比较(±s)

表3 两组患者免疫指标治疗前后差值比较(±s)
组别植入组(n=40)对照组(n=40)t值P值CD4+(%)-16.05±1.92-5.47±0.76 32.405 0.000 CD8+(%)8.79±0.81 4.74±0.34 29.158 0.000 CD4+/CD8+-2.06±0.20-0.66±0.06 42.405 0.000ⅠL-6(pg/ml)0.45±0.05 0.17±0.03 30.370 0.000ⅠL-17(pg/ml)5.31±0.36 2.11±0.17 50.835 0.000
2.3 治疗效果比较
植入组患者的ORR为70.00%(28/40),高于对照组的42.50%(17/40),差异有统计学意义(χ2=6.146,P<0.05)。(表4)

表4 两组患者的疗效[ n(%)]
2.4 不良反应的发生情况比较
两组患者的恶心呕吐、中性粒细胞减少、迟发性腹泻、肝功能不全的发生率比较,差异均无统计学意义(P>0.05);植入组患者肝区中度疼痛的发生率为85.00%,明显高于对照组的20.00%,差异有统计学意义(P<0.01),详见表5。两组肝区中度疼痛患者使用镇痛药物后均完全缓解。

表5 两组患者的不良反应发生情况比较[ n(%)]
3 讨论
有研究证明,125Ⅰ为124Xe俘获1个中子后生成的同位素,其释放的γ射线可直接破坏肿瘤细胞DNA合成,从而诱导肿瘤细胞凋亡[6];γ射线还可通过影响肿瘤细胞DNA抑制蛋白质的合成,使肿瘤细胞难以进行正常的代谢和增殖[7];125Ⅰ产生的低线性能量射线可以将肿瘤细胞内水分电离为自由基,从而损伤肿瘤细胞,使其丧失增殖能力而凋亡[8]。与常规放疗比较,125Ⅰ粒子植入治疗结肠癌肝转移具有下述优势:①辐射距离短,可在有效杀伤病灶的同时保护正常组织;②半衰期长,可对病灶进行持续放疗,提高放疗效果[9];③产生的射线能量小,不良反应少,便于防护;④持续低剂量放疗可抑制肿瘤细胞的有丝分裂,使肿瘤细胞停留在G2期,有效地减弱肿瘤细胞的增殖能力;⑤持续近距离放疗可降低乏氧细胞的抗拒性,促使乏氧细胞再氧合,提高放射治疗的敏感性[10];⑥CT引导下植入,符合微创特点,对患者影响小,术后恢复快。
有研究显示,基底膜和细胞外基质是肿瘤细胞转移的重要屏障,对肿瘤细胞转移具有较强的抑制作用[11]。基质金属蛋白酶(matrix metalloproteinase,MMP)是肿瘤细胞转移相关蛋白,可降解基底膜和细胞外基质,在肿瘤细胞的转移过程中起着重要的作用。通常情况下,正常机体中极少有MMP表达,在肿瘤细胞的转移过程中,肿瘤细胞合成MMP水平明显增加,肿瘤细胞的转移速度也明显加快[12]。MMP-2、MMP-9为MMP家族的重要成员,主要生成于肿瘤细胞转移期,其水平直接决定了肿瘤细胞的转移速度[13]。张军要等[14]的研究显示,血清MMP-2、MMP-9水平与结肠癌细胞的迁移和侵袭能力有密切的关系。李涛等[15]发现,MMP-2、MMP-9过度表达是推动结肠癌浸润和转移的重要因素。CEA、AFP是重要的肿瘤标志物,连续监测CEA、AFP水平可准确地评价肿瘤患者的预后[16]。ⅠL-6为功能广泛的炎性细胞因子,可促进细胞的增殖、分化和免疫调节[17]。有研究发现,ⅠL-6可结合其受体,活化肿瘤细胞内部信号蛋白,使IL-6基因表达上调,促使肿瘤细胞增殖[18];ⅠL-17源于中性粒细胞和T细胞,其靶细胞分布比较广泛[19]。有研究显示,ⅠL-17可通过促进释放炎性因子,增强细胞的增殖能力,参与炎性反应和肿瘤的发生、发展[20]。本研究中,治疗后植入组患者的血清MMP-2、MMP-9、CEA、AFP、ⅠL-6、ⅠL-17治疗前后差值均明显大于对照组,且植入组患者的ORR高于对照组,提示125Ⅰ粒子植入治疗结肠癌肝转移可有效地杀灭肿瘤细胞,抑制肿瘤转移。此外,治疗期间,两组患者恶心呕吐、中性粒细胞减少、迟发性腹泻、肝功能不全的发生率比较,差异均无统计学意义(P>0.05);而植入组患者肝区中度疼痛的发生率明显高于对照组,差异有统计学意义(P<0.01),使用镇痛药物后患者肝区疼痛完全缓解。
综上所述,125Ⅰ粒子植入治疗结肠癌肝转移可有效地杀灭肿瘤细胞,抑制肿瘤转移,疗效明显,不良反应少,且具有微创特点,值得临床推广应用。
[1]Yamada K,Uchiyama T,Uchisako H,et al.A case of mediastinal lymph node metastasis from liver metastasis of colon cancer[J].Gan To Kagaku Ryoho,2017,44(7):603-606.
[2]Lin X,Lin M,Wei X,et al.Clinical observation and retrospective study of the influential factors of liver metastasis in 306 cases of colon cancer[J].Ⅰndian J Cancer,2016,53(4):499-504.
[3]Goodwin TJ,Huang L.Ⅰnvestigation of phosphorylated adjuvants co-encapsulated with a model cancer peptide antigen for the treatment of colorectal cancer and liver metastasis[J].Vaccine,2017,35(19):2550-2557.
[4]王俊锋(综述).结肠癌肝转移物理消融治疗的新进展[J].中国肿瘤临床,2014,41(2):142-146.
[5]何津.125Ⅰ粒子植入治疗延迟性结肠癌肝转移的临床疗效[J].中华肿瘤杂志,2016,38(3):223-227.
[6]胡琰琰,于晓玲.放射性粒子植入技术治疗胰腺癌的临床研究进展[J].解放军医学院学报,2017,38(5):475-477.
[7]Saito S,Ye X.Expert consensus workshop report:Guideline for three-dimensional-printing template-assisted computed tomography-guided125Ⅰseeds interstitial implantation brachytherapy[J].J Cancer Res Ther,2017,13(4):605-606.
[8]Mostaghimi H,Mehdizadeh AR,Darvish L,et al.Mathematical formulation of 125Ⅰseed dosimetry parameters and heterogeneity correction in lung permanent implant brachytherapy[J].J Cancer Res Ther,2017,13(3):436-441.
[9]孟永斌,陈红云.肝脏放射性粒子植入对肝癌患者肝功能及血常规的影响[J].现代中西医结合杂志,2012,21(33):3662-3664.
[10]李保国,郭志.CT引导下放射性125Ⅰ粒子植入治疗难治性肝转移癌的临床观察[J].临床肿瘤学杂志,2013,18(8):713-717.
[11]蒋亚男,王薇,吴逢霞.宫颈癌患者血清及组织VEGF及MMP的变化[J].海南医学院学报,2015,21(4):556-558.
[12]陶燕,刘泽文.VEGF及MMP表达与非小细胞肺癌的关系研究[J].实用癌症杂志,2016,31(6):889-891.
[13]欧小波,周密.ADAM15、MMP-2和MMP-9在不同转移能力乳腺癌细胞系中的表达差异[J].基础医学与临床,2016,36(2):227-231.
[14]张军要,梁树才,朱宝安.科罗索酸下调MMP-2、MMP-9抑制结肠癌LoVo细胞的迁移与侵袭[J].河南科技大学学报(医学版),2017,35(1):11-13.
[15]李涛,张占学,李桂馨,等.结肠癌组织中p27、MMP-2、MMP-9的表达及相关性[J].河北医药,2014,36(9):1300-1301.
[16]王琼,喻勇,曾智,等.乙肝患者癌胚抗原、甲胎蛋白水平与生化应答间的相关性[J].湖南师范大学学报(医学版),2016,13(6):8-9.
[17]Hsu HP,Lai MD,Lee JC,et al.Mucin 2 silencing promotes colon cancer metastasis through interleukin-6 signaling[J].Sci Rep,2017,7(1):5823.
[18]孙平,张洋,张静.乳腺癌患者血清内ⅠL-6和CCL-18的表达及临床意义[J].现代肿瘤医学,2015,23(8):1072-1074.
[19]Mittal GS,Kumar S,Thomas M,et al.The expression of interleukin-17 in cutaneous lesions of lupus erythematosus in pediatric-onset systemic lupus erythematosus[J].Ⅰndian J Pathol Microbiol,2017,60(3):447-448.
[20]吴雨岗,王勍.结肠癌组织中ⅠL-17的表达及临床意义[J].江苏医药,2015,41(16):1890-1892.
