MasaokaⅡ期胸腺瘤患者完整手术切除后辅助放疗的疗效及预后分析
2018-06-13罗红兰刘凯姬生威冯兴勇刘静
罗红兰,刘凯,姬生威,冯兴勇,刘静#
黄冈市中心医院1肿瘤科,2影像科,湖北 黄冈438000
胸腺瘤是胸腺上皮细胞较常见的纵隔恶性肿瘤之一,在中国,其发病率较低[1]。早期胸腺瘤发病隐匿,不易被发现和诊断,而中晚期的胸腺瘤由于发生周围侵犯和远处转移而导致治疗难度较大[2]。临床上,胸腺瘤MasaokaⅡ期时,肿瘤已累及患者的心包膜、纵隔脂肪或胸膜,其治疗方案存在争议。有文献报道,MasaokaⅡ期胸腺瘤患者的治疗方式多以手术完全切除为主,且已取得较理想的临床效果[3]。但也有研究认为,对于不能完全手术切除的胸腺瘤患者,放疗可以改善患者的预后,提高患者的生存率[4-5]。因此,本研究对65例MasaokaⅡ期胸腺瘤完整切除术后接受辅助放疗患者的临床资料进行回顾性分析,旨在明确MasaokaⅡ期胸腺瘤患者术后接受辅助放疗的临床价值,为改善MasaokaⅡ期胸腺瘤患者的预后,降低患者的复发率提供一定的参考依据,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2009年2月至2014年9月于黄冈市中心医院治疗的65例MasaokaⅡ期胸腺瘤患者的临床资料。其中,男39例,女26例;年龄25~60岁,平均(43.38±10.72)岁。纳入标准:①经术前影像学及术后组织病理学检查明确诊断为胸腺瘤;②根据Masaoka分期标准[6]为MasaokaⅡ期;③接受胸腺完整切除术治疗。排除标准:①异位胸腺瘤、异位胸腺癌患者;②术前有放疗和化疗史。根据患者术后是否接受辅助放疗,将患者分为对照组(接受单纯手术治疗,n=43)和观察组(术后接受辅助放疗,n=22)。两组患者的性别、年龄、肿瘤病理分型(根据2014年WHO分型)、肿瘤直径及合并重症肌无力情况比较,差异无统计学意义(P>0.05),具有可比性,详见表1。
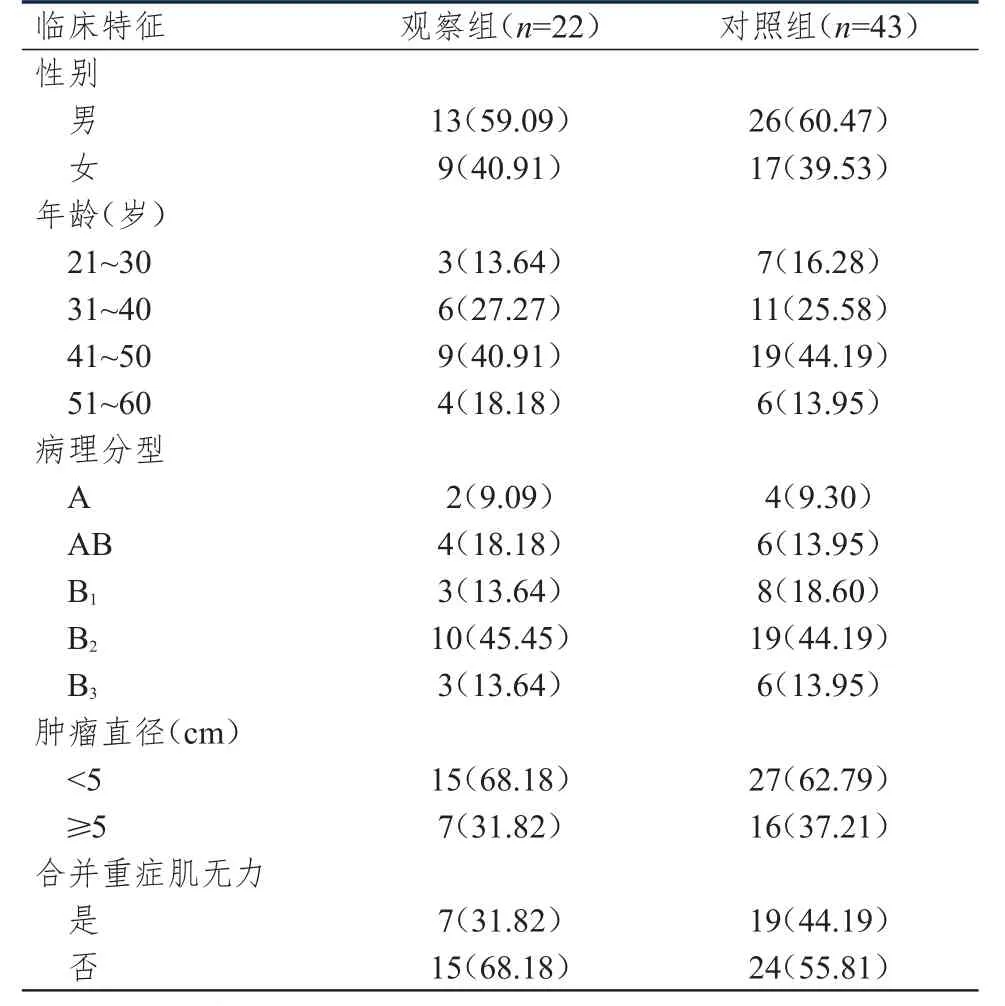
表1 两组患者的临床特征[ n(%)]
1.2 治疗方法
全部患者均在全身麻醉下接受胸腺完整切除术,根据患者肿瘤的大小、位置、转移等情况,合理选择前外侧切口、后外侧切口、胸骨正中劈开切口或胸腔镜切口,术中完整切除胸腺瘤及其周围其他组织。对于合并重症肌无力的患者,术前通过药物控制症状后再进行手术治疗。根据患者的肿瘤病理分型、分期及一般状况等进行辅助放疗,放疗应用常规分割技术、调强放疗或三维适形放疗。选择2.5 mm影像切面厚度进行CT定位扫描。术后接受辅助化疗的患者,其放疗剂量为43~55 Gy,平均放疗剂量为48.3 Gy。常规治疗2 Gy/d,5次/周。
1.3 资料收集和随访
收集患者的年龄和性别等一般人口学特征资料,以及患者接受的放疗剂量、治疗后复发情况、不良反应发生情况等。根据患者的复查及电话随访结果进行分析,首次随访时间为治疗结束后3个月,之后每隔3个月进行电话随访1次,复查的时间窗为1个月。终点事件定义为患者因胸腺瘤及其并发症导致死亡。原始资料参照患者的入院记录、手术记录和麻醉记录,并将末次随访记录作为随访结果,记录患者出现肿瘤进展和发生死亡的人数及时间。删失定义为参与研究的患者中途退出、失访或死于其他与本研究无关的原因。
1.4 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计数资料以例数和率(%)表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 3年累积生存率的比较
全部患者的随访时间为2~36个月,中位随访时间为36个月,随访率为95.38%(62/65)。随访截止日期为2017年8月,共3例患者失访,其中,观察组失访1例患者,对照组失访2例患者。随访过程中,观察组死亡患者2例,3年累积生存率为90.91%(20/22);对照组死亡患者6例,3年累积生存率为86.05%(37/43)。两组患者的3年累积生存率比较,差异无统计学意义(χ2=0.282,P=0.595)。(图1)
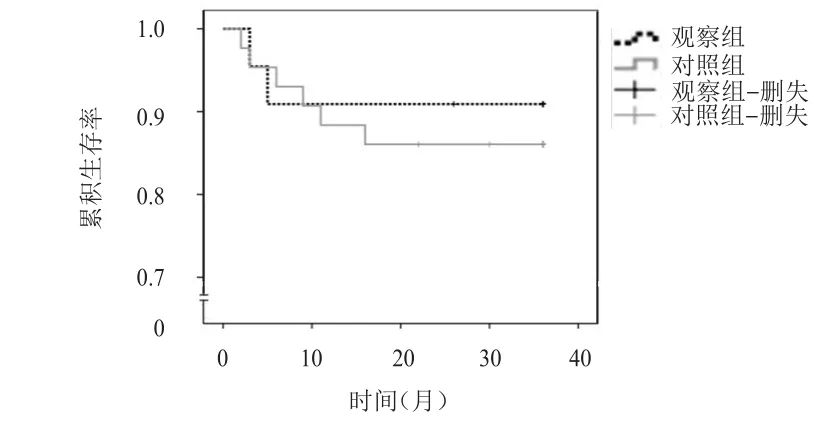
图1 两组患者的 3年累积生存率
2.2 无进展生存率的比较
观察组患者的无进展生存率为90.91%(20/22),高于对照组患者的72.09%(31/43),差异有统计学意义(χ2=4.419,P=0.036)。(图2)
2.3 复发情况
治疗后,全部患者的总复发率为15.38%(10/65),复发时间为4~28个月,中位复发时间为21个月。其中,观察组复发患者1例,累积复发率为4.55%(1/22);对照组复发患者9例,累积复发率为20.93%(9/43)。10例复发患者中,病理分型主要为B1型1例,B2型2例,B3型4例,A型1例,AB型2例;合并有重症肌无力症状的患者5例。
2.4 不良反应发生情况
放疗过程中及放疗结束后,22例术后接受辅助放疗的患者中,共3例患者发生不良反应,其中,发生轻度放射性心包炎患者1例,占4.55%(1/22),表现为胸闷、心率加快的症状;发生轻度放射性胃炎患者2例,占9.09%(2/22),表现为少食、呕吐、腹泻等症状。
3 讨论
在中国,胸腺瘤的发病率相对较低,多发于成年人[7],但其由于临床症状具有一定的隐匿性,早期不易被发现,其诊断主要依靠临床症状和影像学检查。根据世界卫生组织(WHO)对胸腺瘤的分期标准,MasaokaⅡ期时,肿瘤已累及患者的心包膜、纵隔脂肪或胸膜。目前,手术切除是胸腺瘤的首选治疗方式,对患者的预后较好。有报道指出,早期胸腺瘤患者术后的5年累积生存率超过95%[6]。虽然手术是治疗胸腺瘤的重要手段,但是,由于部分患者存在周围浸润及组织转移,手术治疗无法完全切除,术后需进行放疗,已经证实对不完全切除患者术后进行辅助放疗可使患者获益。胸腺瘤对化疗敏感,尤其在电子计算机断层扫描(CT)、磁共振成像(MRⅠ)确认胸腺瘤浸润到周围组织或重要脏器而手术无法完整切除时,辅助放疗可明显改善患者的生存率。
有研究认为,MasaokaⅡ期胸腺瘤患者接受完整切除术即可充分获得治疗,术后无需再加以放疗,但由于其在临床上存在一定的复发风险,很多医师在对患者完全切除胸腺瘤后,仍继续进行辅助放疗[8]。但对于完整切除术后辅助放疗的具体效果,由于前期研究较少,至今仍然缺少确切的循证医学证据。本研究针对MasaokaⅡ期胸腺瘤完整切除术后辅助放疗的患者进行长时间随访研究发现,对照组患者的3年累积生存率为86.05%,这与Detterbeck和Zeeshan[9]所报道的研究结果基本一致,而观察组患者的3年累积生存率为90.91%,两组比较,差异无统计学意义(P>0.05)。分析其主要原因可能由于胸腺瘤手术患者的生存状况与肿瘤切除的彻底性关系最大,而术后放疗只能够在一定程度上提高患者的生存率。
对于患者的术后复发情况,本研究发现,治疗后,观察组患者的累积复发率为4.55%,而对照组患者的累积复发率为20.93%。观察组患者的无进展生存率为90.91%,高于对照组患者的72.09%,差异有统计学意义(χ2=4.419,P<0.05)。可见,术后辅助放疗后,MasaokaⅡ期胸腺瘤患者的复发率低,无进展生存率高,这与贾佳和李月敏[10]的研究结果一致。本研究还发现,复发的患者中,病理分型主要为B1、B2、B3型。有研究认为,肿瘤病理分型属于WHO分型的B2、B3型及未合并重症肌无力是MasaokaⅡ期胸腺瘤患者发生复发的独立危险因素[11]。因此,对于具有上述危险因素的患者,应在完整切除术后给予辅助放射治疗以降低患者的肿瘤复发率。随着三维适形放疗、调强放疗等技术的精确应用,患者接受放疗后的不良反应明显减少[12]。在本研究的22例术后辅助放疗患者中,仅有3例患者出现轻微的不良反应。但临床工作中仍应予以重视,注意放射性胃炎、食管炎、肺炎、心包炎等并发症的发生,早期、及时发现,并进行对症处理。
由于胸腺瘤的发病率较低,且本研究存在纳入样本数量较少的不足,同时由于本研究属于回顾性研究,在研究过程中,并未采取随机分组的方法,且只讨论了总体治疗及预后情况,缺少对具体病理分型的研究。同时,本研究的整体时间较长,可能会受到医师临床经验及对疾病认识程度不同的影响,而导致对手术后患者是否进行放疗的决策出现选择性差异。
综上所述,对MasaokaⅡ期胸腺瘤患者完整手术切除后进行辅助放疗,尽管不能提高患者的总生存率,但可以提高患者的无进展生存率。今后仍需要多中心、大样本的相关研究,具体分析不同病理分型的胸腺瘤患者术后接受辅助放疗的疗效差异。
[1]霍小森,王文璋.常规开胸与胸腔镜下治疗早期胸腺瘤的临床研究[J].癌症进展,2014,12(5):502-504.
[2]Hamaji M,Kojima F,Omasa M,et al.Ameta-analysis of debulking surgery versus surgical biopsy for unresectable thymoma[J].Eur J Cardiothorac Surg,2015,47(4):602-607.
[3]Sandri A,Cusumano G,Lococo F,et al.Long-term results after treatment for recurrent thymoma:a multicenter analysis[J].J Thorac Oncol,2014,9(12):1796-1804.
[4]Keijzers M,Dingemans AM,Blaauwgeers H,et al.8 years’experience with robotic thymectomy for thymomas[J].Surg Endosc,2014,28(4):1202-1208.
[5]Miki Y,Hamada K,Yoshino T,et al.Type AB thymoma is not a mixed tumor of type A and type B thymomas,but a distinct type of thymoma[J].Virchows Arch,2014,464(6):725-734.
[6]梁光辉,谷志涛,李印,等.基于中国胸腺瘤协作组回顾性数据库对比Masaoka-Koga分期和国际肺癌协会/国际胸腺肿瘤协作组提出的TNM分期系统[J].中国肺癌杂志,2016,19(7):425-436.
[7]王利欢,王卫,陈玉萍,等.126例胸腺瘤伴重症肌无力患者临床特点及预后[J].中华放射肿瘤学杂志,2016,25(1):37-41.
[8]Weksler B,Pennathur A,Sullivan JL,et al.Resection of thymoma should include nodal sampling[J].J Thorac Cardiovasc Surg,2015,149(3):737-742.
[9]Detterbeck FC,Zeeshan A.Thymoma:current diagnosis and treatment[J].Chin Med J(Engl),2013,126(11):2186-2191.
[10]贾佳,李月敏.术后放疗在胸腺瘤中的作用及研究进展[J].实用医学杂志,2016,32(15):2573-2575.
[11]ScorsettiM,LeoF,TramaA,etal.Thymomaandthymiccarcinomas[J].CritRevOncolHematol,2016,99(6):332-350.
[12]Lee JH,Park CM,Park SJ,et al.Value of computerized 3D shape analysis in differentiating encapsulated from invasive thymomas[J].PLoS One,2015,10(5):e0126175.
