他莫昔芬对乳腺癌MCF- 7细胞侵袭能力的影响及其作用机制
2018-06-13王捷王岩朱芸
王捷,王岩,朱芸
南阳医学高等专科学校第一附属医院1药学部,2外科教研室,3心血管内科,河南 南阳473000
乳腺癌是女性恶性肿瘤中占据比例较大且预后不佳的生殖系统疾病[1]。乳腺癌的发病原因与雌激素受体(estrogen receptor,ER)的作用密切相关[2]。ER表达的乳腺癌被称为ER阳性乳腺癌[3]。他莫昔芬(Tamoxifen,TAM)可与ER结合切断雌激素对乳腺癌细胞的刺激作用,是一种选择性ER调节剂,可阻止癌细胞的生长[4]。但相关研究表明,仅仅抑制ER是不够的,TAM具有类似雌激素的作用,能提高血管内皮细胞生长因子(vascular endothelial growth factor,VEFG)水平,提高肿瘤组织产生新生血管的能力,促进癌细胞的浸润和转移[5];同时还能提高基质金属蛋白酶-2(matrix metalloproteinases-2,MMP-2)、基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)水平,协同增强新生血管的形成能力。本研究探讨TAM对乳腺癌MCF-7细胞侵袭能力的影响及其作用机制,现报道如下。
1 材料与方法
1.1 细胞
乳腺癌MCF-7细胞株购自重庆医科大学基础研究实验室。
1.2 实验仪器与药品
高糖DMEM培养基、无酚红高糖DMEM培养基、胎牛血清购自Gibco公司;DMSO培养基、TAM、明胶均购自Sigma公司;RNA提取试剂盒、逆转录试剂盒以及实时荧光定量PCR试剂盒均购自日本TaKaRa公司。仪器中CO2培养箱购自Thermo公司;制胶、电泳和转印系统,Chemi Doc XRS+凝胶成像系统,CFX Connect实时荧光定量PCR仪均购自Bio-Rad公司。
1.3 细胞培养
MCF-7细胞培养采用含10%的胎牛血清、100 U/ml青霉素及100 μg/ml链霉素的高糖DMEM培养基在37℃及5%CO2条件下孵育。待细胞融合率达90%时进行传代培养。
1.4 细胞分组及实验方法
取对数生长期MCF-7细胞。给药前将耗竭细胞本身的内源性雌激素改用无血清无酚红高糖DMEM培养基培养24 h。将MCF-7细胞接种至6孔板中,过夜,直至细胞贴壁。设对照组、TAM组。对照组用无血清无酚红高糖DMEM培养基继续培养24 h,TAM组用含1 μmol/L TAM的无血清无酚红高糖DMEM培养基培养24 h,每组5个复孔。
1.5 Western blot法测定MMP- 9、MMP- 2、VEGF蛋白水平
采用BCA蛋白定量法测定MMP-9、MMP-2、VEGF蛋白:向其中加入Loading Buffer在95℃条件下变性15 min,12 000 r/min离心10 min,保存于-80℃冰箱中用于蛋白表达水平检测。将每孔10 μl样品加入含10%的十二烷基硫酸钠(lauryl sodium sulfate,SDS)的聚丙烯凝胶中电泳分离90 min,分离完毕后切胶,制作三明治盒。冰水中转膜2 h。5%脱脂奶粉封闭2 h。一抗(Bcl-2、Bax、Actin,1∶1000)常温孵育2 h,TBST洗膜3次,每次12 min,二抗(1∶5000)常温孵育1 h,TBST洗膜3次,每次8 min,加入ECL发光液后,转入暗室,化学发光法曝光感光底片,显影定影洗涤后烘干裁片保存。
1.6 RT-PCR 法 测 定 MMP- 9、MMP- 2、VEGF mRNA水平
按TRⅠzol试剂说明书要求提取RNA。逆转录反应条件参照TaKaRa M-MLV逆转录酶说明书。PCR反应体系:cDNA1.0 μl,2×Premix Taq 10 μl,上、下游引物各10 pmol,加双蒸水至总体积20 μl。PCR反应条件:94℃5 min预变性;94℃ 30 s变性,59℃45 s退火,72℃1 min延伸,34个循环;72℃延 伸 10 min。 β-actin 正 义 引 物 序 列 为 5′-TGGATCCTGTGGCAT-CCATGAAAC-3′,反义引物序列为5′-TAAAACG-CAGTAACAGTCC-3(′350 bp);Bcl-2正义引物序列为5′-TGCACCTGACGCCCTTCA-3′,反义引物序列为 5′-AGA-CAGCCAGGAGAAATCAAACA-3(′291 bp);Bcl-xL正义引 物 序 列 为5′-ATGTCTCAGAGCAACCGGGAGC-3′,反义为 5′-GCGATCCGACTCACCAATACCT-3(′500 bp);XⅠAP正义引物序列为5′-ATGATACCATCTTCCAAAATCC-3′,反 义 为 5′-TTCTGTAATGAAGTCTGACTT-3(′200 bp)。PCR反应结束取产物5 μl于12 g/L琼脂糖凝胶电泳。采用Quantity One软件进行分析,以β-actin作为内参照,以靶基因与β-actin光密度的比值作为mRNA的表达丰度,进行半定量检测。
1.7 Transwell法
采用Transwell侵袭实验检测细胞侵袭能力,按照文献[6]操作。各组MCF-7细胞侵袭能力=穿过Matrigel胶微孔滤膜的细胞数/空白对照穿过Matrigel胶微孔滤膜的细胞数。
1.8 统计学方法
采用SPSS 16.0统-计软件进行数据分析,计量资料以均数±标准差(±s)表示,两组间比较采用t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 VEGF、MMP- 9、MMP- 2蛋白表达水平的比较
TAM组MCF-7细胞中的VEGF、MMP-9、MMP-2蛋白表达水平均明显高于对照组,差异均有统计学意义(P<0.01)。(表1)
表1 两组MCF- 7细胞中VEGF、MMP- 9、MMP- 2蛋白表达水平的比较(%,±s)

表1 两组MCF- 7细胞中VEGF、MMP- 9、MMP- 2蛋白表达水平的比较(%,±s)
组别对照组TAM组t值P值VEGF 100.4±2.1 157.9±13.6 10.235<0.01 MMP-9 100.9±3.3 181.2±23.8 8.186<0.01 MMP-2 100.0±1.6 172.4±21.5 8.226<0.01
2.2 VEGF、MMP- 9、MMP- 2 mRNA表达水平的比较
TAM 组 MCF-7细胞中的VEGF、MMP-9、MMP-2mRNA相对表达水平均明显高于对照组,差异均有统计学意义(P<0.01)。(表2)

表2 两组MCF- 7细胞中VEG-F、MMP- 9、MMP- 2 mRNA相对表达水平的比较(x± s)
2.3 细胞侵袭能力的比较
TAM组MCF-7细胞的侵袭能力相对数为(34.9±5.9),明显高于对照组的(12.6±3.4),差异有统计学意义(t=8.022,P<0.01)。(图1)
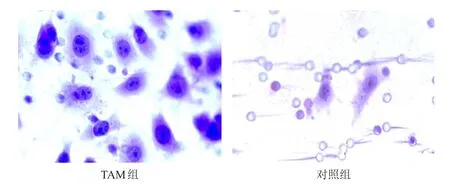
图1 两组MCF- 7细胞侵袭实验结果(HE染色,×400)
3 讨论
乳腺癌是临床上常见的生殖系统恶性肿瘤,对中国女性的健康危害极大。目前常采用内分泌治疗并取得较满意的效果。雌激素通过调节或拮抗经典的雌激素受体ER-α、ER-β所参与的各个生理过程来实现降低乳腺癌细胞中抗凋亡的Bcl-2表达,增加促凋亡的Bax表达能力,从而促使癌细胞凋亡[7]。TAM为一种非固醇类ER拮抗药,通过竞争性抑制ER发挥抑制增殖分化的能力从而治疗乳腺癌[8]。但近年来的研究发现,TAM也发挥类似雌激素作用[8],主要体现在其活性代谢产物4-羟基他莫昔芬(4-OHT)具有雌激素样作用,可促进ER-α阴性乳腺癌SR-BR-3细胞的增殖,同时可增强子宫内膜癌Tshikawa和KLE细胞的增殖与侵袭能力,提高其MMP-9、MMP-2蛋白及MMP-9、MMP-2mRNA的表达和活性[9]。提示拮抗ER-α受体治疗乳腺癌具有一定的局限性,需辅助抑制相关雌激素样作用,降低不良反应发生率。
肿瘤组织生长的关键是形成新生血管。VEGF是一种具有强作用的促血管内皮细胞分裂剂[10]。与相应受体结合后刺激血管内皮细胞增生,形成新的血管和基质。研究报道,VEGF表达与乳腺癌预后有关,高水平的VEGF可促进乳腺癌远处转移[11]。有学者认为乳腺癌中VEGF的表达与MMP-2、MMP-9有关,提示VEGF、MMP-2、MMP-9在乳腺癌中协同刺激肿瘤血管形成,促进细胞外基质的降解和癌细胞的侵袭转移[12]。本研究结果显示,TAM组MCF-7细胞中的VEGF、MMP-9、MMP-2蛋白表达水平均明显高于对照组,差异均有统计学意义(P<0.01);TAM组MCF-7细胞中的VEGF、MMP-9、MMP-2mRNA相对表达水平均明显高于对照组,差异均有统计学意义(P<0.01),说明TAM在拮抗ER-α受体的同时,发挥雌激素样作用,促进乳腺癌细胞的侵袭和转移,影响预后效果。
目前研究TAM的耐药机制可能为:①ER-α的突变与缺失,主要由于部分耐药肿瘤细胞编码ER-α 351位酪氨酸基因突变,被天冬氨酸占据。②ER-β表达的变化,李鹏程等[13]报道由Fos-Jun异源二聚体与Jun-Jun同源二聚体组成的AP-1转录因子,通过AP-1位点途径的作用,使ER-β异常激活或过度表达,引起乳腺癌患者耐药现象的发生。③生长因子信号通路激活ER,ER和生长因子受体通路之间存在相互作用。研究发现,乳腺癌患者中ER-α、ER-β的高表达可增加生长因子信号蛋白(EGFR/HER2)及下游MAPK的活性,通过EGFR-Ras-Raf-MAPK磷酸级联反应,使ER A/B区的第118位丝氨酸磷酸化,ER以配体非依赖性的方式被激活[14]。④细胞激酶信号转导通路的改变,PⅠ3K/AKT/MTOR和MAPK/EPK信号转导通路是细胞内重要的传导通路,与乳腺癌的发生发展密切相关。MAPK和AKT作为重要的信号转导分子可发挥抑制细胞凋亡、促进细胞增殖的作用,可直接激活ER,是导致内分泌治疗耐受的关键原因。
本研究结果显示,TAM组MCF-7细胞的侵袭能力相对数明显高于对照组,差异有统计学意义(P<0.01),其机制可能与提高Bcl-2表达水平,降低BAX水平有关。在不利因素环境下,细胞会在基因调控下发生自动死亡,此过程为凋亡,对维持细胞正常活动具有重要意义。凋亡过程与Bcl-2家族和促凋亡蛋白(BAX)关系密切。Bcl-2可维持线粒体外膜的完整性,防止线粒体内细胞色素C等促凋亡分子进入细胞。BAX则可破坏线粒体外膜的完整性,促进各种凋亡分子进入细胞,发挥促凋亡作用。正常情况下,Bcl-2和BAX形成二聚体,作为调控细胞凋亡过程的开关。当外界条件刺激,二聚体分离,抑制细胞出现凋亡,继而引发肿瘤。已有研究证实,TAM作用于MCF-7细胞可提高乳腺癌细胞中Bcl-2表达水平,降低BAX表达水平[15]。与本研究结果一致。
综上所述,TAM可能发挥类雌激素功能,促进乳腺癌MCF-7细胞侵袭能力,这与其提高MCF-7细胞中VEGF、MMP-9、MMP-2蛋白表达有关。
[1]Wynder EL,Rose DP,Cohen LA.Diet and breast cancer in causation and therapy[J].Cancer,1986,58(8 Suppl):1804-1813.
[2]廉馨,史丹,李洪艳.新型雌激素受体ER-α36与乳腺癌[J].中国生物化学与分子生物学报,2015,31(1):34-37.
[3]杨成成,南克俊,张雅敏,等.细胞周期蛋白D1的高表达与雌激素受体表达及乳腺癌患者良好预后相关[J].细胞与分子免疫学杂志,2016,32(1):84-87.
[4]兰瑛,胡蝶,何琴.托瑞米芬对比他莫昔芬治疗乳腺癌安全性的系统评价[J].中国药房,2017,28(3):360-364.
[5]陈妍,王婧,徐旖旎,等.他莫昔芬对乳腺癌MCF-7细胞侵袭能力、MMP-9活性和表达的影响及机制[J].山东医药,2016,56(26):6-9.
[6]卢科莲,喻小兰,夏纪毅,等.黄芩素对宫颈癌Hela细胞增殖的抑制作用及机制探讨[J].山东医药,2014,54(27):4-7.
[7]许岩磊,陈曦琰,陈绪,等.三黄煎剂抑制Aurora激酶A增强乳腺癌MCF-7细胞对他莫昔芬治疗敏感性的研究[J].时珍国医国药,2015,26(12):2826-2829.
[8]朱庆,伍俊仪,袁杰,等.新型雌激素受体GPER在乳腺癌MCF-7细胞他莫昔芬耐药中的作用及机制[J].第三军医大学学报,2015,37(22):2249-2254.
[9]陈海霞,周业江,王璐璐,等.他莫昔芬对人胃癌细胞增殖和丝氨酸蛋白酶抑制剂9表达的影响[J].重庆医学,2016,45(7):873-875;879.
[10]朱振浩,陈家乐,伍丽青,等.miRNA参与的血管内皮生长因子及其信号通路调控在肿瘤血管生成中作用的研究进展[J].广东医学,2016,37(1):136-139.
[11]刘清华,于国华,刘雨清.CCR7和VEGF-C蛋白与乳腺癌预后之间的关系[J].中国病理生理杂志,2016,32(8):1457-1460;1465.
[12]张红霞,李洪利.乳腺浸润性导管癌中PTTG与MMP-2和MMP-9的表达及相关性[J].中国生物化学与分子生物学报,2015,31(6):616-623.
[13]李鹏程,刘玉玲,党群,等.巴多昔芬对子宫内膜异位症模型大鼠异位内膜组织中ERα、ERβ、AP-1、VEGF表达的影响[J].中华妇产科杂志,2016,51(7):541-543.
[14]邓婷婷,邹娇,陈彬,等.ER-α36对乳腺癌细胞Herceptin敏感性的影响[J].第三军医大学学报,2015,37(11):1080-1085.
[15]金伟,袁媛,汤继春,等.他莫昔芬与辛伐他汀对人乳腺癌细胞MCF-7的协同效应及机制[J].安徽医科大学学报,2017,52(5):677-681.
