供氢类添加剂与苯氧基乙苯共混热解的反应机理
2018-06-12沈德魁
周 娇 沈德魁 金 伟
(东南大学能源热转换及其过程测控教育部重点实验室, 南京 210096)
随着化石能源的日益枯竭和环境问题的日益严重,木质素成为代替化石能源生产芳香族化合物的重要来源,其开发利用受到广泛关注[1-4].由于木质素复杂的三维结构,国内外学者均采用木质素模型化合物的简化结构来研究其反应机理[5-10].β-O-4 作为木质素结构单元的主要连接方式,占木质素连接键总量的48%~60%[11].Britt等[12]利用真空闪速热解的方式在500 ℃条件下对苯氧基乙苯(PPE)及含有甲氧基支链的苯氧基乙苯类模型化合物进行热解特性的研究.木质素单独热解生成的产物油热值较低,含氧量高,稳定性差.共混热解是提高产物油品质的重要方式之一.采用有效液态供氢添加剂对木质素模型化合物热解反应提供了小分子自由基,稳定热解过程中生成的不稳定自由基增加了单体芳香族产物的产率.甲醇、乙醚和丙酮热解过程中产生H·等自由基,其中甲醇的有效氢碳比达到2[13-16].从供氢的角度上看,甲醇、乙醚和丙酮适合作为共混物与木质素进行共混热解反应.
本文采用苯氧基乙苯作为模型化合物,与甲醇、乙醚和丙酮进行共混热解反应,探究供氢添加剂对热解过程中芳香族产物的影响和共混热解反应机理,为木质素共混热解及高值化利用提供理论指导.
1 实验材料与方法
1.1 实验材料
实验选用的木质素模型化合物苯氧基乙苯(CAS 40515-89-7)购于艾森化工有限公司;供氢添加剂(甲醇,乙醚,丙酮)以及无水乙醇(AR,99.7%)均购于四川科龙试剂有限公司;石英砂选用60~80目,购于科密欧试剂有限公司.
1.2 实验装置与实验方法
实验采用的小型固定床热解反应装置[17]如图1所示.该装置由两段加热炉、石英玻璃反应管(反应段内径为20 mm,下段内径为8 mm,有效高度为300 mm)、进料器、气体质量流量控制器、温度显示仪和两级冷凝器等组成.实验前,先称量0.5 g 石英砂置于石英管反应器中的石英板上.连接实验装置,开启载气N2,控制流速为100 mL/min.同时启动升温程序,以10 ℃/min的升温速率达到设定温度并维持稳定后,用微量注射泵注入反应物进行实验,以2 g/h的速率将反应原料PPE注入反应管内,PPE总进料量为0.5 g,反应时间15 min,吹扫时间5 min.采用二级冷凝管对热解气中可冷凝气体进行冷凝,每级冷凝管装有11 mL无水乙醇,将冷凝管置于温度约为-15 ℃的乙醇冷却槽中,从而达到对冷凝气的充分吸收.用乙醇收集产物油定量至约32 mL.
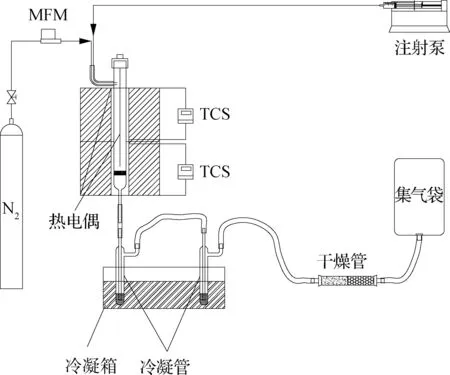
图1 固定床热解反应装置[13]
1.3 产物分析
冷凝管中收集的产物油通过气相色谱/质谱仪(GC/MS)(7890A/5975C,Agilent)进行检测.色谱柱型号为HP-5MS(30 m×0.25 mm×0.25 μm),分流比为30∶1.色谱GC升温程序为:初温40 ℃保持3 min,以5 ℃的升温速率升至180 ℃,保持2 min,再以10 ℃/min的升温速率升至终温280 ℃,保持2 min.质谱MS的运行条件为:电离能为70 eV,扫描速率为35~550 amu/s.在GC/MS分析仪上使用外标法对目标产物(见表1)进行定量计算.将每个目标化合物标准物质配成一定浓度梯度的标准溶液,经GC/MS检测后获得绝对峰面积-浓度的对应关系,拟合成标准曲线(可决系数R2>0.999 5)[18-19].根据该化合物的实际峰面积获得对应的浓度,进而得出该化合物的质量及反应过程中的质量产率.
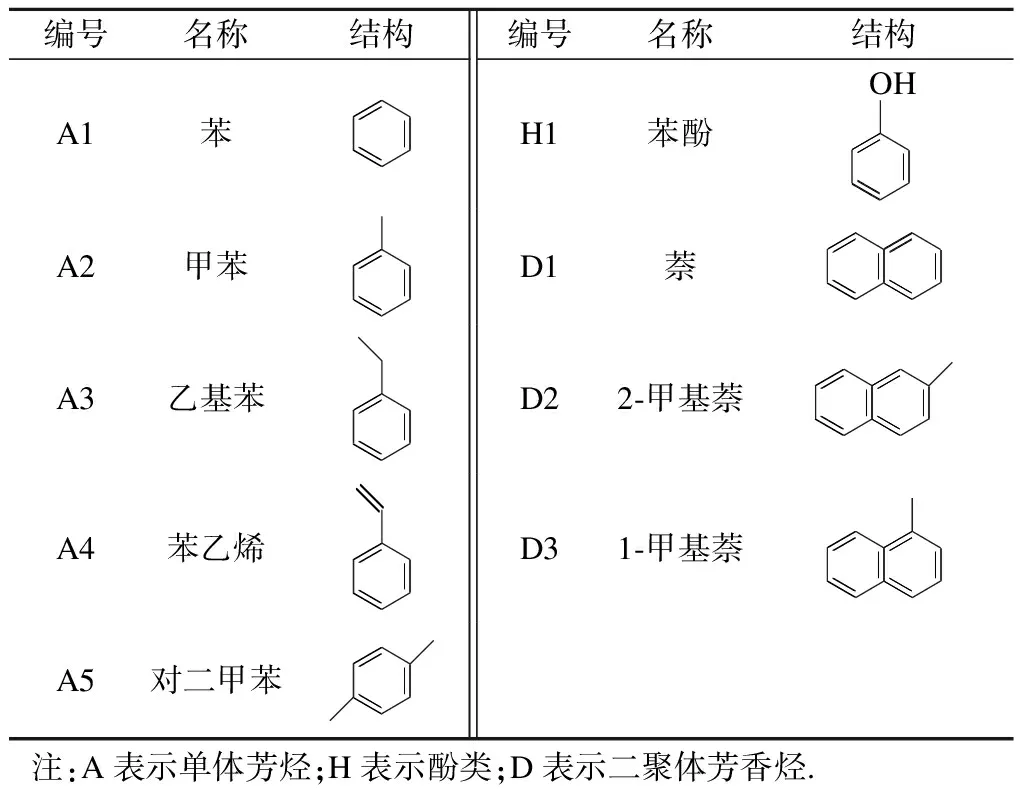
表1 PPE热解产物中主要芳香族化合物
2 结果与讨论
2.1 温度对PPE热解产物的影响
反应温度是影响热解反应过程和反应产物的重要因素之一.基于木质素的相关研究本文选取500,600和700 ℃三种反应温度对PPE进行直接热解,研究温度对PPE热解产物分布的影响[20-21].
在反应温度为500 ℃时,只有28.85%的PPE发生热解反应, 在较高温度(600和700 ℃)未检测到残余的反应物,这表明PPE在600 ℃左右发生完全热解.PPE在不同反应温度下直接热解单体产物的产率分布如图2(a)所示.由图可知,随着反应温度的升高,单体芳香族产物的总产率由500 ℃时的2.45%提高至700 ℃时的34.78%.各单体芳香族产物的产率随着温度的升高而逐渐提高,其中苯乙烯(A4)和苯酚(H1)作为PPE直接热解反应的主要单体产物,在700 ℃分别达到最高产率11.12%和11.44%.
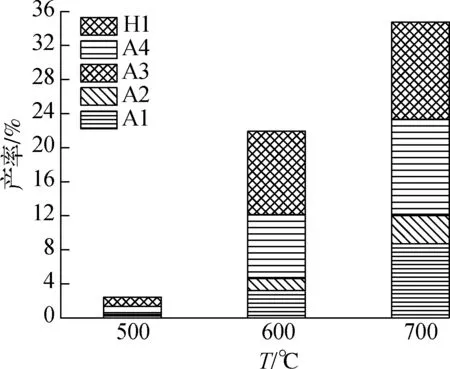
(a) 热解单体芳香族产物产率

(b) 热解二聚体芳香烃产率图2 PPE热解单体芳香族和二聚体芳香烃产率
图2(b)为PPE在不同反应温度下单独热解生成的二聚体芳香烃的产率分布.由图可知,PPE单独热解的唯一二聚体芳香烃为萘(D1).在500和600 ℃时未检测到萘,700 ℃时,萘的产率为1.27%.结果表明高温有利于PPE的热解,但也可能促进重聚反应生成更多的多聚体.
2.2 供氢添加剂对PPE热解产物的影响
由PPE直接热解产物分布及产率可知,700 ℃时PPE热解转化率为100%,且生成的单体芳香族产物产率最高.因此,选取700 ℃作为PPE与不同供氢添加剂共混热解的反应温度.共混热解实验中,0.5 g反应物(PPE)与供氢添加剂按一定的共混比例均匀注入到反应器中.PPE浓度为溶质PPE溶解在溶剂供氢添加剂中所得液体的浓度.PPE浓度越低,共混热解过程中所添加的供氢添加剂越多.
2.2.1 甲醇与PPE共混热解
本文主要研究了3种不同供氢添加剂对PPE热解产物的影响.其中添加甲醇供氢添加剂后,PPE热解单体产物的分布以及产率如图3(a)所示.由图可知,添加甲醇后的主要单体芳香族产物种类与图2(a)中PPE直接热解相同,但单体芳香族产物总产率有了明显的提高,表明甲醇的添加对PPE热解单体产物有明显的促进作用.PPE浓度为0.06 g/mL时总产率达到最高值62.62%.各单体芳香烃的产率随着PPE浓度的增大先增加后减小,在0.06 g/mL时达到最大值,其中主要产物苯(A1)和苯乙烯(A4)产率分别高达20.75%和15.66%.苯酚(H1)的产率也在反应浓度为0.06 g/mL 时达到最大产率17.33%.甲醇单独热解无芳香族产物生成,主要生成H2,CH4,CH2O等小分子气体,热解过程中甲醇的加入可能会提供足够多的H·自由基,稳定热解过程中生成的单环自由基,从而生成更多的单体芳香族产物[22-23].此外,单体产物产率的增加降低了聚合反应的可能性,减少了多聚体芳香族的生成[17,24].
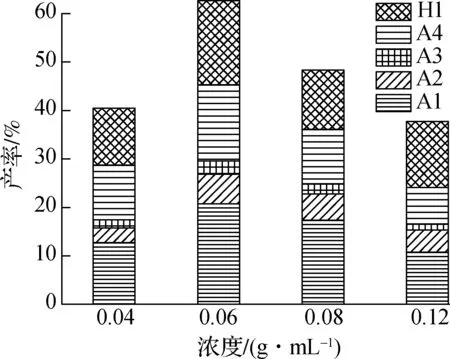
(a) 热解单体芳香族产物产率
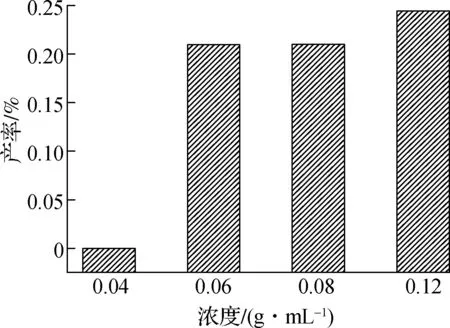
(b) 热解二聚体芳香烃产率图3 PPE与甲醇共混热解单体芳香族和二聚体芳香烃产率
PPE与甲醇共混热解生成的二聚体芳香烃分布如图3(b)所示,萘(D1)作为主要二聚体芳香烃,其产率随着PPE浓度的降低而减少.随着甲醇添加量的增加,二聚体芳香烃的生成逐渐减少.共混热解过程中甲醇提供的小分子自由基对单芳环自由基的稳定,一定程度上抑制了二聚体芳香烃的生成.
2.2.2 乙醚与PPE共混热解
乙醚单独热解主要以H2,CH4,C2H4,CH2O等气体产物为主,无目标芳香族产物的生成.图4(a)为PPE与乙醚共混热解单体芳香族产物的产率分布.由图可知,随着PPE浓度的降低,单体芳香族产物总产率在PPE浓度为0.12 g/mL时的最低产率为38.10%,在PPE浓度为0.06 g/mL时最低产率为46.04%,表明乙醚的添加可以促进单体芳香族产物的生成.单体芳香烃产物除苯乙烯(A4)外产物产率随着乙醚添加量的增加而逐渐增大,其中苯(M1)作为主要单体芳香烃产物产率由10.25% 逐渐升高至15.68%,这可能是随着乙醚的充分加入,提供更多的H·,CH3·,C2H5·与苯基自由基结合生成苯[14-15].在乙醚量为0.06 g/mL时,苯酚(H1)随着乙醚量的增加产率由15.73%逐渐降至最低产率12.63%,在乙醚量为0.04 g/mL时苯酚产率增加至13.92%,这可能是乙醚热解生成的小分子自由基抑制了苯氧基自由基的夺氢反应,减少了苯酚的生成[25].
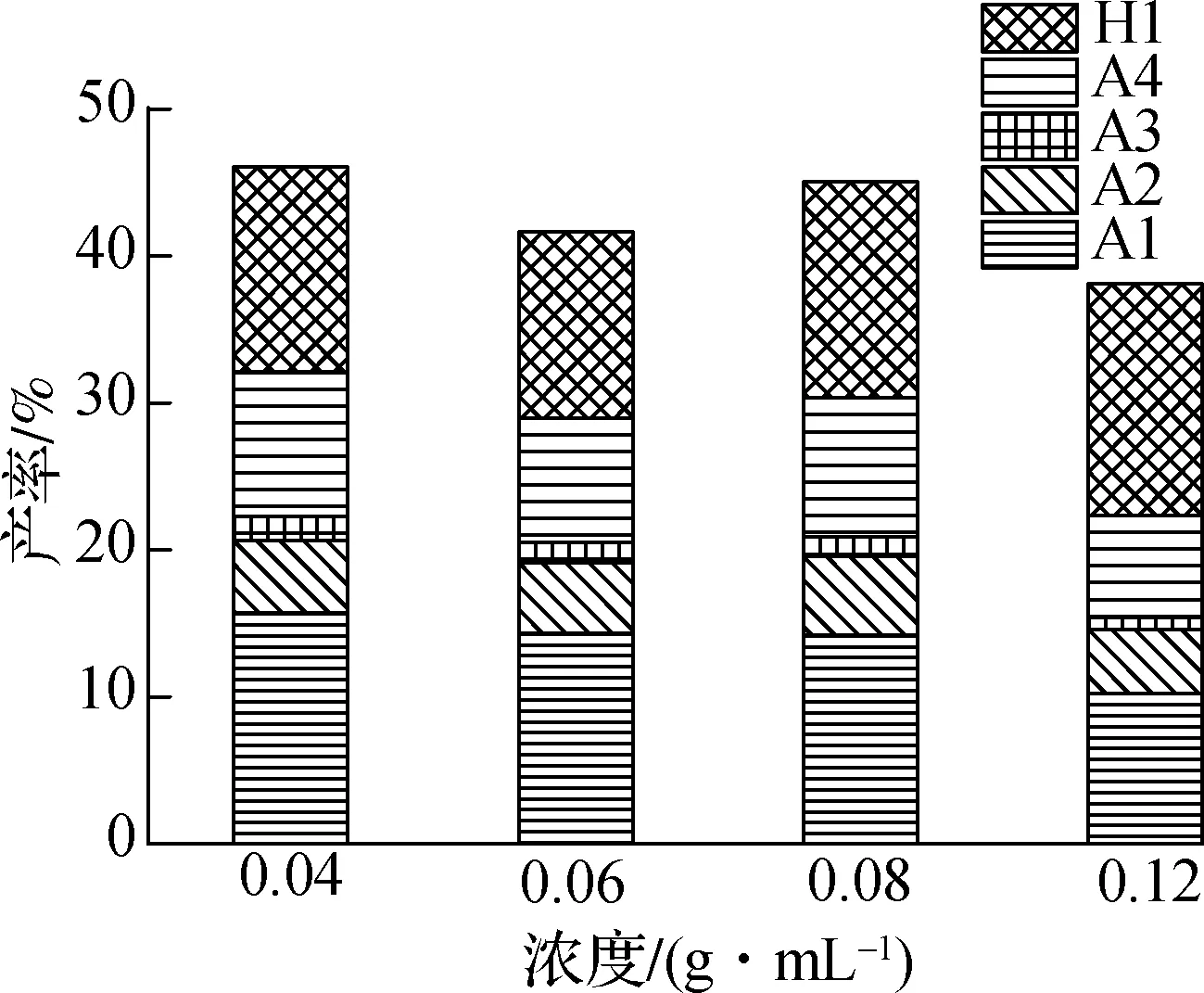
(a) 热解单体芳香族产物产率
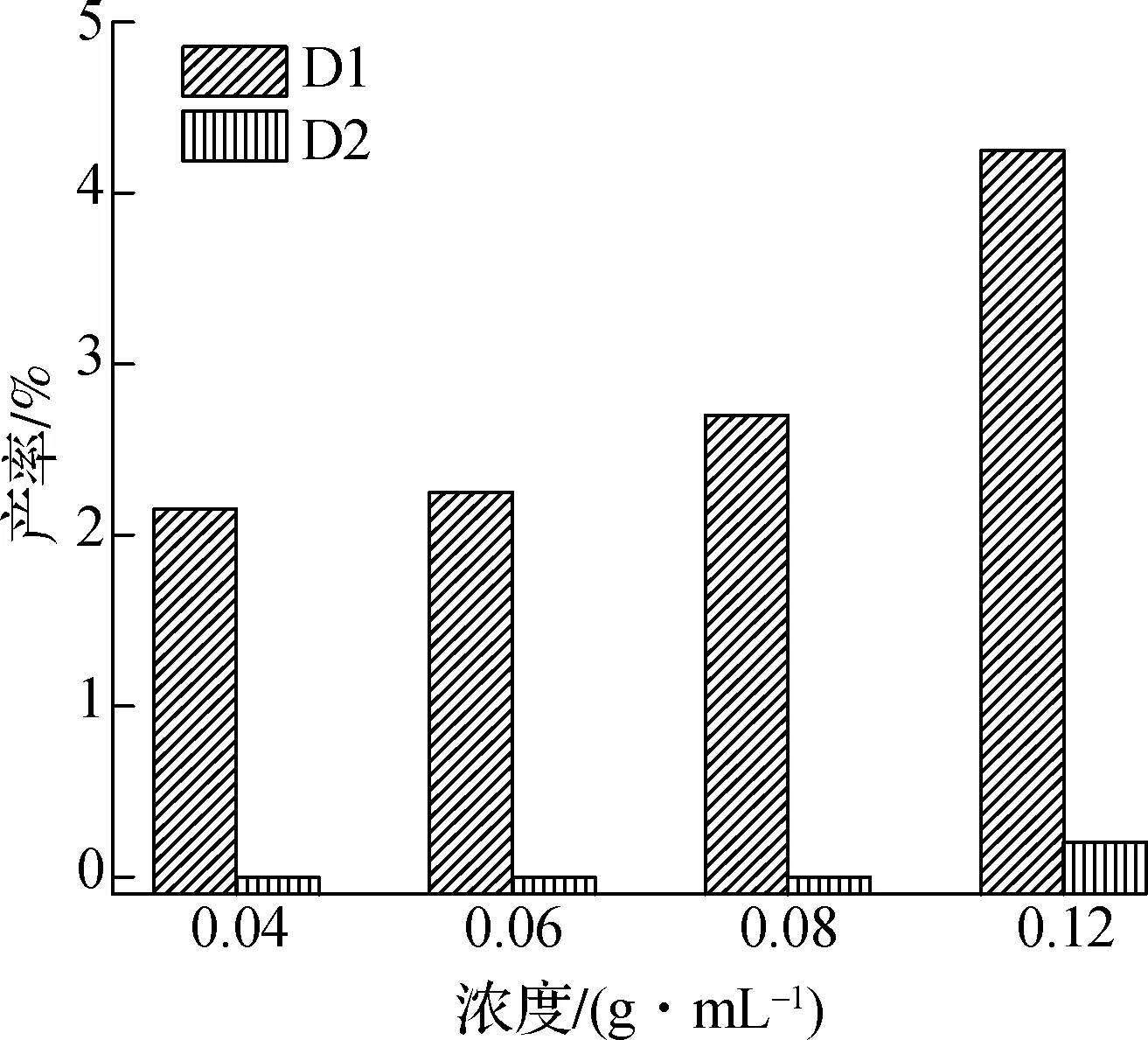
(b) 热解二聚体芳香烃产率图4 PPE与乙醚共混热解单体芳香族和二聚体芳香烃产率
图4(b)为PPE与乙醚共混热解二聚体芳香烃产率的分布.与PPE直接热解相比,添加乙醚后检测到2-甲基萘(D2),由此二聚体种类增多.由图可知,随着乙醚添加量的增加,二聚体芳香烃的产率逐渐降低,但仍高于PPE直接热解多聚体产物产率,乙醚的添加促进了二聚体的生成,但随着乙醚量的增加,二聚体的生成有所降低,这可能是由于大量乙醚热解吸收热量缓解了重聚反应.
2.2.3 丙酮与PPE共混热解
丙酮单独热解主要以CH4,H2,C2H4,C2H6等气体产物为主,同时还有无目标芳香族产物的生成[16,26].图5(a) 为PPE与丙酮共混热解单体芳香族产物产率分布.由图可知,PPE热解单体芳香烃产物种类增加至5种,其中对二甲苯(A5)为PPE与丙酮共混热解的典型产物.当PPE浓度为0.12 g/mL时,共混热解单体产物产率降低至33.58%,在PPE浓度为0.08 g/mL时,达到总产率最高值41.82%.在PPE浓度为0.08 g/mL时,苯(A1)的产率随着丙酮量的增加达到最大产率12.74%,之后有所降低.PPE与丙酮共混热解明显促进了甲苯(A2)的生成,其产率与乙基苯(A3)和苯乙烯(A4)一样呈波动变化,在PPE浓度为0.08 g/mL 时产率为11.66%.对二甲苯(A5)作为新检测到的单体芳香烃产物,其产率随着丙酮量的添加逐渐增多,在PPE浓度为0.06 g/mL时,达到相对最佳产率0.83%.苯酚(H1)作为典型和唯一的单体酚类产物,其产率随着丙酮量的增加而降低,这表明丙酮的添加抑制了PPE热解过程中苯酚的生成.
图5(b)为PPE与丙酮共混热解二聚体芳香烃产率的分布.与PPE直接热解相比,添加丙酮后二聚体芳烃的产率明显升高.萘(D1)和2-甲基萘(D2)随着丙酮添加量的增加在PPE浓度为0.08 g/mL时分别达到最大值2.91%和3.43%,随着添加量的进一步增加,产率逐渐降低至最低值1.97%和2.08%.1-甲基萘(D3)的变化规律与2-甲基萘相似,在PPE浓度为0.08 g/mL时1-甲基萘达到最大产率3.15%.结果表明,丙酮的添加,同时促进了PPE热解过程中单体芳香族产物和二聚体芳香烃的生成,这可能是因为丙酮热解生成CH3·,H·等小分子自由基的同时,生成了CH3CO·,CH3COCH2·相对复杂的自由基与苯基自由基,重组异构生成更多的二聚体,同时随着丙酮添加量的增加,其热解过程所需的热量增加,缓解了重聚反应,减缓了二聚体芳香烃的生成[16].
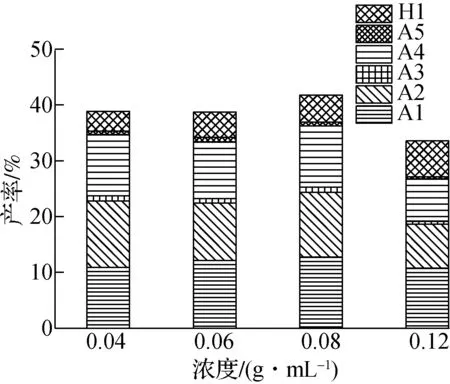
(a) 热解单体芳香族产物产率
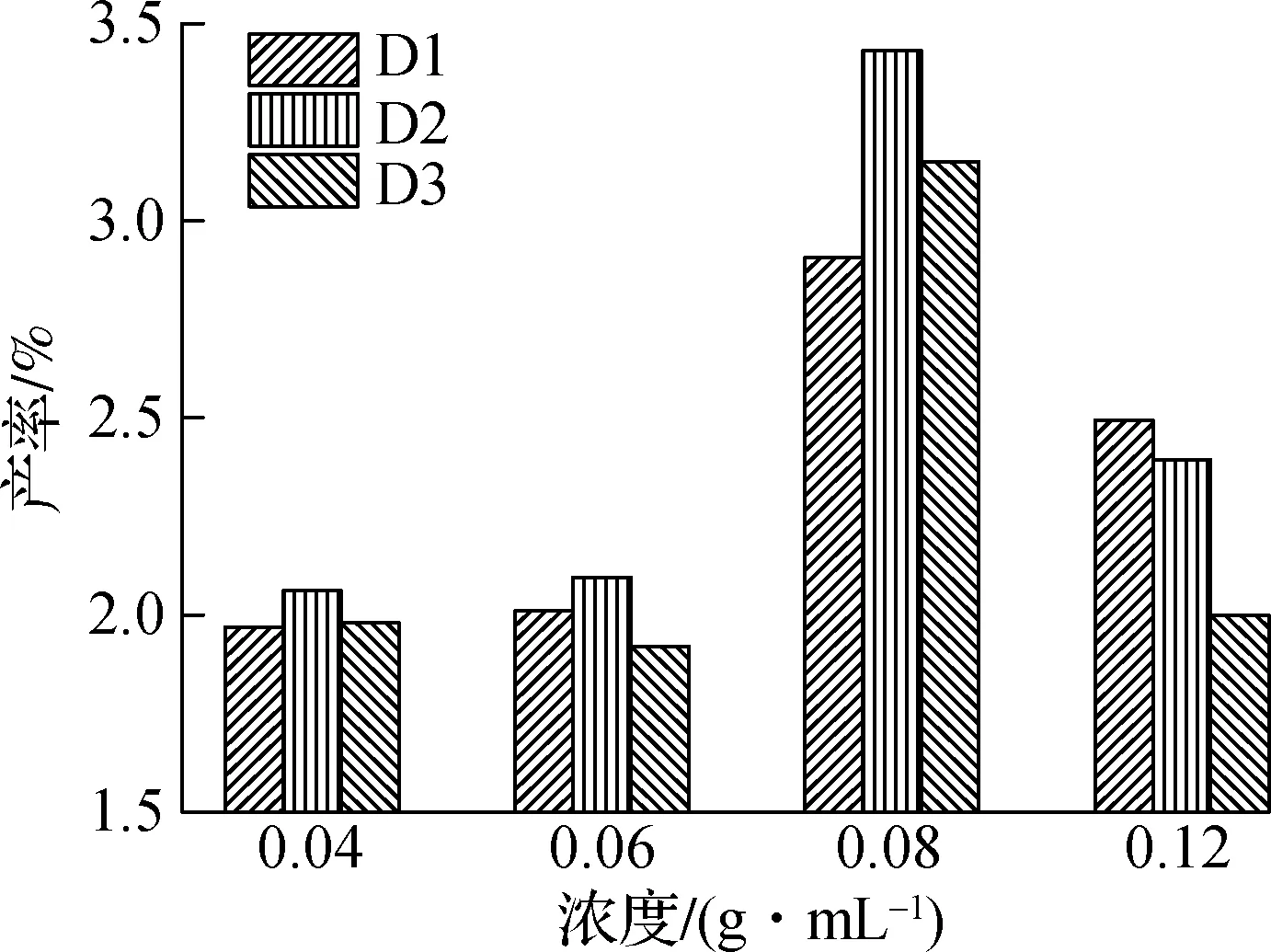
(b) 热解二聚体芳香烃产率图5 PPE与丙酮共混热解单体芳香族和二聚体芳香烃产率
2.3 PPE共混热解机理
结合PPE在小型固定床的热解实验结果以及文献[17,24]研究结果,分析了PPE热解过程中产物和自由基生成的可能反应,进一步探究了PPE共混热解机理,具体反应如下:
PhCH2CH2OPh→PhCH2CH2·+PhO
(1)
(2)
(3)
(4a)
(4b)
Ph·+H·→C6H6
(5)
Ph·+H·+CH3·→PhCH3
→CH3PhCH3
(6)
PPE的Cβ—O键的键解离能(272 kJ/mol)低于C—C键的键解离能(301 kJ/mol),PPE热解过程从Cβ—O键的均裂引发形成自由基(见反应(1))[27-28].苯乙烯(A4)主要由自由基PhCH2CH2·的脱氢反应生成.苯酚(H1)作为PPE热解主要单体酚类,由初期形成的自由基PhO·对PPE上α或β位进行吸氢反应形成(见反应(2)).添加供氢添加剂后,PPE热解产物苯(A1)的产率均有了明显的提高,可能是因为供氢添加剂热解产生的H·减少了Ph·对PPE的吸氢反应(见反应(3)),直接与H·结合生成苯(A1)(见反应(5)),促进PPE直接均裂生成较多的单环自由基,同时也促进了苯乙烯(A4)的生成(见反应(4)).PPE与甲醇共混热解明显促进了苯酚(H1)的生成,这可能是甲醇上羟基形成的H·优先与PhO·结合,生成了较多的苯酚[17].从乙醚和丙酮对苯酚的抑制作用也反映出醇羟基具有对苯酚的促进作用.在丙酮添加剂作用下,PPE热解产物甲苯(A2)产率明显提高,同时由对二甲苯(A5)的测出表明,丙酮热解生成的大量CH3·在与苯环自由基反应时可能存在与H·的竞争反应,促进了烷基类芳香族产物的生成(见反应(6)).
3 结论
1) PPE热解需要较高的热解温度,在700 ℃时完全热解,单体芳香族总产率逐渐升高,同时高温也促进了重聚反应生成二聚体.
2) PPE与供氢添加剂共混热解时,供氢添加剂热解生成H·,CH3·等小分子自由基,优先与单环自由基结合,促进了单体芳香族产物的生成.不同添加剂对单体芳香族产物的最佳反应浓度不同,与甲醇共混热解时,PPE浓度为0.06 g/mL时单体产物产率最佳,而与乙醚和丙酮共混热解的最佳浓度则分别为0.04和0.08 g/mL.
3) 合适的供氢添加剂能调控PPE热解产物的分布和产量.供氢添加剂热解产生的小分子抑制了大分子自由基之间的重聚,促进了苯、苯乙烯等单体芳香烃的生成.甲醇羟基形成的H·优先与PhO·反应,促进了酚类的生成.丙酮热解过程中的CH3·促进了甲苯、对二甲苯的生成.同时乙醚和丙酮较甲醇结构复杂,热解过程中有相对大的自由基形成,与PPE热解过程中的大自由基反应重聚,促进了二聚体的形成.
参考文献(References)
[1] 许洁,袁振宏,刘姝娜,等. 中国生物质能源发展现状、障碍与对策[J]. 太阳能学报,2012,33(S1):122-128.
Xu Jie, Yuan Zhenhong, Liu Shuna, et al. The development status, obstacles of biomass industry in China and countermeasures[J].ActaEnergiaeSolarisSinica, 2012,33(S1):122-128.(in Chinese)
[2] 张斌,武书彬,阴秀丽,等. 酸水解木质素的结构及热解产物分析[J]. 太阳能学报,2011,32(1):19-24.
Zhang Bin,Wu Shubin,Yin Xiuli,et al. Structure and pyrolysis product analysis of acid hydrolysis lignin[J].ActaEnergiaeSolarisSinica, 2011,32(1):19-24. (in Chinese)
[3] 黄金保, 伍丹, 童红, 等. β-O-4 型木质素二聚体中键离解能的理论计算[J]. 材料导报, 2013, 27(22): 108-110.
Huang Jinbao, Wu Dan, Tong Hong, et al. Theoretical calculation of bond dissociation energies for β-O-4 linkage lignin dimer [J].MaterRev, 2013,27(22): 108-110. (in Chinese)
[4] Lora J H,Glasser W G. Recent industrial applications of lignin: A sustainable alternative to nonrenewable materials [J].PolymEnviron, 2002,10(1/2): 39-48.
[5] Huber G W,Iborra S, Corma A. Synthesis of transportation fuels from biomass:Chemistry,catalysts,and engineering [J].ChemicalReviews, 2006,106(9):4044-4098.
[6] 王华静, 赵岩, 王晨, 等. 木质素二聚体模型物裂解历程的理论研究[J]. 化学学报, 2009, 67(9): 893-900. DOI:10.3321/j.issn:0567-7351.2009.09.003.
Wang Huajing, Zhan Yan, Wang Chen, et al. Theoretical study on the pyrolysis process of lignin dimer model compounds [J].ActaChimicaSinica, 2009,67(9):893-900. DOI:10.3321/j.issn:0567-7351.2009.09.003.(in Chinese)
[7] Younker J M, Beste A, Buchanan A C. Computational study of bond dissociation enthalpies for substituted β-O-4 lignin model compounds [J].ChemPhysChem, 2011,12(18): 3556-3565. DOI:10.1002/cphc.201100477.
[8] Beste A, Buchanan A C. Computational study of bond dissociation enthalpies for lignin model compounds. Substituent effects in phenethyl phenyl ethers [J].OrgChem, 2009,74(7): 2837-2841. DOI:10.1021/jo9001307.
[9] Elder T,Beste A. Density functional theory study of the concerted pyrolysis mechanism for lignin models [J].EnergFuel, 2014,28(8): 5229-5235. DOI:10.1021/jo9001307.
[10] Beste A, BuchananⅢ A C. Kinetic simulation of the thermal degradation of phenethyl phenyl ether, a model compound for the β-O-4 linkage in lignin[J].ChemicalPhysicsLetters, 2012,550: 19-24. DOI:10.1016/j.cplett.2012.08.040.
[11] Huang J B, He C. Pyrolysis mechanism of α-O-4 linkage lignin dimer: A theoretical study[J].JournalofAnalyticalandAppliedPyrolysis, 2015,113: 655-664. DOI:10.1016/j.jaap.2015.04.012.
[12] Britt P F, BuchananⅢ A C ,Cooney M J, et al .Flash vacuum pyrolysis of methoxy-substituted lignin model compounds [J].JournalofOrganicChemistry, 2000,65(5): 1376-1389. DOI:10.1021/jo991479k.
[13] Zhang H Y, Carlson T R, Xiao R, et al. Catalytic fast pyrolysis of wood and alcohol mixtures in a fluidized bed reactor [J].GreenChemistry, 2012,14(1):98-110. DOI:10.1039/c1gc15619e.
[14] Benson S W. Pyrolysis of dimethyl ether [J].TheJournalofChemicalPhysics, 1956,25(1): 27-31. DOI:10.1063/1.1742841.
[15] Hoehlein G, Freeman G R. Radiation-sensitized pyrolysis of diethyl ether: Free-radical reaction rate parameters [J].JournaloftheAmericanChemicalSociety, 1970,92(21): 6118-6125. DOI:10.1021/ja00724a004.
[16] Sato K, Hidaka Y. Shock-tube and modeling study of acetone pyrolysis and oxidation [J].CombustionandFlame, 2000,122(3): 291-311. DOI:10.1016/s0010-2180(00)00121-8.
[17] Shen D K, Jin W, Gu S. Enhancement of aromatic monomer production from pyrolysis of lignin-related β-O-4 contained model compound [J].JournalofAnalyticalandAppliedPyrolysis, 2017,127: 176-182. DOI:10.1016/j.jaap.2017.08.010.
[18] Choi G G, Oh S J, Lee S J, et al. Production of bio-based phenolic resin and activated carbon from bio-oil and biochar derived from fast pyrolysis of palm kernel shells [J].BioresourceTechnology, 2015,178: 99-107. DOI:10.1016/j.biortech.2014.08.053.
[19] Lou R, Wu S B,Lyu G J. Quantified monophenols in the bio-oil derived from lignin fast pyrolysis [J].JournalofAnalyticalandAppliedPyrolysis, 2015,111: 27-32. DOI:10.1016/j.jaap.2014.12.022.
[20] Yang H P, Yan R, Chen H P, et al. Characteristics of hemicellulose, cellulose and lignin pyrolysis [J].Fuel, 2007,86(12/13): 1781-1788. DOI:10.1016/j.fuel.2006.12.013.
[21] 赵静. 木质素快速热解催化重整制备芳香烃的研究[D]. 南京:东南大学能源与环境学院, 2016.
[22] Norton T S, Dryer F L. Toward acomprehensive mechanism for methanol pyrolysis [J].InternationalJournalofChemicalKinetics, 1990,22(3): 219-241. DOI:10.1002/kin.550220303.
[23] Aronowitz D, Naegeli D W, Glassman I. Kinetics of the pyrolysis of methanol [J].TheJournalofPhysicalChemistry, 1977,81(25):2555-2559. DOI:10.1021/j100540a037.
[24] Jin W,Shen D K, Gu S. Pyrolytic behavior of lignin-related α-O-4 contained model compound with addition of methanol [J].JournalofAnalyticalandAppliedPyrolysis, 2017,128:363-369. DOI:10.1016/j.jaap.2017.09.013.
[25] Vin N,Herbinet O, Battin-Leclerc F. Diethyl ether pyrolysis study in a jet-stirred reactor [J].JournalofAnalyticalandAppliedPyrolysis, 2016,121: 173-176. DOI:10.1016/j.jaap.2016.07.018.
[26] Mousavipour S H, Pacey P D. Initiation and abstraction reactions in the pyrolysis of acetone [J].TheJournalofPhysicalChemistry, 1996,100(9): 3573-3579. DOI:10.1021/jp9520613.
[27] Britt P F, BuchananⅢ A C, Cooney M J, et al. Flash vacuum pyrolysis of methoxy-substituted lignin model compounds [J].TheJournalofOrganicChemistry, 2000,65(5): 1376-1389. DOI:10.1021/jo991479k.
[28] Britt P F, BuchananⅢ A C, Malcolm E A. Thermolysis of phenethyl phenyl ether: A model for ether linkages in lignin and low rank coal [J].TheJournalofOrganicChemistry, 1995,60(20): 6523-6536. DOI:10.1021/jo00125a044.
