卵巢成熟性畸胎瘤恶变的术中冷冻切片分析
2018-06-12沈扬眉吴秀丽
孙 亮,沈扬眉,徐 炼,吴秀丽
四川大学华西第二医院病理科/出生缺陷与相关妇儿疾病教育部重点实验室,四川 成都 610041
成熟性畸胎瘤(mature cystic teratoma,MCT)是一种生殖细胞源性肿瘤,是女性最常见的卵巢肿瘤,约占所有卵巢原发肿瘤的20%[1]。MCT发生恶变非常罕见,发生率为0.17%~2.00%[2,3],MCT恶变缺乏特殊的临床改变,与MCT在影像学上难以区分,术前诊断困难,常需通过术中快速冷冻切片(frozen section,FS),明确诊断后便于临床医师开展分期手术。 本研究通过对18例MCT恶变病例的临床病理资料进行回顾性分析,将冷冻切片结果与最终诊断进行对比,并结合文献复习,以期提高对这类疾病的认识水平,改善术中冷冻切片诊断的准确性,避免治疗过度或不足以及不必要的二次手术。
1 资料和方法
1.1 一般资料
收集2008年9月—2017年9月于四川大学华西第二医院完成手术治疗的18例卵巢MCT恶变病例。复习临床病理资料并重阅切片。
1.2 方法
将术中送检卵巢肿瘤取材2~3块置于组织包埋托上,组织块周围用OCT胶包埋后置于LEICA CM1900冷冻切片机速冻台上,-20 ℃冷冻4 min,4 μm厚度切片,切片冷风吹干及H-E染色,在光镜下观察。冷冻送检后剩余手术标本经4%甲醛溶液固定,常规取材、脱水、石蜡包埋、4 μm厚度切片及H-E染色,在光镜下观察。将冷冻切片与石蜡切片进行对比研究。组织学分类以世界卫生组织(World Health Organization,WHO)女性生殖器官肿瘤分类标准(2014版)进行。
1.3 临床分期
肿瘤分期采用2013年国际妇产科联盟(International Federation of Gynaecology and Obstetrics,FIGO)分期标准。
2 结 果
2.1 临床资料
四川大学华西第二医院同时期完成9 213例卵巢MCT手术,其中5 790例卵巢MCT送检术中冷冻切片,18例(0.3%)患者发生恶变。本组患者年龄19~80岁,平均年龄51岁。患者主要临床症状是腹胀及腹部包块。发生恶变部位位于左侧卵巢10例,右侧8例。肿瘤分期ⅠA期12例,ⅡA期3例,ⅡC期1例,ⅢB期1例,ⅢC期1例。所有患者均完成盆腔超声检查,4例患者同时完成盆腔CT检查。17例患者术前检查血清肿瘤标志物(CA125、CA199、CEA和AFP),4例肿瘤标志物正常,13例有1项或多项指标升高。CA199升高者人数最多,共10例,升高范围为44.1~7 000.0 U/mL(正常值<30.9 U/ mL),均值为1 460.0 U/mL;CEA有6例患者升高,升高范围为3.6~284.0 ng/mL(正常值<2.5 ng/mL),均值为52.0 ng/mL;还有4例患者CA125升高,升高范围为46.9~202.0 U/mL(正常值<35.0 U/mL),均值为98.0 U/mL(表1)。
2.2 病理检查
2.2.1 眼观
肿瘤最大径7~28 cm,平均14 cm,13例肿瘤包膜完整,表面光滑,5例肿瘤与周围组织有粘连。切面:肿瘤呈囊性或囊实性,囊内均可见油脂及毛发,个别病例不明显(图1)。囊内壁可见结节状增厚区或团块状实性区,部分区域形成乳头或菜花状结构,质地较脆,常伴有出血、坏死。
2.2.2 镜检
所有肿瘤均可见MCT成分,包括分化好的鳞状上皮、皮肤附属器、脂肪组织及纤维结缔组织等。恶变成分为鳞状细胞癌8例、腺癌6例、腺鳞癌1例、恶性纤维组织细胞瘤1例、恶性黑色素瘤1例及类癌1例(图2~7)。
2.2.3 冷冻切片诊断与最后诊断对照
18例患者中冷冻切片诊断病变性质与最终诊断一致的有14例,冷冻切片诊断为MCT 4例,诊断为恶性肿瘤但不能明确肿瘤与MCT关系的10例,明确诊断MCT恶变4例(表2)。
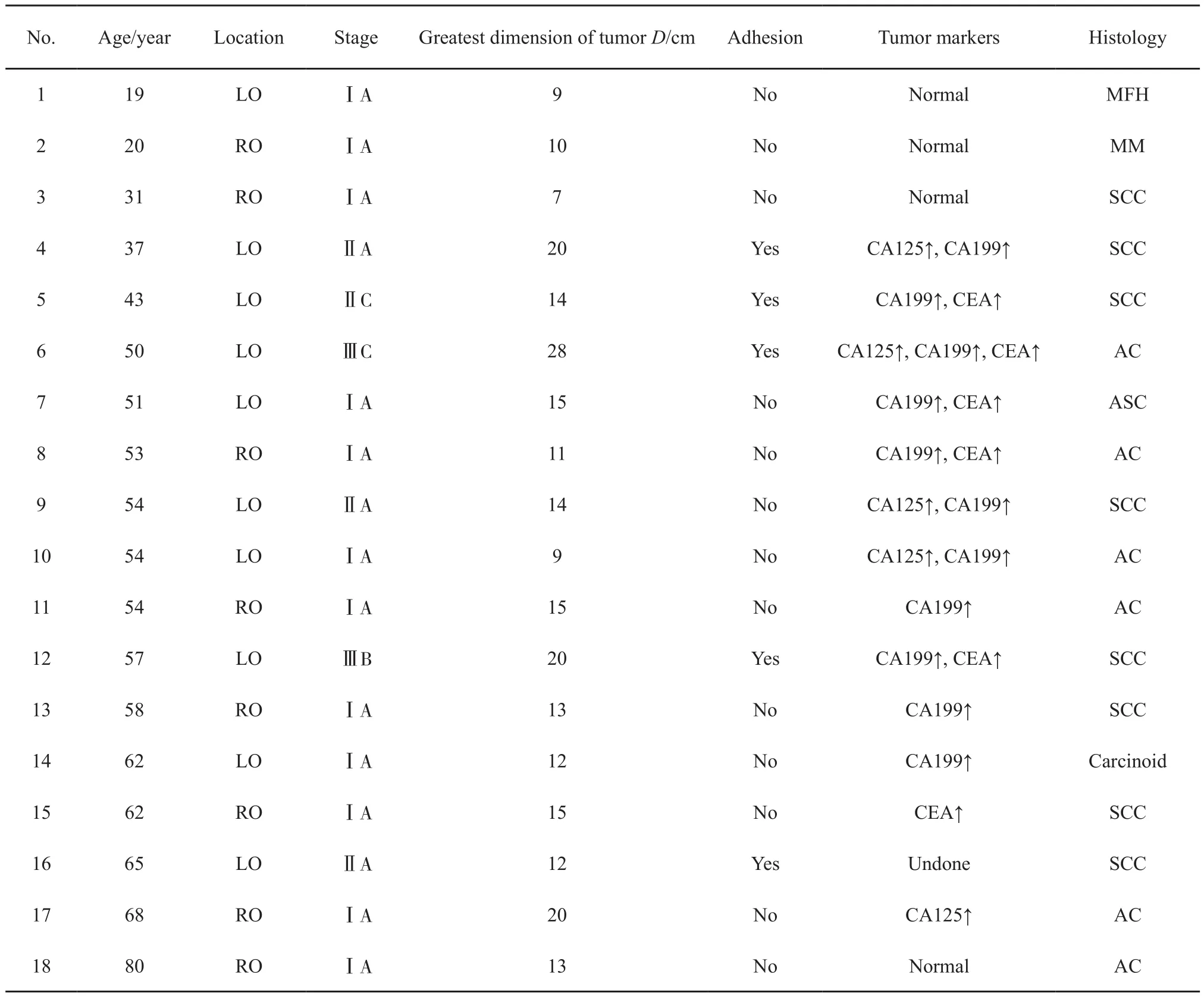
表1 18例患者临床病理资料Tab.1 Clinicopathologic features of the 18 cases

图1 囊内壁仅见少许皮脂(病例7:腺鳞癌)Fig.1 Only scanty adipose tissue is present in the cystic wall (case 7: adenosquamous carcinoma)
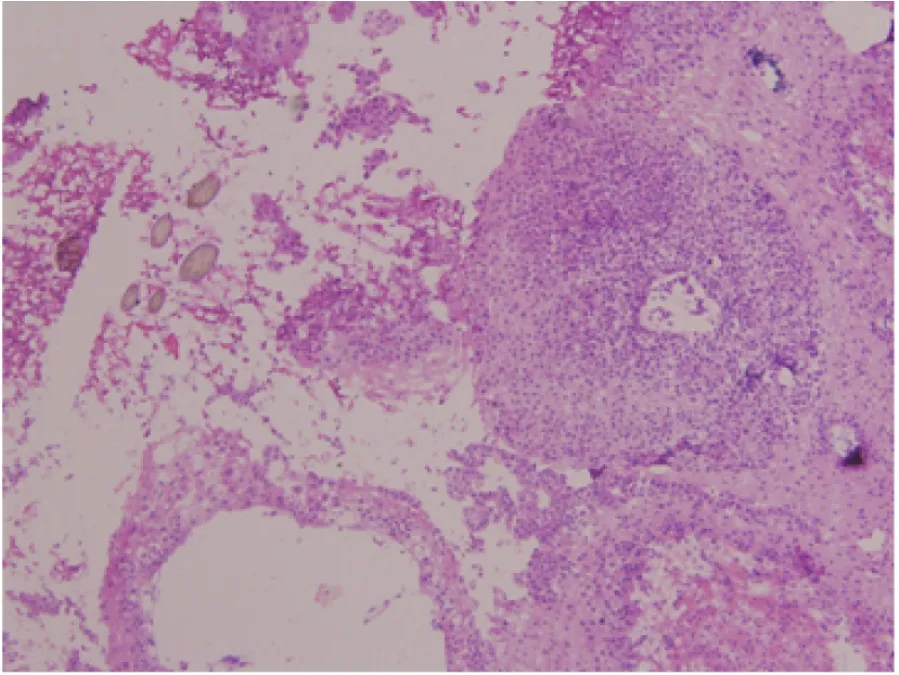
图2 少许毛干被腺鳞癌中的鳞癌组织所包绕(病例7:腺鳞癌)Fig.2 A few hair shafts are surrounded by squamous component of adenosquamous carcinoma (case 7: adenosquamous carcinoma)

图3 肿瘤细胞浸润囊壁,包绕毛干(病例1:恶性纤维组织细胞瘤)Fig.3 Tumor cells invade the cyst wall and surround hair shafts(case 1: MFH)
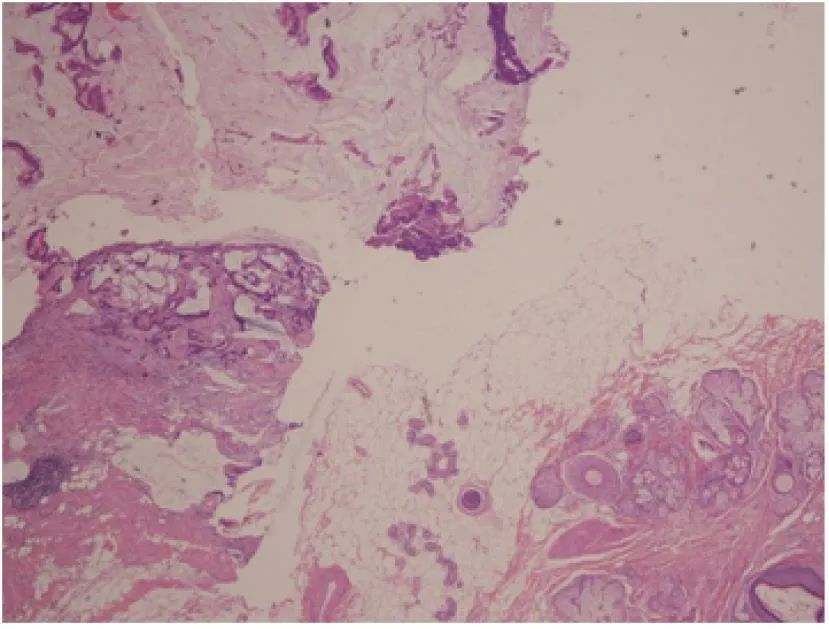
图4 畸胎瘤恶变成分为肠型腺癌时,可形成黏液湖,类似于消化道腺癌转移至卵巢改变(病例8)Fig.4 Adenocarcinoma arising from mature cystic teratoma can produce mucin pool which simulates metastatic adenocarcinoma from gastric and intestinal tract (case 8)
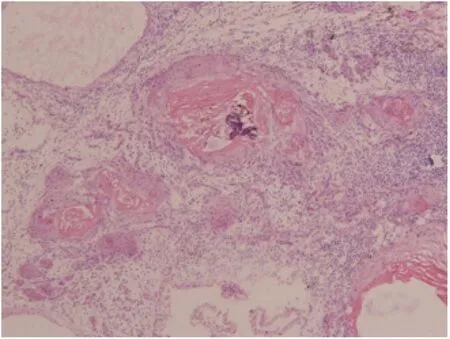
图5 在看似良性的囊壁区域查见鳞状细胞癌浸润(病例18)Fig.5 Tumor cells of SCC invasion can be found in benignlooking area of cyst (case 18)
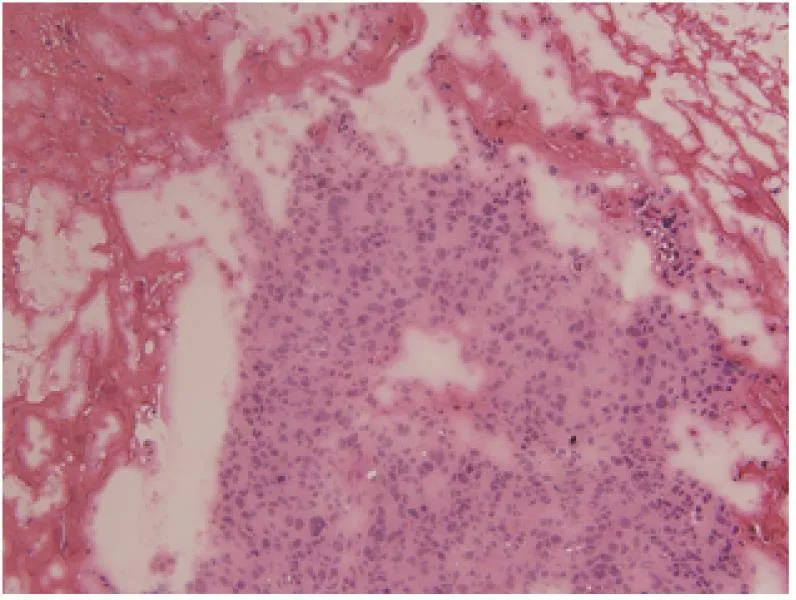
图6 在冷冻切片中未见黑色素(病例2:恶性黑色素瘤)Fig.6 No pigment can be seen in the slide of frozen section (case 2:malignant melanoma)
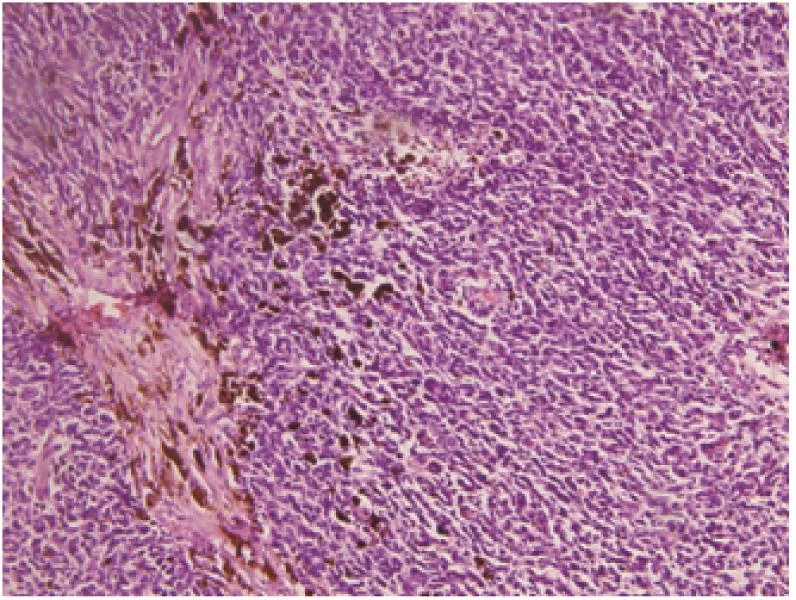
图7 对肿瘤经广泛取材后找到具有黑色素的肿瘤细胞(病例2:恶性黑色素瘤)Fig.7 Thorough sampling of the tumor revealed melanin pigment-containing tumor cells (case 2: malignant melanoma)
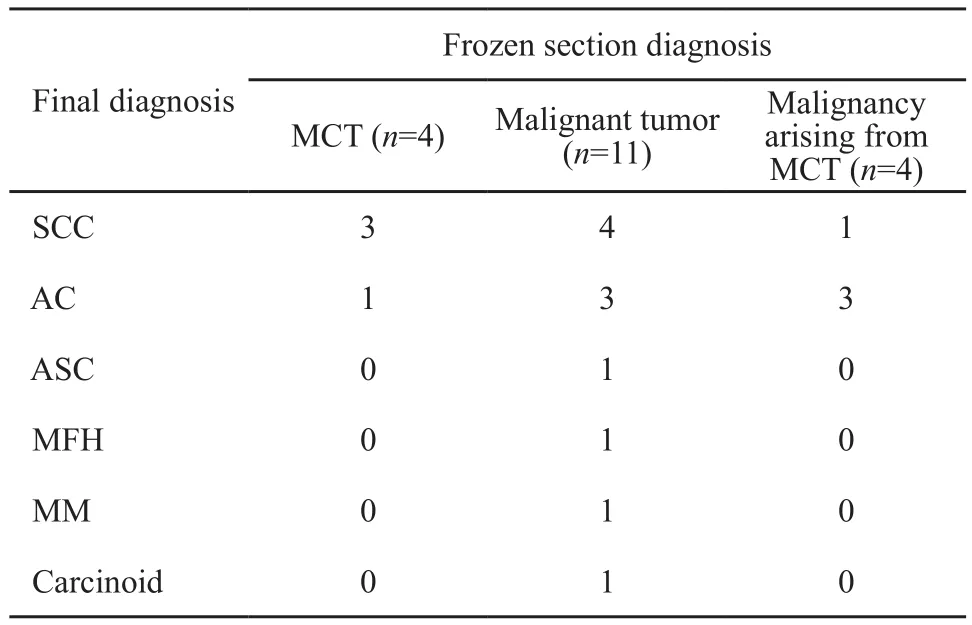
表2 冷冻切片诊断与最后诊断比较Tab2 Comparison of frozen section assessment and final diagnosis
3 讨 论
冷冻切片检查常用于术中鉴别病变性质,是一种成熟而可靠的方法,冷冻切片结果与最终诊断的一致性为92%~98%[4-5]。冷冻切片检查在妇科手术中起着重要作用,尤其是在卵巢肿瘤手术中,冷冻切片检查结果影响临床医师手术方式的选择,卵巢肿瘤组织学类型不同,其手术范围截然不同。是否切除子宫及对侧卵巢或保留生育功能,对于未生育的年轻妇女关系重大。卵巢是一个原发和转移肿瘤类型都相对多见的部位,这种多样性是冷冻切片检查与最后诊断不一致的一个重要原因。Acs[6]的研究证实,冷冻切片检查诊断卵巢肿瘤的准确性为86%~97%,低于身体其他部位发生的肿瘤。
MCT起源于具有全能分化的生殖细胞,包括外、中、内胚层结构,3个胚层均可发生各种组织学类型的恶变,最常见的是鳞癌,约占80%,其次是腺癌,约占7%,其他类型非常罕见[1]。由于病例数少,对于这类肿瘤的认识有限,尤其是鳞癌之外的类型,本研究收集的18例畸胎瘤恶变的病例中,非鳞癌类型占56%。MCT发生恶变患者通常年龄较大,发生鳞癌恶变多见于绝经后女性,Avci等[7]的研究发现,发生鳞癌恶变患者年龄常在45岁以上,但其他组织学类型由于更为罕见,尚缺乏大宗统计数据。本组患者平均年龄51岁,其中发生鳞癌组49岁,与文献报道一致,其他类型部分患者年龄较小,如恶性纤维组织细胞瘤和恶性黑色素瘤患者年龄分别是19和20岁,提示恶变成分组织学类型不同时,其发病年龄可能不同。MCT发生恶变没有特殊的临床表现,早期表现和MCT一致,术前诊断困难,最终确诊需通过术中冷冻切片或术后石蜡切片诊断。影像学检查和其他辅助检查虽然缺乏特异性,但能提示发生恶变。MCT中大量的油脂样物、毛发、软骨及甲状腺组织等具有明显的超声图像特征,但在其发生恶变时超声辨识度不高。CT能够提示卵巢MCT发生恶变,Parithivel等[8]报道,卵巢MCT发生鳞癌时,增强CT显示在加权影像内可见增强对比度的实性成分。然而,妇科医师常过于依赖超声检查,加做CT的意识不强,在本组18例患者中,仅4例术前完成了CT检查。血清肿瘤标志物水平的升高能够提示MCT发生恶变,Hackethal等[9]报道,患者卵巢MCT发生鳞癌时,其SCC、CA125、CEA及CA199等血清肿瘤标志物水平升高,但其升高水平与肿瘤体积和FIGO分期无关。由于例数较少,具体数值还需更多病例来确定。在本组完成血清肿瘤标志物检查的17例患者中,13例出现1项或多项血清肿瘤标志物水平升高,有4例患者血清肿瘤标志物水平正常,恶变的组织学类型1例是恶性黑色素细胞瘤,1例是恶性纤维组织细胞瘤,1例是鳞癌和腺癌,提示血清肿瘤标志物水平的改变可能与发生恶变的组织学类型有关。
MCT发生恶变由于难以在术前诊断,术中冷冻切片对于明确诊断和临床开展分期手术非常重要。但是,冷冻切片送检样本取材有限,存在遗漏病变的风险,本组病例中,冷冻切片结果与最终诊断的符合率为78%,远低于文献报道的数据,究其原因均为冷冻送检组织没有送检发生恶变的区域。因此,肉眼对病变的辨识显得尤为重要。MCT发生恶变时,具有一些肉眼可见的特点。高期别患者肿瘤常和周围组织发生粘连,本组中5例与周围组织粘连的患者FIGO分期在ⅡA以上。肿瘤囊壁内通常可见皮脂、毛发等成分,但有时可能因为恶性成分生长旺盛掩盖畸胎瘤成分,肉眼观类似于卵巢的上皮性肿瘤,如病例7,仅可见少许皮脂,未见毛发等成分,或仅镜下可见少许畸胎瘤成分(病例1和16)。肿瘤通常体积较大,Kikkawa等[10]报道,平均最大径>9.9 cm,本组患者肿瘤平均最大径>14.0 cm,但也需注意其中2例患者的肿瘤最大径<9.9 cm,分别是7.0和9.0 cm。恶变常位于囊内乳头状区、实性区及囊壁增厚区,质地脆,常伴有出血坏死。富琪等[11]的研究发现,发生鳞癌恶变的11例MCT中有2例表现为部分囊壁增厚,厚度为1~3 cm。卵巢囊肿内有乳头或实性成分易引起手术医师的注意,但囊壁增厚区域却容易被忽视造成病变遗漏。术中冷冻切片送检组织常由手术医师切取送检,在本组发生冷冻切片与最终诊断不一致的病例中,均为这种情况。某些发生鳞癌恶变的病例,其囊壁不一定出现显著增厚,在病例18中,在囊壁厚0.6 cm的区域,其内也查见鳞状细胞癌浸润灶。尤其病例3这种情况,肿瘤体积不大,血清肿瘤标志物水平不高,恶变区域表现为囊壁增厚,容易被临床忽视,导致病变遗漏而无法通过冷冻切片确定其病变性质。此外,Storms等[12]曾报道由于切面不同导致冷冻诊断与冻后石蜡诊断不一致的情况,在本组患者中未见这种情况出现,但是对这一情况应该关注,对于临床信息高度提示恶性,但冷冻送检组织不符合时可以与临床医师沟通后要求再送检,在本组有2例患者通过二次送检冷冻明确了病变性质。
MCT发生恶变如果肉眼能够准确辨识病灶并送检,术中冷冻对于判断肿瘤的性质未必困难,但是要确认是畸胎瘤发生恶变有时是比较困难的,在本组患者中,只有4例在术中冷冻切片明确是畸胎瘤发生恶变。MCT恶变的病理组织学诊断要点主要是同时存在成熟性囊性畸胎瘤成分和恶变成分,并除外其他恶性病变。MCT恶变为鳞癌时在镜下常常能够找到发生恶变的移行过渡区,而恶变成分为其他组织学类型时,有时难以判断肿瘤与畸胎瘤之间的关系,尤其冷冻切片送检组织非常有限。卵巢是发生转移性肿瘤类型非常丰富的部位,当恶变成分生长旺盛导致畸胎瘤成分不明显时,还需与转移性肿瘤相鉴别。恶变成分为腺癌时,若腺癌类型为肠型时可出现黏液湖,类似于消化道腺癌转移至卵巢改变(病例8),使得术中冷冻诊断困难。Stewart等[13]报道,术中冷冻切片对于区别卵巢肿瘤是原发还是转移只有中等程度敏感性。其他罕见组织学类型,如恶性黑色素瘤,肿瘤细胞可能出现无色素或少色素的情况,如病例1,术中冷冻切片送检组织中查见异型的梭形细胞肿瘤伴广泛出血坏死,未见色素,难以确定其恶变成分的具体类型,在对送检标本广泛取材后找到其具有色素的区域。上述这些情况均会给鉴别诊断增加难度。
综上所述,卵巢MCT发生恶变非常罕见,当患者年龄>45岁、肿瘤最大径>10 cm、肿瘤生长速度过快、肿瘤标志物升高及有影像学特征表现者,应高度怀疑卵巢MCT发生恶变,并及时进行术中冷冻切片检查。肉眼准确辨识病灶并送检,有助于术中冷冻切片明确病变性质,确保手术范围,利于最大限度清除病灶,准确进行临床分期,是决定预后的重要因素。充分取材有利于明确恶性成分与畸胎瘤的关系,便于鉴别诊断。
[1] KURMAN R J, CARCANGIU M L, HERRINGTON C S, et al.WHO classification of tumors of female reproductive organs[M]. Lyon: IARC Press, 2014: 60-66.
[2] COMERCI J T JR, LICCIARDI F, BERGH P A, et al. Mature cystic teratoma: a clinicopathologic evaluation of 517 cases and review of the literature[J]. Obstet Gynecol, 1994, 84(1): 22-28.
[3] SAKUMA M, OTSUKI T, YOSHINAGA K, et al. Malignant transformation arising from mature cystic teratoma of the ovary:A retrospective study of 20 cases[J]. Int J Gynecol Cancer,2010, 20(5): 766-771.
[4] WHITE V A, TROTTER M J. Intraoperative consultation/final diagnosis correlation relationship to tissue type and pathologic process[J]. Arch Pathol Lab Med, 2008, 132(1): 29-36.
[5] MAHE E, ARA S, BISHARA M, et al. Intraoperative pathology consultation: error, cause and impact[J]. Can J Surg, 2013,56(3): E13-E18.
[6] ACS G. Intraoperative consultation in gynecologic pathology[J]. Semin Diagn Pathol, 2002, 19(4): 237-254.
[7] AVCI S, SELCUKBIRICIK F, BILICI A, et al. Squamous cell carcinoma arising in a mature cystic teratoma[J]. Case Reports Obstet Gynecol, 2012, 2012: 314535.
[8] PARITHIVEL K, JAGANNATHAN J P, KRAJEWSKI K, et al.Ovarian squamous cell carcinoma arising from mature cystic teratoma[J]. Cancer Imaging, 2011, 11(1): 67-69.
[9] HACKETHAL A, BRUEGGMANN D, BOHLMANN M K, et al. Squamous-cell carcinoma in mature cystic teratoma of the ovary: systematic review and analysis of published data[J].Lancet Oncol, 2008, 9(12): 1173-1180.
[10] KIKKAWA F, NAWA A, TAMAKOSHI K, et al. Diagnosis of squamous cell carcinoma arising from mature cystic teratoma of the ovary[J]. Cancer, 1998, 82(11): 2249-2255.
[11] 富 琪, 魏丽惠, 回允中, 等. 卵巢成熟囊性畸胎瘤恶变[J]. 北京医科大学学报, 1998, 30(3): 70-72.
[12] STORMS A A, SUKUMVANICH P, MONACO S E, et al.Mucinous tumors of the ovary: diagnostic challenges at frozen section and clinical implications[J]. Gynecol Oncol, 2012,125(1): 75-79.
[13] STEWART C J, BRENNAN B A, HAMMOND I G, et al.Accuracy of frozen section in distinguishing primary ovarian neoplasia from tumors metastatic to the ovary[J]. Int J Gynecol Pathol, 2005, 24(4): 356-362.
