三种不同磁共振扩散加权成像模型在鉴别乳腺良恶性病灶中的价值研究
2018-06-12夏冰清黎鑫乐柴维敏
夏冰清,黎鑫乐,孙 琨,柴维敏
上海交通大学医学院附属瑞金医院放射科,上海 200025
在我国,乳腺癌是女性最常见的恶性肿瘤,其发病率逐年增高,发病年龄呈现年轻化趋势[1]。常规动态增强磁共振(magnetic resonance,MR)能够发现体格检查、超声及乳腺X线摄影所不能发现的乳腺癌[2],在乳腺良恶性病灶的诊断与鉴别诊断中扮演着越来越重要的角色,其诊断灵敏度高达85%~100%[3],但其诊断特异度相对较低,常造成患者接受不必要的活检[4]。随着扩散加权成像(diffusion-weighted imaging,DWI)技术的开展及应用,大大提高了MR的特异度,而且无需注射造影剂,临床应用前景广阔。近年来,DWI的一些扩展模型,如体素内不相干运动(intravoxel incoherent motion,IVIM)模型和扩散峰度成像(diffusion kurtosis imaging,DKI),已经在肝脏病灶[5]、直肠癌[6]和脑胶质瘤[7]等疾病诊断中有了一定的应用。本研究旨在探讨DWI的3种不同模型-单指数模型、IVIM模型和DKI模型在乳腺良恶性病灶中的鉴别诊断价值。
1 资料和方法
1.1 入组标准
本研究为前瞻性研究,收集2016年5月—2016年8月在上海交通大学医学院附属瑞金医院乳腺疾病诊治中心收治的乳腺病患者进行乳腺MR检查。纳入标准:乳腺超声或X线检查BIRADS 4类及以上患者。排除标准:① 乳腺MR检查前已进行穿刺检查、新辅助化疗或手术的患者;② 图像运动伪影较重。
1.2 MR检查方法
采用德国Siemens公司的Aera 1.5 T MR扫描仪,双侧乳腺4通道专用相控线圈,均为横轴位扫描。患者取俯卧位,双侧乳腺自然悬垂于专用乳腺表面线圈内。行双侧乳腺快速反转恢复(turbo inversion recovery magnitude,TIRM)序列,重复时间(repetition time,TR)/回波时间(echo time,TE)=5 240 ms/62 ms,层厚4 mm,视野(field of view,FOV):340 mm×340 mm。多b值DWI采用读出方向分段采样平面回波成像序列,DWI参数:TR/TE=9 500 mm/72 ms,层厚4 mm,FOV:384 mm×384 mm,b值分别取0、50、100、150、200、400、800、1 000、1 500、2 000和2 500 s/mm2,共11个b值,激励次数(number of excitation,NEX)分别为1、1、1、1、1、2、2、3、3、5和5,扫描时间共计14 min 17 s。最后行T1加权动态增强扫描,TR/TE=4.58 ms/1.89 ms,层厚1.5 mm,FOV:360 mm×360 mm。第1序列进行平扫后,静脉注射钆喷酸葡胺(Gddiethylenetriamine pentaacetic acid,Gd-DTPA),以2.0 mL/s的速度进行注射,其后以同样速率注入15 mL 0.9%NaCl溶液冲洗管腔内残留的Gd-DTPA,共采集5期增强扫描,每个时相扫描时间为90 s。
1.3 图像处理与数据分析
所有图像传送至第三方软件MATLAB(美国MathWorks公司产品)进行后处理,分别得到表观弥散系数(apparent diffusion coefficient,DADC)图、IVIM和DKI相关参数图,所有数据逐个像素按照不同公式进行拟合。
本研究使用单指数模型进行对照,选择b=50和1 000 s/mm2进行计算,其计算方程式[8]为:
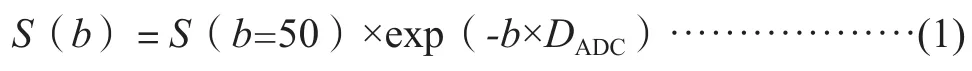
IVIM模型:选择0、50、100、150、200、400、800和1 000 s/mm2共8个b值进行数据采集,采用经典的两步计算法,其计算方程式[9]为:
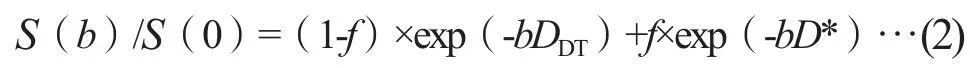
真实扩散系数(tissue diffusivity coefficient,DDT)反映纯的水分子扩散;灌注相关扩散系数(perfusion-related diffusivity coefficient,D*),也称为假扩散系数,反映微循环灌注的灌注系数;灌注分数(perfusion fraction,f)反映微循环灌注效应占总体扩散效应的容积率。高b值(>200 s/mm2)下,灌注信号基本完全衰减,D*远大于DDT,可简化为线性最小二乘法S(b)/S(0)=exp(-bD)公式计算获得DDT值。算得DDT值后,再将所有b值使用Least-Marquardt非线性最小二乘法[10]进行拟合计算,得出灌注相关扩散系数D*值和血管容积分数f值。
DKI模型:选择5个高b值(0、1 000、1 500、2 000和2 500 s/mm2)进行计算,其计算方程式[11]为:
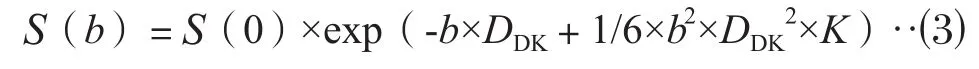
其中,扩散峰度系数(kurtosis coefficient,K)是一个无量纲的值,主要反映组织微观结构的复杂性;扩散系数(diffusivity coefficient,DDK)是矫正后的DADC值,即去除非高斯偏移后的DADC值。
在公式(1-3)中,b为扩散敏感梯度因子,S(0)为b=0 s/mm2时的DWI信号强度,S(b=50)为b=50 s/mm2时的DWI信号强度,S(b)为b>0 s/mm2时的DWI信号强度。
1.4 感兴趣区(region of interest,ROI)划定和参数计算
测量者①②分别为从事乳腺诊断9年和7年年资的放射科医师,两位测量者在不知道组织病理学结果的情况下分别阅片,各测量2次。使用MATLAB后处理软件,在b=50、1000 s/mm2的DADC图像上划取ROI,选择病灶实性成分最大层面,并且避开明显囊性变、坏死液化区,然后将ROI复制到其他参数图上,得出其他相应参数,所有参数均采用平均值。平均ROI大小为152 mm2(范围40~420 mm2)。
1.5 统计学处理
使用SPSS 21.0和MEDCALC 15.6统计学软件,P<0.05为差异有统计学意义(双尾侧方法)。所有患者的临床资料中,计数资料采用χ2检验、计量资料采用t检验;不同模型各参数值通过独立样本t检验;使用受试者工作特征(receiver operating characteristic,ROC)曲线确定各诊断参数的临界值及与该临界值相关的曲线下面积(area under curve,AUC),采用最大约登指数来确定各参数的临界值及相应的诊断灵敏度和特异度,所有参数的一致性检验通过比较组内与组间相关因子实现,其中组内一致性检验使用测量者的2次测量结果来评估,组间一致性检验则由2位测量者的第1次测量结果来评估。当组内相关系数(intraclass correlation coefficient,ICC)大于0.75视为一致性好,0.50~0.75视为一般,小于0.5视为很差[12]。
2 结 果
2.1 临床病理资料
共入选80例患者(83个病灶),年龄27~70岁,良性组患者平均年龄(40.1±7.2)岁(范围27~51岁),恶性组患者平均年龄(50.7±9.3)岁(范围35~70岁),两组间差异有统计学意义(P<0.001)。良恶性病灶在病灶大小方面的差异有统计学意义[(2.0±1.3)vs(2.5±1.3);P=0.005]。良性病灶中肿块样强化的病灶有31个,非肿块样强化的病灶有7个;恶性病灶中肿块样强化的病灶有33个,非肿块样强化的病灶有12个。
所有病例均经组织病理学或粗针穿刺活检确诊,良性病灶共38个,包括腺病11个、纤维腺瘤16个、纤维腺瘤合并导管乳头状瘤1个、导管内乳头状瘤5个、肉芽肿性小叶性乳腺炎1个、分叶状肿瘤2个、导管扩张伴炎性反应1个、囊肿伴感染1个。恶性病灶共45个,包括浸润性导管癌20个、浸润性导管癌合并导管原位癌13个、导管原位癌9个、浸润性导管癌合并黏液癌2个、淋巴瘤1个。
2.2 单指数模型、IVIM模型和DKI模型各参数值的组内组间一致性评价
DADC值、DDT值、D*值、K值和DDK值的一致性检验结果均大于0.75,具有良好的组内组间一致性。但是f值的组间一致性ICC为0.656,视为一般,而组内一致性ICC为0.824,视为良好。
2.3 乳腺良恶性病灶的不同参数值
恶性病灶中的DADC、DDT和DDK值均明显低于良性病灶,差异有统计学意义(P<0.001)。良恶性病灶的DADC值分别为(1.44±0.36)×10-3和(0.91±0.14)×10-3mm2/s,DDT值分别为(1.43±0.36)×10-3和(0.88±0.13)×10-3mm2/s,DDK值分别为(1.77±0.43)×10-3和(1.13±0.19)×10-3mm2/s,差异均有统计学意义(P均<0.001,表1)。而恶性病灶的K值明显高于良性病灶(0.87±0.11 vs 0.61±0.12),差异有统计学意义(P<0.001);另外D*和f值均在良恶性病灶之间存在较大重叠,差异均无统计学意义(P均 >0.05)。
表1 乳腺良恶性病灶不同模型各参数特征Tab.1 Characteristics of different parameters of benign and malignant breast lesions(±s)
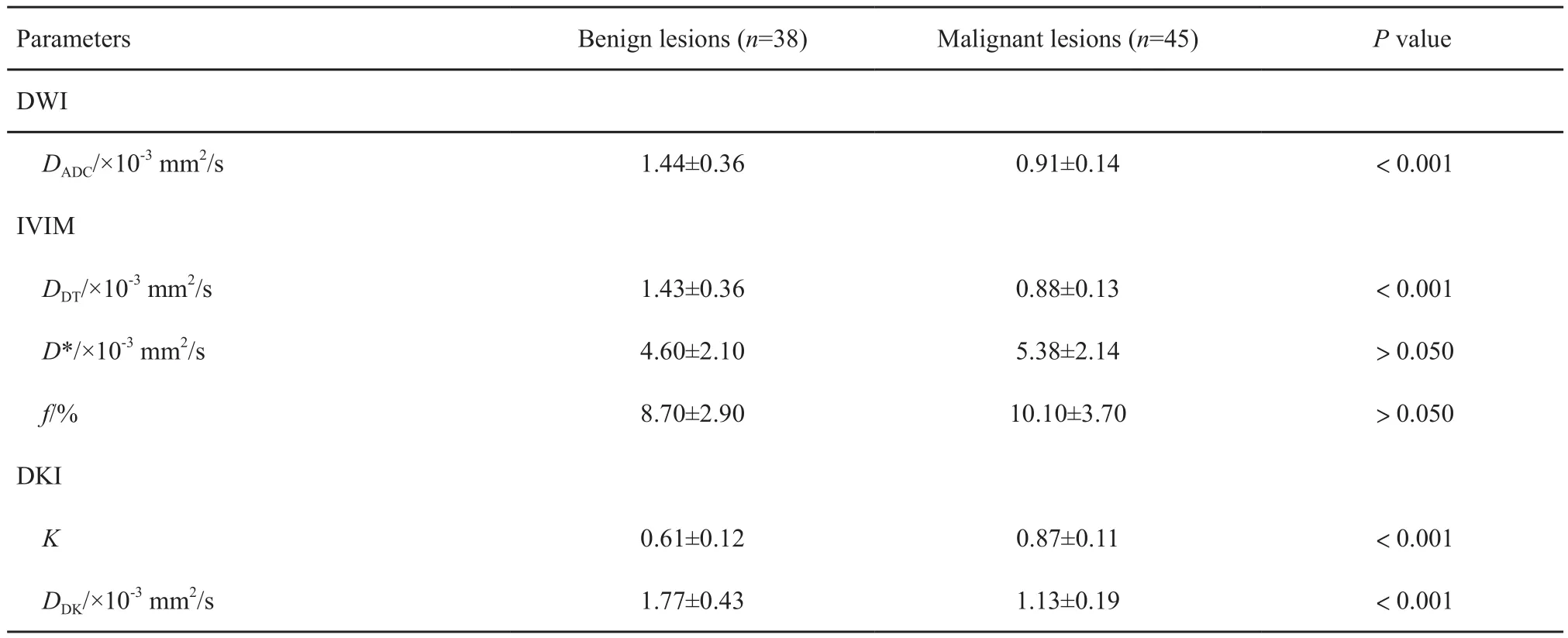
表1 乳腺良恶性病灶不同模型各参数特征Tab.1 Characteristics of different parameters of benign and malignant breast lesions(±s)
DADC: Apparent diffusion coefficient; DDT: Tissue diffusivity coefficient; D*: Perfusion-related diffusivity coefficient; f: Perfusion fraction; K: Kurtosis coefficient; DDK: Diffusivity coefficient
Parameters Benign lesions (n=38) Malignant lesions (n=45) P value DWI DADC/×10-3 mm2/s 1.44±0.36 0.91±0.14 <0.001 IVIM DDT/×10-3 mm2/s 1.43±0.36 0.88±0.13 <0.001 D*/×10-3 mm2/s 4.60±2.10 5.38±2.14 >0.050 f/% 8.70±2.90 10.10±3.70 >0.050 DKI K 0.61±0.12 0.87±0.11 <0.001 DDK/×10-3 mm2/s 1.77±0.43 1.13±0.19 <0.001
2.4 3种模型参数的ROC曲线图及诊断效能的比较
以病理结果为金标准,计算3种不同DWI模型的参数诊断乳腺癌的临界值、灵敏度、特异度及AUC。DKI模型中的参数K值与IVIM模型中的参数DDT值的ROC曲线的AUC最高,略高于DADC值和DDK值的AUC(表2,图1)。当DDT临界值取≤1.06×10-3mm2/s时,其诊断灵敏度和特异度分别为93.3%和84.2%。当K值临界值取>0.756时,其诊断灵敏度和特异度分别为91.1%和89.5%。对上述4个参数的ROC曲线的AUC进行Z检验,发现DADC、DDT、K和DDK值之间的差异均无统计学意义(P均>0.05)。
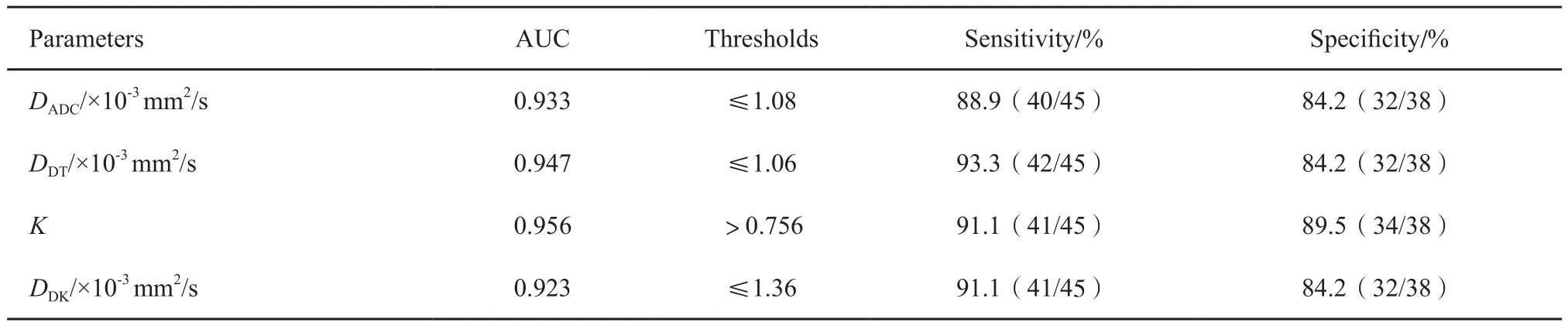
表2 3种不同模型参数的诊断效能的比较Tab.2 Comparison of diagnostic efficiency of three different model parameters
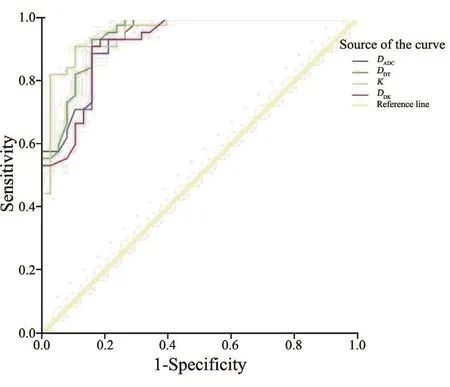
图1 DADC值、DDT值、K值及DDK值的ROC曲线图Fig.1 The ROC curves of DADC, DDT, K and DDK values
3 讨 论
单指数模型是临床应用最广泛的DWI模型,其扫描要求低,时间短,后处理简单,在乳腺良恶性病灶的鉴别诊断中具有较高的诊断价值[8,13-14]。一项Meta分析显示[13],与动态增强MR相比,DADC值半定量分析可以提高乳腺良恶性病灶鉴别诊断的特异度。理论上仅需2个b值就足够对曲线进行拟合[15],1.5 T MR乳腺扫描中高b值一般选择800~1 000 s/mm2,可获得较好的图像质量和较高的诊断价值[14]。本研究选择了50和1 000 s/mm2两个b值,结果显示,良恶性病灶的DADC值分别为(1.44±0.36)×10-3和(0.91±0.14)×10-3mm2/s,差异有统计学意义(P<0.001)。若以DADC值≤1.08×10-3mm2/s作为鉴别乳腺良恶性病灶的临界值,其灵敏度为88.9%,特异度为84.2%,与Marini等[16]的研究结果相符。与IVIM模型和DKI模型相比,虽然DADC的诊断灵敏度较DDT值、K值和DDK值稍低,但这3种不同模型之间的差异均无统计学意义。
在20世纪80年代末,Le Bihan等[9]提出的IVIM模型,通常采用高(>200 s/mm2)、低(≤200 s/mm2)2组b值,使用最小二乘法求得组织灌注信息和扩散运动信息。理论上至少应用4个不同加权的b值(包括b=0 s/mm2),才可获得D、D*和f参数值,且b值需在0~200 s/mm2之间时,才可通过算法拟合出灌注相关信息,在乳腺的IVIM研究中,通常b值选择0~800 s/mm2[17-19]。因此本研究选用了8个b值(0~1 000 s/mm2,包括0 s/mm2),足够得到以上3个参数。在b值较低的情况下(b≤200 s/mm2),DADC值受灌注的影响显著,不能反映真实水分子扩散的程度[9]。而DDT值由于去除了组织灌注的影响,可以更为准确地反映水分子真实扩散信息。本研究结果显示,体素内不相干运动模型中的3个参数中,只有DDT值能够较好地将乳腺良恶性病灶区分开来。在本研究中,恶性病灶的DDT值明显低于良性病灶,与国内外的研究结果相符[20-21]。良恶性病灶DDT值分别为(1.43±0.36)×10-3和(0.88±0.13)×1 0-3m m2/ s,差异有统计学意义(P<0.001),若以DDT值≤1.06×10-3mm2/s作为鉴别乳腺良恶性病灶的临界值,其灵敏度为93.3%,特异度为84.2%,与DADC值相比,虽然两者参数临界值相仿,特异度相同,但DDT值的诊断灵敏度更高(93.3% vs 88.9%)。可能由于DDT值剔除了组织灌注的影响,能够更加真实地反映组织内水分子扩散情况。Liu等[20]也对IVIM模型在乳腺良恶性病灶的鉴别诊断中进行了相关的研究,其研究结果显示,DDT值较DADC值的AUC略高,分别为0.952和0.945;良恶性病灶DDT值分别为1.35×10-3和0.85×10-3mm2/s,如果以DDT≤1.06×10-3mm2/s作为鉴别良恶性病灶的临界值,灵敏度为90%,特异度为92.68%。f值代表的是快速扩散所占的容积分数,但在本研究中,f值的组间一致性一般,在乳腺良恶性病灶中的差异也无统计学意义,与Liu等[20]的研究结果不一致,该研究发现f值在恶性病灶中明显升高,在鉴别良恶性病灶中差异也有统计学意义,可能是恶性肿瘤的微循环灌注血容量增加导致的,其诊断灵敏度和特异度分别为87.5%和53.66%。笔者认为f值可能在不同机器之间的重复性较差,导致此次研究IVIM灌注信息拟合不好。此外,既往在前列腺癌的研究中也发现,f值在前列腺癌和良性前列腺增生之间的差异无统计学意义[22]。D*值是快速扩散系数,主要受到微循环灌注中毛细血管长度和血流速度的影响,大部分研究结果均显示,乳腺良恶性病灶的D*值差异无统计学意义[20-21],与本研究结果一致。IVIM的DDT值可除外组织灌注的影响,与单指数模型相比,可略微提高乳腺疾病诊断的灵敏度。
单指数模型假定生物组织内水分子扩散呈高斯分布,不同b值下的水分子扩散呈线性衰减,但当b值超过1 000 s/mm2时,水分子扩散信号的衰减开始偏离线性,此时用常规模型模拟水分子的信号衰减存在较大误差。DKI模型则是用来探测非高斯分布水分子的扩散特性,可以量化偏离高斯模型的偏差值。理论上DKI模型至少需要3个b值才能拟合,临床研究中乳腺癌的DKI扫描方法也是多种多样的[23-25],但目前尚无推荐的扫描方案。有研究认为,DKI模型的最大b值至少需要>2 000 s/mm2,但不能超过3 000 s/mm2[26]。因此,在本研究中,b值选择0、1 000、1 500、2 000和2 500 s/mm2。由于b值越高会导致图像信噪比明显下降,图像变形越来越严重,故本次研究使用RS-EPI,相比于SS-EPI,可明显减少图像几何变形及磁敏感伪影,进一步精确地划定ROI的范围[27],但是扫描时间相对更长,相当于单指数模型的2~3倍。
本研究结果显示,K值和DDK值在鉴别乳腺良恶性病灶中均有较高的诊断价值。其中K值的诊断效能最高,恶性病灶在DDK图上呈明显低信号,而在K图上呈明显高信号,这与Nogueira等[25]的观察结果一致。K值是DKI中最具代表性的参数,是一个无量纲参数,主要反映细胞结构复杂的程度,ROI内组织结构复杂程度越高,则K值也越高,表明非高斯分布扩散受限越显著。以往研究表明,DKI能提高对恶性病灶的灵敏度和特异度,可定量分析水分子扩散受限情况和组织复杂度[11,24,26,28]。从病理学角度上讲,恶性肿瘤破坏正常腺体结构,细胞密度增大,核浆比增大,细胞间隙缩小,正常腺体内部腺泡、导管及间质结构出现紊乱,细胞呈不均匀生长,导致结构相对复杂[29]。DDK值代表水分子扩散相关系数,是修正的DADC值,反映水分子的扩散程度,其诊断效能与DADC值相似,但DDK值比DADC值大,这可能归因于2种不同模型的不同本质。本研究中K值和DDK值的诊断能力与Sun等[24]的研究相比略低,差异可能主要与良恶性病灶的不同病理分布及所选病灶大小有关,在其研究中,恶性病灶主要以浸润性乳腺癌为主,占所有恶性病灶的91.2%(52/57),并且病灶体积偏大,最小的ROI面积为98 mm2,而在本研究中,单纯浸润性乳腺癌所占比例较少,仅为44.4%(20/45),最小ROI约40 mm2。综上所述,DKI的各参数在乳腺良恶性病灶的鉴别诊断中均有较高的诊断灵敏度和特异度,但扫描时间相对较长。
本研究存在一定的局限性:① 本次研究的样本量相对较少,需要在今后的研究工作中进一步增加病例数;② IVIM的数据偏移较大,得到的结论与其他类似研究有一定差距;③ 为了达到较好的图像质量,DKI扫描方案中采用了较多高b值,并增加了激励次数,导致扫描时间相对较长,下一步如果要应用到临床,还需要对b值进行优化。
[1] 汪登斌. 乳腺MRI应用现状和我国乳腺MRI应用中存在的问题[J]. 中华放射学杂志, 2014, 48(3): 177-179.
[2] KUHL C K, SCHRADING S, BIELING H B, et al. MRI for diagnosis of pure ductal carcinoma in situ: a prospective observational study[J]. Lancet, 2007, 370(9586): 485-492.
[3] KUHL C K, MIELCARECK P, KLASCHIK S, et al. Dynamic breast MR imaging: are signal intensity time course data useful for differential diagnosis of enhancing lesions?[J]. Radiology,1999, 211(1): 101-110.
[4] KUHL C. The current status of breast MR imaging. Part I.Choice of technique, image interpretation, diagnostic accuracy,and transfer to clinical practice[J]. Radiology, 2007, 244(2):356-378.
[5] 盛若凡, 杨 丽, 汪禾青, 等. 扩散峰度成像对肝纤维化分级的诊断价值[J]. 中华放射学杂志, 2017, 51(9): 709-713.
[6] ZHU L, PAN Z, MA Q, et al. Diffusion kurtosis imaging study of rectal adenocarcinoma associated with histopathologic prognostic factors: preliminary findings[J]. Radiology, 2017,284(1): 66-76.
[7] 谭朝元, 杨 晶, 严开心, 等. 扩散峰度成像对高级别胶质瘤及单发脑转移瘤的鉴别诊断价值[J]. 放射学实践, 2017,32(3): 218-222.
[8] WOODHAMS R, MATSUNAGA K, IWABUCHI K, et al.Diffusion-weighted imaging of malignant breast tumors: the usefulness of apparent diffusion coefficient (ADC) value and ADC map for the detection of malignant breast tumors and evaluation of cancer extension[J]. J Comput Assist Tomogr,2005, 29(5): 644-649.
[9] LE BIHAN D, BRETON E, LALLEMAND D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging[J]. Radiology, 1988, 168(2): 497-505.
[10] ICHIKAWA S, MOTOSUGI U, ICHIKAWA T, et al. Intravoxel incoherent motion imaging of focal hepatic lesions[J]. J Magn Reson Imaging, 2013, 37(6): 1371-1376.
[11] JENSEN J H, HELPERN J A, RAMANI A, et al. Diffusional kurtosis imaging: the quantification of non-gaussian water diffusion by means of magnetic resonance imaging[J]. Magn Reson Med, 2005, 53(6): 1432-1440.
[12] DELONG E R, DELONG D M, CLARKE-PEARSON D L.Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach[J].Biometrics, 1988, 44(3): 837-845.
[13] CHEN X, LI W L, ZHANG Y L, et al. Meta-analysis of quantitative diffusion-weighted MR imaging in the differential diagnosis of breast lesions[J]. BMC cancer, 2010, 10(1):693-703.
[14] 张 静, 安宁豫, 程流泉, 等. 1.5TMR乳腺扩散加权成像b值的优化[J]. 中华放射学杂志, 2011, 45(10): 937-941.
[15] PEREIRA F P, MARTINS G, FIGUEIREDO E, et al.Assessment of breast lesions with diffusion-weighted MRI:comparing the use of different b values[J]. AJR Am J Roentgenol, 2009, 193(4): 1030-1035.
[16] MARINI C, IACCONI C, GIANNELLI M, et al. Quantitative diffusion-weighted MR imaging in the differential diagnosis of breast lesion[J]. Eur Radiol, 2007, 17(10): 2646-2655.
[17] KOH D M, COLLINS D J, ORTON M R. Intravoxel incoherent motion in body diffusion-weighted MRI: reality and challenges[J]. AJR Am J Roentgenol, 2011, 196(6): 1351-1361.
[18] LEBIHAN D. IVIM method measures diffusion and perfusion[J]. Diagn Imaging, 1990, 12(6): 133-136.
[19] SIGMUND E E, CHO G Y, KIM S, et al. Intravoxel incoherent motion imaging of tumor microenvironment in locally advanced breast cancer[J]. Magn Reson Med, 2011, 65(5): 1437-1447.
[20] LIU C, LIANG C, LIU Z, et al. Intravoxel incoherent motion(IVIM) in evaluation of breast lesions: comparison with conventional DWI[J]. Eur J Radiol, 2013, 82(12): 782-789.
[21] 王庆军, 李小娟, 张 静, 等. 磁共振体素内不相干运动对于肿块样乳腺良恶性病变的诊断价值[J]. 中华临床医师杂志, 2014, 8(19): 21-25.
[22] 闵祥德, 王 良, 冯朝燕, 等. MR扩散加权成像不同模型诊断前列腺癌的价值[J]. 中华放射学杂志, 2015, 49(11):838-842.
[23] WU D, LI G, ZHANG J, et al. Characterization of breast tumors using diffusion kurtosis imaging (DKI)[J]. PloS One, 2014,9(11): e113240.
[24] SUN K, CHEN X, CHAI W, et al. Breast cancer: diffusion kurtosis MR imaging-diagnostic accuracy and correlation with clinical-pathologic factors[J]. Radiology, 2015, 277(1): 46-55.
[25] NOGUEIRA L, BRANDAO S, MATOS E, et al. Application of the diffusion kurtosis model for the study of breast lesions[J].Eur Radiol, 2014, 24(6): 1197-1203.
[26] JENSEN J H, HELPERN J A. MRI quantification of non-Gaussian water diffusion by kurtosis analysis[J]. NMR Biomed, 2010, 23(7): 698-710.
[27] BOGNER W, PINKER-DOMENIG K, BICKEL H, et al.Readout-segmented echo-planar imaging improves the diagnostic performance of diffusion-weighted MR breast examinations at 3.0 T[J]. Radiology, 2012, 263(1): 64-76.
[28] 高 欣, 周丽娟, 徐孝秋, 等. 扩散峰度成像对乳腺良、恶性病变的鉴别诊断价值[J]. 中华放射学杂志, 2017, 51(8):583-587.
[29] ELSTON C W, ELLIS I O. Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer:experience from a large study with long-term follow-up[J].Histopathology, 1991, 19(5): 403-410.
