自噬相关基因5在肝癌组织中的表达及临床意义
2018-06-12彭雪强张小东马英博魏士博华向东刘金钢李航宇
彭雪强,杨 良,张小东,马英博,杨 朔,李 岩,魏士博,范 庆,华向东,刘金钢,李航宇
1.中国医科大学附属第四医院普外科,辽宁 沈阳 110032;
2.中国医科大学肿瘤医院肝胆外科,辽宁 沈阳 110042
肝细胞癌(hepatocellular carcinoma,HCC)是常见的消化道恶性肿瘤,最新癌症统计显示,HCC已成为世界各地癌症患者死亡的主要原因之一[1]。我国2012年共发生78 200例新HCC病例和745 500例死亡病例,约占全球新发患者和死亡人数的50%[1]。当前HCC的治疗主要分为手术和非手术治疗,但是由于其恶性程度高、术后易复发等原因,HCC的治疗仍然是一个巨大挑战[2],因此进一步探讨其发生、发展的分子机制,将有助于HCC患者的早期诊断与靶向治疗。自噬是真核生物广泛进行的维持自身稳态的机制,又称为Ⅱ型程序性细胞死亡[3]。一方面,自噬可以将真核生物细胞内异常的蛋白质和损伤的细胞器运输到溶酶体进行消化降解,从而抑制癌症发生[4]。另一方面,自噬可以提供肿瘤细胞在低氧、营养不足时的能量供应,有利于肿瘤恶性进程[5]。总之自噬与肿瘤的发生、发展有直接的关系[4-6]。
当前研究表明,酵母中存在超过30种自噬相关基因(autophagy-related gene,Atg),在哺乳动物中也已鉴定出16个Atg[7]。自噬相关基因5(autophagy-related gene 5,Atg5)是自噬小体形成中泛素样连接系统Atgl2-Atg5-Atgl6的关键因子,已被证明是自噬体形成所必需的[8-9]。但是,目前关于HCC中Atg5的表达情况尚不明确。因此本研究通过免疫组织化学染色检测Atg5蛋白在HCC和癌旁组织中的表达,并结合其表达水平,分析与患者临床病理特征之间的关系。同时采用蛋白质印迹法(Western blot)与实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)分别检测HCC及癌旁组织中Atg5蛋白和mRNA的表达。探究在HCC发生、发展中Atg5表达的改变与意义,为HCC的治疗寻找新的靶点。
1 材料和方法
1.1 标本收集和研究对象
采用中国医科大学肿瘤医院2015年3月—2017年6月进行HCC手术切除的110例HCC标本。所有组织经两名病理学医师评估确诊为HCC并复查无误。患者术前未进行化疗和放疗,且具有完整的临床、病理和随访资料。其中男性89例,女性21例;年龄34~83岁,中位年龄55岁,小于50岁48例,大于等于50岁62例;HBsAg阴性25例,HBsAg阳性85例;肿瘤直径小于5 cm 69例,大于等于5 cm 41例;未发现肝硬化24例,肝硬化86例;低分化67例,中、高分化43例;甲胎蛋白(alpha fetoprotein,AFP)水平小于200 ng/mL 42例,大于等于200 ng/mL 68例;未发现有血管侵犯66例,合并血管侵犯44例。对照组取样距离癌组织大于2 cm。另外46例是在手术时立即取材的新鲜HCC及癌旁组织标本,置液氮中保存。其中男性34例,女性12例;年龄37~80岁,中位年龄57岁,小于50岁16例,大于等于50岁30例;HBsAg阴性11例,HBsAg阳性35例;肿瘤直径小于5 cm 28例,大于等于5 cm 18例;未发现肝硬化14例,肝硬化32例;低分化16例,中、高分化30例;AFP水平小于200 ng/mL 19例,大于等于200 ng/mL 27例;未发现有血管侵犯31例,合并血管侵犯15例。标本检测均在患者和其家属同意,并签署知情同意书的情况下进行。
1.2 主要试剂
免疫组织化学试剂盒和二氨基联苯胺(diaminobenzidine,DAB)试剂盒购自福州迈新生物技术开发有限公司,兔抗人Atg5多克隆抗体购自美国AbSci公司,鼠抗人多克隆β-actin抗体购自美国ABclonal公司,辣根过氧化物酶标记的羊抗兔IgG和辣根过氧化物酶标记的羊抗鼠IgG购自北京鼎国昌盛生物技术有限责任公司,RTFQ-PCR试剂盒购自美国Promega公司,PCR引物由北京鼎国昌盛生物技术有限责任公司合成。
1.3 免疫组织化学检测
采用免疫组织化学染色法半定量分析110例HCC及癌旁组织中Atg5蛋白的表达。其具体操作步骤根据说明书指导完成,同时用试剂盒提供的阳性切片作为对照,以PBS替代一抗作为阴性对照。免疫组织化学检测结果判断标准:细胞质内出现黄色颗粒染色判定为阳性,每张切片在高倍镜下取3个不同视野,并各计数100个细胞。染色阳性细胞比例计分:阳性细胞比例≤10%,计0分;10%<阳性细胞比例≤25%,计1分;25%<阳性细胞比例≤50%,计2分;阳性细胞比例>50%,计3分。细胞染色强度强弱:无明显染色计0分,染色浅黄色计1分,染色棕黄色计2分,染色棕褐色计3分。染色阳性细胞比例计分与染色强度强弱相乘即为免疫组织化学染色强度计分,0~1分为(-),2~3分为(+),3~4分为(++),>4分为(+++)。结果,计分≥2为阳性,计分≤1为阴性[10]。
1.4 Western blot检测
采用Western blot检测46例HCC及癌旁组织中Atg5蛋白的表达,其具体操作步骤根据说明书指导完成。通过Image J软件分析图像,Atg5的表达经β-actin内参标准化后求得其相对表达水平。
1.5 RTFQ-PCR检测
采用RTFQ-PCR检测46例新鲜HCC及癌旁组织中Atg5 mRNA的相对表达水平。取1 mm3组织剪碎研磨后,加入1 mL TRIzol溶液裂解后经氯仿等提取细胞总R NA,测定RNA的纯度和浓度,其比值为1.8~2.0,mRNA的纯度较高。DNA的合成按反转录试剂盒说明进行。PCR Atg5引物序列:上游引物序列为5’-GCAACTCTGGATGGGATTGC-3’,下游引物序列为5’-TTGCAGCAGCGAAGTGTTTC-3’;G A P D H引物序列:上游引物序列为5’-CTCTGCTCCTCCTGTTCGAC-3’,下游引物序列为5’-GCGCCCAATACGACCAAATC-3’。根据SYBR Green说明书配制RTFQ-PCR的反应体系。RTFQ-PCR的循环条件:95 ℃变性3 min;95 ℃变性5 s,60 ℃ 25 s退火,共40个循环。由绘制的标准曲线可以得到Atg5 mRNA表达的相对浓度,并以Atg5与GAPDH基因相对浓度的比值去反映其相对的表达量。每例设3个复孔,结果取均值。
1.6 统计学处理
应用SPSS 17.0软件进行统计学处理。计量资料用±s表示,数据统计分析采用配对t检验;计数资料的统计分析用χ2检验。所有数据行单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 免疫组织化学检测结果
2.1.1 HCC和癌旁组织中Atg5的表达
免疫组织化学染色结果表明,Atg5主要定位于细胞质内,染色呈现棕黄色。其在HCC组织中的表达,(-)31例,(+)26例,(++)30例,(+++)23例,总表达阳性率为71.82%(79/110);其在癌旁组织中的表达,(-)87例,(+)21例,(++)2例,(+++)0例,总表达阳性率为20.09%(23/110),详见图1。

图1 HCC和癌旁组织中Atg5蛋白免疫组织化学染色结果Fig.1 The immunohistochemical staining results of Atg5 protein in HCC and adjacent tissues
2.1.2 HCC组织中Atg5蛋白表达与患者临床病理学特征的关系
HCC组织中Atg5蛋白的表达与患者性别、年龄、HBsAg阳性、肝硬化及肿瘤分化程度均无关(P<0.05),而与肿瘤直径、AFP水平及血管侵犯相关(P<0.05),肿瘤直径大于等于5 cm、AFP水平大于等于200 ng/mL及合并血管侵犯肝癌患者的Atg5蛋白的表达阳性率较高(表1)。
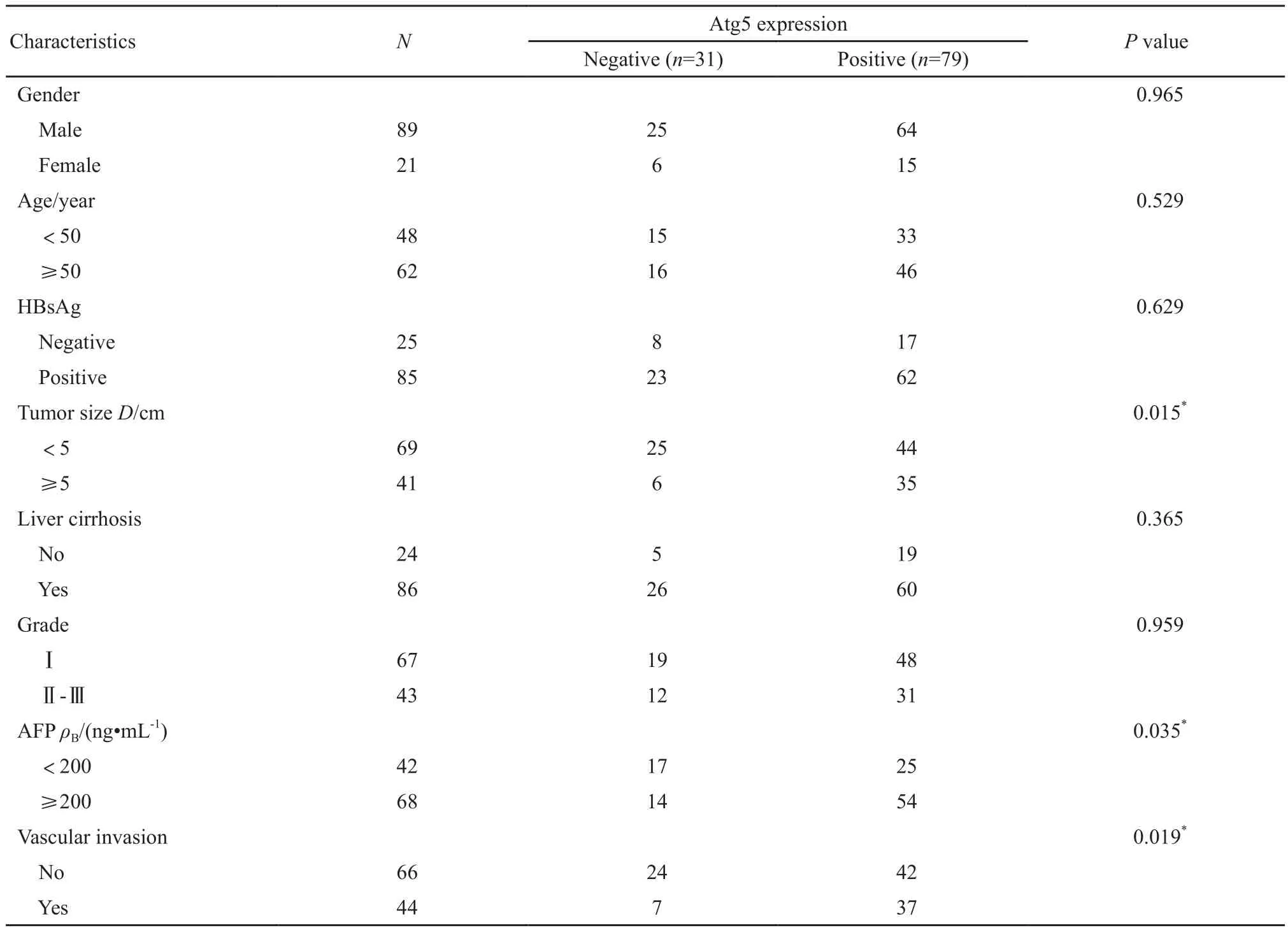
表1 HCC组织中Atg5蛋白表达与患者临床病理学特征的关系Tab.1 Expression of Atg5 protein in HCC tissue and its relationship with clinicopathological features
2.2 Western blot检测结果
Atg5蛋白表达水平,Western blot结果显示,46例HCC组织中Atg5蛋白的表达水平为1.25±0.25,癌旁组织为0.47±0.12。Atg5蛋白在HCC组织中的表达高于癌旁组织(P<0.05,图2)。
2.3 RTFQ-PCR结果
RTFQ-PCR结果表明,Atg5 mRNA在46例HCC组织中的相对表达水平为10.87±0.513,在癌旁组织中的相对表达水平为2.498±0.175。Atg5 mRNA在HCC组织中的表达是癌旁组织的4.37倍(P<0.05,图3)。
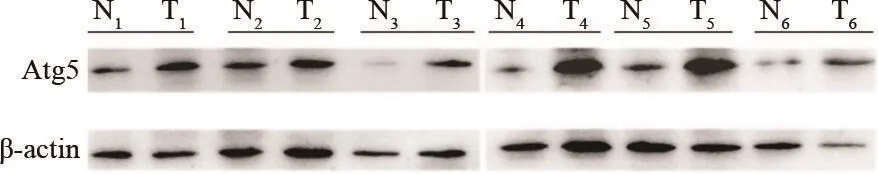
图 2 Western blot检测Atg5蛋白在HCC和癌旁组织中的表达Fig. 2 The expression of Atg5 protein in HCC and adjacent tissues detected by Western blot
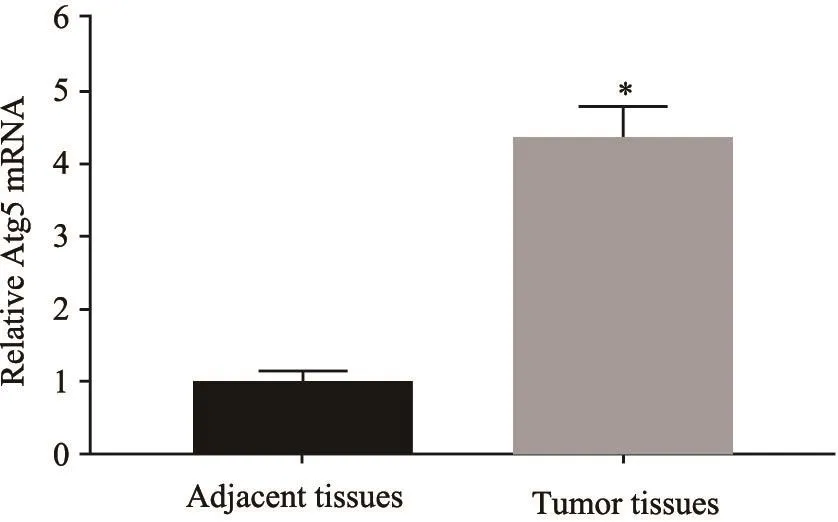
图3 RTFQ-PCR Atg5 mRNA在HCC和癌旁组织中的表达Fig.3 The expression of Atg5 mRNA in HCC and adjacent tissues detected by RTFQ-PCR
3 讨 论
自噬过程的发生离不开自噬小体的形成[11]。有研究证实,在自噬小体形成中Atg起主要的调控作用[12]。其在分子机制上主要主导二类泛素结合系统,分别是Atgl2-Atg5-Atgl6共轭系统和Atg8/LC3共轭系统,此外,Atg12-Atg5-Atg16共轭系统可能在自噬体生成期间驱动膜小叶的扩张和形成[11]。有研究发现,Atg12-Atg5-Atg16共轭系统主要位于吞噬泡的外侧,在自噬体形成之后会自发释放到细胞质中[13]。其中Atg5基因映射到染色体位点6q21,Atg5在Atgl2-Atg5-Atgl6复合物中起关键作用,并且许多蛋白质与Atg5直接相互作用,常在自噬体成熟中起关键角色[13-14],因而成为自噬的关键调节因子。
同时,当前研究表明,Atg5基因的突变与肿瘤恶性进展密切相关[7,14-16]。目前已有研究报道胃癌和前列腺癌中Atg5表达上调,且促进肿瘤的发生、发展[9,17-18],并且在关于胃癌的研究中证实,3,3’-二吲哚基甲烷可能通过miR-30e-ATG5调节自噬抑制胃癌细胞的增殖[19]。但是在上皮性卵巢癌[20]、结直肠癌[7]中Atg5的表达下调并促进了肿瘤的发生、发展,在早期皮肤黑色素瘤中Atg5对HCC的增殖具有明显抑制作用[21]。此外研究显示,Atg5的敲除会诱发实验小鼠肝脏肿瘤的发生[15],在大鼠早期HCC中敲除Atg5同样有促癌作用[22],同时也有研究证实,在沉默NIH3T3细胞系Atg5基因后会导致细胞恶性转变,并促进其侵袭能力[16]。miR-181a可以通过靶向下调HepG2细胞Atg5抑制自噬的活性,进而促进肿瘤生长[23]。但也有研究证实,在褪黑素处理HepG2细胞诱导细胞凋亡实验中,Atg5的敲除阻断自噬,会显著促进褪黑素诱导HepG2细胞的凋亡[24]。总之,目前的研究表明,Atg5在不同的肿瘤中表达趋势并不相同,可能由于自噬的发生是涉及多种自噬相关基因的复杂过程。而且在肝癌细胞中Atg5下调后,自噬受到抑制的情况下,肿瘤的发生、发展可出现抑制或促进的不同结果[23-24]。自噬对HCC发生、发展的影响目前仍存在争议,这可能是由于自噬在HCC的发生、发展中的双重调控作用,即在肿瘤发生早期起到肿瘤抑制因子的作用,但当肝细胞发生恶变后,自噬的发生将有利于HCC细胞在各种应激条件下存活,从而促进肿瘤发生、发展[25]。综上所述,目前关于HCC中Atg5的表达及其对于HCC的发生、发展的确切意义仍不明确。
本研究通过免疫组织化学染色检测HCC及癌旁组织中Atg5蛋白的表达,证实肝癌组织中Atg5蛋白定位在细胞质中,HCC组织中Atg5蛋白上调。其次通过Atg5的表达与临床病理参数分析可知,Atg5的表达与肿瘤直径、AFP水平及血管侵犯相关(P<0.05)。且肿瘤直径大于等于5 cm、AFP水平大于等于200 ng/mL及合并血管侵犯者Atg5蛋白的表达阳性率高。同时采用Western blot与RTFQ-PCR分别验证癌旁及HCC组织中Atg5蛋白和mRNA的表达,结果证实,相比于癌旁组织,HCC组织中Atg5基因在转录与翻译两个水平上都出现上调(P<0.05)。
综上所述,HCC的发生、发展与Atg5蛋白的表达上调密切相关,Atg5可能成为HCC治疗的潜在靶点,但其具体机制有待进一步研究证实。
[1] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012 [J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[2] YEGIN E G, OYMACI E, KARATAY E, et al. Progress in surgical and nonsurgical approaches for hepatocellular carcinoma treatment [J]. Hepatobiliary Pancreat Dis Int,2016, 15(3): 234-256.
[3] PARZYCH K R, KLIONSKY D J. An overview of autophagy:morphology, mechanism, and regulation [J]. Antioxid Redox Signal, 2014, 20(3): 460-473.
[4] WHITE E. The role for autophagy in cancer [J]. J Clin Invest, 2015, 125(1): 42-46.
[5] WHITE E, MEHNERT J M, CHAN C S. Autophagy, metabolism,and cancer [J]. Clin Cancer Res, 2015, 21(22): 5037-5046.
[6] GALBRAITH I I, DUGGAN G. Envelope-function matching conditions for GaAs/(Al,Ga)As heterojunctions [J]. Phys Rev B Condens Matter, 1988, 38(14): 10057-10059.
[7] CHO D H, JO Y K, KIM S C, et al. Down-regulated expression of ATG5 in colorectal cancer[J]. Anticancer Res, 2012,32(9): 4091-4096.
[8] WALCZAK M, MARTENS S. Dissecting the role of the Atg12-Atg5-Atg16 complex during autophagosome formation [J].Autophagy, 2013, 9(3): 424-425.
[9] LI X, LI C, ZHU L H. Correlation of autophagy-associated gene Atg5 with tumorigenesis of prostate cancer [J]. Zhonghua Nan Ke Xue, 2015, 21(1): 31-34.
[10] 邢传平, 刘 斌, 董 亮. 免疫组织化学标记结果的判断方法 [J]. 中华病理学杂志, 2001, 30(4): 318-318.
[11] YANG Z, KLIONSKY D J. An overview of the molecular mechanism of autophagy [J]. Curr Top Microbiol Immunol,2009, 335: 1-32.
[12] SUZUKI K, AKIOKA M, KONDO-KAKUTA C, et al. Fine mapping of autophagy-related proteins during autophagosome formation in Saccharomyces cerevisiae [J]. J Cell Sci, 2013,126(Pt 11): 2534-2544.
[13] ROGOV V, DOTSCH V, JOHANSEN T, et al. Interactions between autophagy receptors and ubiquitin-like proteins form the molecular basis for selective autophagy[J]. Mol Cell,2014, 53(2): 167-178.
[14] KIM J H, HONG S B, LEE J K, et al. Insights into autophagosome maturation revealed by the structures of ATG5 with its interacting partners [J]. Autophagy, 2015, 11(1): 75-87.
[15] LIU H, HE Z, SIMON H U. Protective role of autophagy and autophagy-related protein 5 in early tumorigenesis [J]. J Mol Med (Berl), 2015, 93(2): 159-164.
[16] HWANG S H, HAN B I, LEE M. Knockout of ATG5 leads to malignant cell transformation and resistance to Src family kinase inhibitor PP2 [J]. J Cell Physiol, 2018, 233(1): 506-515.
[17] 李 新, 李 佽, 朱璐宏, 等. 自噬相关基因Atg5与前列腺腺癌发生的相关性分析 [J]. 中华男科学杂志, 2015, 21(1):31-34.
[18] CAO Q H, LIU F, YANG Z L, et al. Prognostic value of autophagy related proteins ULK1, Beclin 1, ATG3, ATG5,ATG7, ATG9, ATG10, ATG12, LC3B and p62/SQSTM1 in gastric cancer [J]. Am J Transl Res, 2016, 8(9): 3831-3847.
[19] YE Y, FANG Y, XU W, et al. 3,3’-Diindolylmethane induces anti-human gastric cancer cells by the miR-30e-ATG5 modulating autophagy [J]. Biochem Pharmacol, 2016, 115:77-84.
[20] 邓琦程, 王福萍, 高爱华, 等. Beclin1和Atg5在上皮性卵巢癌组织中的表达及临床意义 [J]. 基础医学与临床, 2013,33(12): 1595-1599.
[21] LIU H, HE Z, VON RUTTE T, et al. Down-regulation of autophagy-related protein 5 (ATG5) contributes to the pathogenesis of early-stage cutaneous melanoma [J]. Sci Transl Med, 2013, 5(202): 202ra123.
[22] SUN K, XU L, JING Y, et al. Autophagy-deficient Kupffer cells promote tumorigenesis by enhancing mtROS-NF-kappaBIL1alpha/beta-dependent inflammation and fibrosis during the preneoplastic stage of hepatocarcinogenesis [J]. Cancer Lett,2017, 388: 198-207.
[23] ANG J, HE Y, ZHAI N, et al. MicroRNA-181a inhibits autophagy by targeting Atg5 in hepatocellular carcinoma [J].Front Biosci (Landmark Ed), 2018, 23: 388-396.
[24] RDONEZ R, FERNANDEZ A, PRIETO-DOMINGUEZ N, et al. Ceramide metabolism regulates autophagy and apoptotic cell death induced by melatonin in liver cancer cells [J]. J Pineal Res, 2015, 59(2): 178-189.
[25] IU L, LIAO J Z, HE X X, et al. The role of autophagy in hepatocellular carcinoma: friend or foe [J]. Oncotarget, 2017,8(34): 57707-57722.
