磁共振扩散峰度成像预测鼻咽癌放疗近期疗效研究
2018-06-12林少民黄小鹏黄薇园
吴 刚,王 奋,林少民,张 帅,黄小鹏,黄薇园
1.海南省人民医院放疗科,海南 海口 570311;
2.海南省人民医院放射科,海南 海口 570311
鼻咽癌起源于鼻咽腔黏膜的鳞状上皮,由于病灶发生位置较深且起病隐匿,早期临床症状多不明显且容易被忽略,因此大部分首次就诊的鼻咽癌患者已是中晚期。鼻咽癌的病理类型主要为未分化型非角化性癌,肿瘤恶性程度高,倍增时间短,易发生远处转移。鼻咽癌预后除了跟肿瘤分期、治疗方案相关外,还主要取决于肿瘤的生物学特性,其中放疗敏感性是决定预后的重要因素。多数鼻咽癌患者放疗敏感性相对较高,以放疗为主的综合治疗后,很多患者可以达到完全缓解(complete remission,CR),预后相对较好。然而部分鼻咽癌患者,病理类型虽然相同,但是对放疗反应灵敏度较低,放疗后表现为部分缓解(partial remission,PR)或疾病稳定(stable disease,SD),甚至疾病进展(progressive disease,PD)。对于未达到CR的患者,根据放射生物学原理,肿瘤细胞虽然未完全死亡,但是放疗基本上已使肿瘤细胞失去增殖能力,故临床上处理是观察至少3个月,等待肿瘤细胞凋亡。若仍未达到CR,则再选择进一步局部治疗,如后装放疗或手术治疗。数月带瘤生存可能会增加远处转移率及肿瘤负荷,因此可能会使未控患者错失最佳治疗时机,甚至导致治疗失败。如何在治疗中,早期发现放射治疗敏感性低的患者,早期干预,是临床工作中的重点和难点。放疗近期疗效在一定程度上可以反映肿瘤放射敏感性。所以,预测近期疗效有利于及时有效地调整治疗方案,改善患者预后。
磁共振(magnetic resonance imaging,MRI)扩散峰度成像(diffusion kurtosis imaging,DKI)是非侵入性新型功能成像技术,是扩散张量成像(diffusion tensor imaging,DTI)技术的延伸和发展,通过探测水分子在组织中的扩散运动来反映肿瘤组织的超微结构特性,并通过多种参数测量间接反映微血管循环、细胞膜完整性及细胞密度,并可以在形态学改变之前发现肿瘤组织细微变化。本研究运用MRI-DKI技术的相关参数前瞻性分析该技术在预测鼻咽癌放疗近期疗效中的作用。
1 资料和方法
1.1 入组标准
① 年龄大于18岁;② 有明确的病理诊断;③ KPS评分>80;④ 治疗前全身评估无远处转移;⑤ MRI检查前未接受任何抗肿瘤治疗。
1.2 排除标准
① MRI检查禁忌证;② 过去5年诊断出恶性肿瘤;③ 未完成放疗计划;④ 远处转移;⑤ 头颈部接受过放疗。
1.3 患者资料
2014年11月—2017年8月共有60例在海南省人民医院就诊的鼻咽癌患者入组。2例患者因拒绝放疗出组,1例患者因个人原因要求出组。最终有57例患者纳入研究。患者的一般资料及疾病分期见表1。TNM分期参照美国癌症联合会(American Joint Committee on Cancer,AJCC)第7版分期标准[1]。放疗前分期检查包括:鼻咽部和颈部的磁共振扫描,胸部CT扫描,腹部彩超及全身骨显像检查。
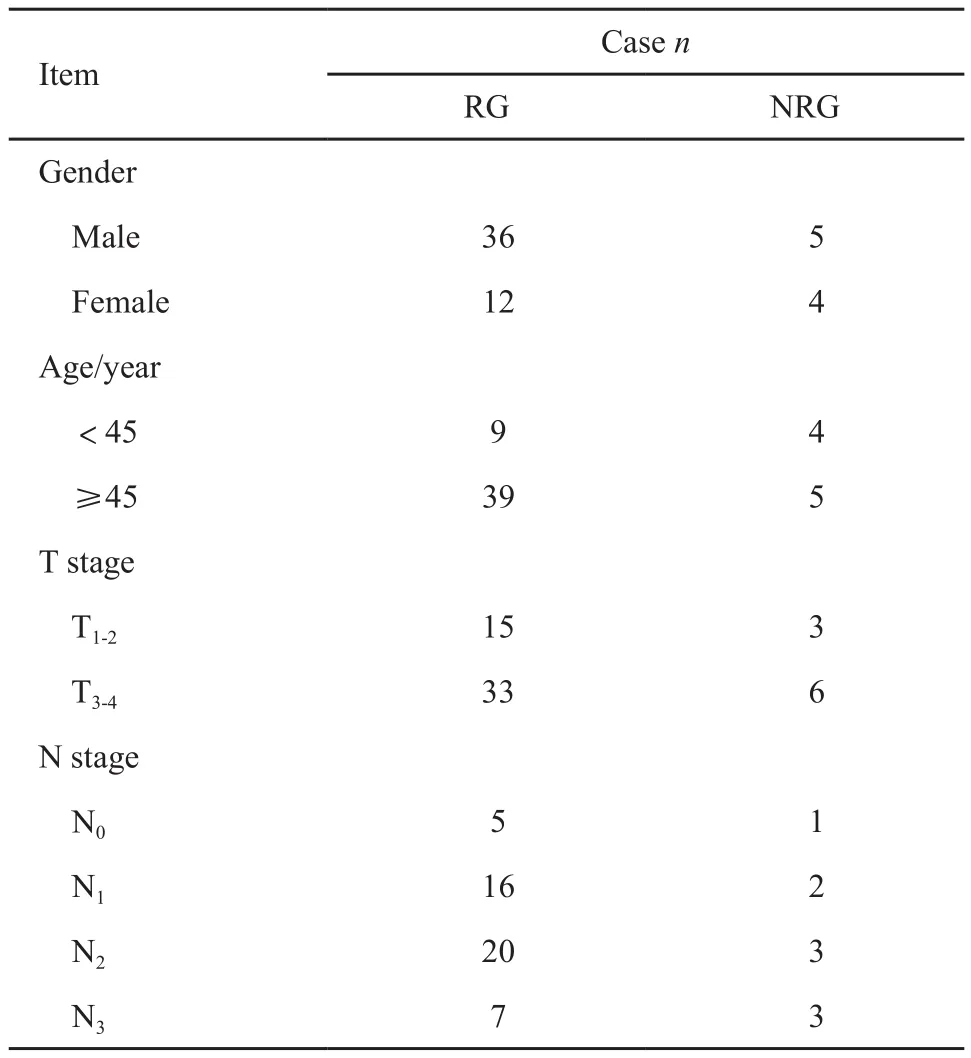
表1 患者基本信息Tab.1 Patient characteristics
1.4 方法
1.4.1 治疗与评估
所有患者均接受适形调强放射治疗(intensitymodulated radiation therapy,IMRT),鼻咽病灶放疗总剂量68.2~72.6 Gy/31~33次/43~54 d。放疗结束3个月后在海南省人民医院复查鼻咽MRI。根据RECIST 1.1标准评估疗效,CR:鼻咽部无局部肿块及黏膜增厚。难以通过影像学界定的患者,可借助鼻咽活检以确认是否有肿瘤残留。根据肿瘤消退情况将患者分为治疗反应组(response group,RG)及治疗抵抗组(no-response group,NRG)。
1.4.2 MRI扫描方法
扫描采用3.0 T MRI扫描仪(MAGNETOM Skyra,购自德国Siemens公司),线圈采用8通道头颈联合线圈,仰卧位。训练患者在扫描期间尽量避免运动、吞咽及说话。MRI扫描序列包括:横断位质子加权成像(proton density weighted imaging,PDWI)和DKI。PDWI采用短时反转恢复序列,DKI采用30个方向的脂肪抑制单链自旋回波序列。DKI参数包括部分各向异性(fractional anisotropy,FA)、平均扩散系数(mean diffusion coefficient,Dmean)、平均峰度系数(mean kurtosis coefficient,Kmean)、平均峰度张量(mean kurtosis tensor,Mkt)、峰度部分各向异性(kurtosis fractional anisotropy,KFA)、横向扩散系数(radius diffusion coefficient,Drad)、轴向扩散系数(axis diffusion coefficient,Dax)、横向峰度系数(radius kurtosis coefficient,Krad)及轴向峰度系数(axis kurtosis coefficient,Kax)。
1.4.3 DKI后处理及数据测量
DKI原始图像经后处理软件DKE version 2.6处理得到各参数伪彩图[2]。基于感兴趣区(region of interest,ROI)的参数测量使用MRIcro version 1.40软件。阅片分别由两名高年资放射科诊断医师单独完成,阅片者对病理结果和治疗后分组采取盲法。ROI选取在肿瘤最大截面上手动勾画,横断位PDWI图像作为解剖参考。从Kmean绘制的ROI拷贝到各个参数伪彩图,保证测量ROI的一致性。在横断位PDWI图像上测量肿瘤的最大径。所有参数值采用两位阅片者的平均值。
1.5 统计学处理
用SPSS 22.0 mac版统计软件对数据进行分析,阅片分别由两名放射科诊断医师单独完成,并计算组间同类相关系数。连续变量组间比较采用Mann-Whitney U检验。年龄(<45岁 vs ≥45岁)和T分期(T1-2vs T3-4)组间采用χ2检验。各个DKI参数预测鼻咽癌放疗反应采用受试者工作特征(receiver operating characteristic,ROC)曲线分析并计算曲线下面积(area under curve,AUC)、灵敏度和特异度。通过计算Youden指数(Youden指数=灵敏度+特异度-1)得到临界值。二分类Logistic回归分析各参数是否是鼻咽癌放疗反应的独立预测因素。P<0.05为差异有统计学意义。
2 结 果
2.1 肿瘤最大径及各个DKI参数在RG与NRG间的比较
放疗结束后3个月复查MRI,RG共有48例(84.2%)患者,无可见病灶,按RECIST 1.1版本评估为CR组。NRG共有9例(15.8%)患者,主要包括PR、SD及PD。DKI参数的组间同类相关系数为0.78。
治疗前测量肿瘤最大径,N R G比R G大,但差异无统计学意义(P=0.057)。年龄(χ2=9.281,P=0.002)及T分期在两组间差异有统计学意义(χ2=3.947,P=0.047)。在9个DKI参数中,治疗前RG的Dax、Dmean和Drad明显大于NRG(P=0.020、0.030和0.030)。治疗前RG的FA、Kax、KFA、Kmean、Krad和Mkt明显低于NRG(P=0.030、0.020、0.010、0.000、0.000和0.000,表2)。
表2 DKI扫描结果Tab.2 DKI Parameters(±s)
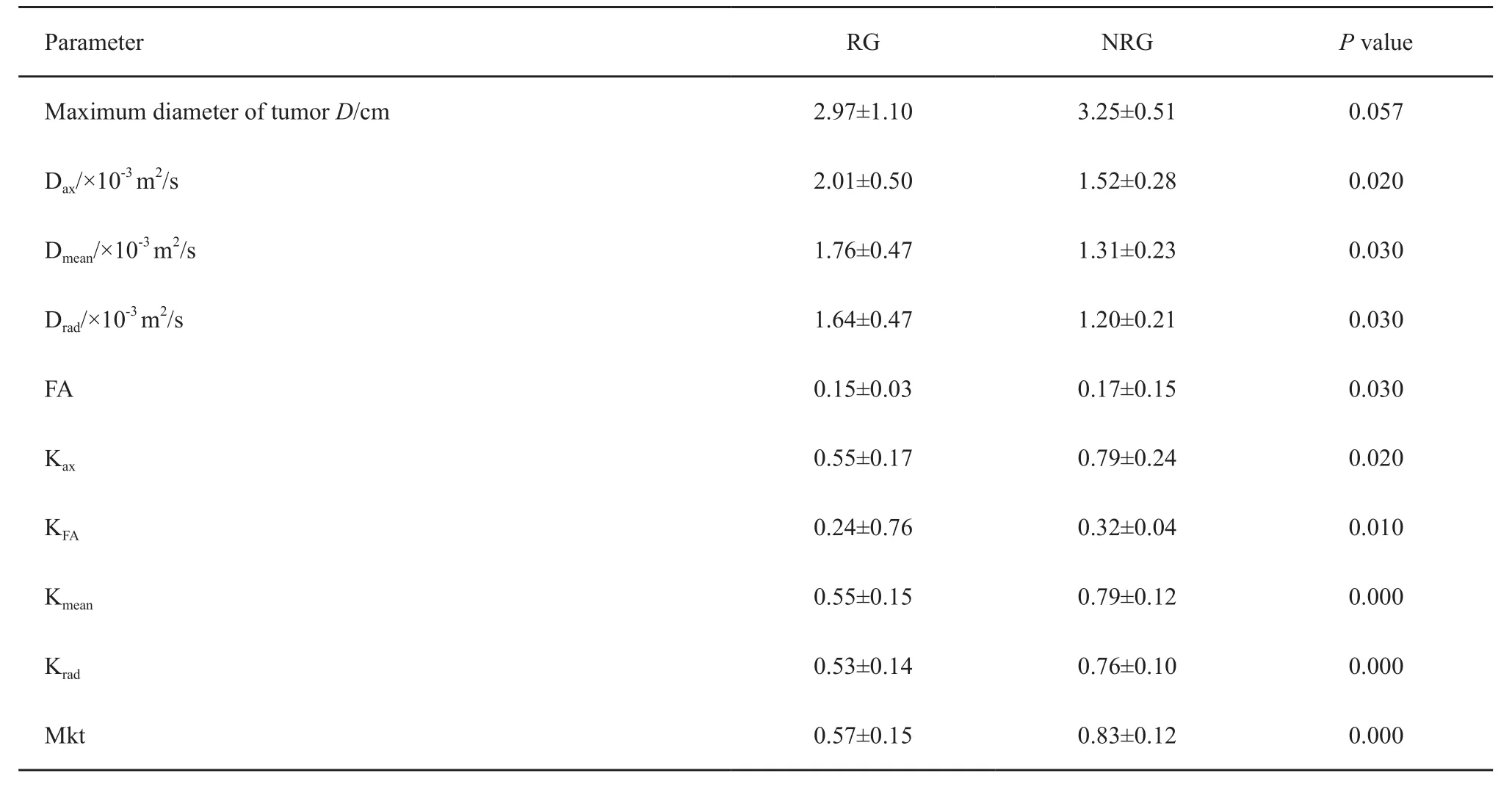
表2 DKI扫描结果Tab.2 DKI Parameters(±s)
Parameter RG NRG P value Maximum diameter of tumor D/cm 2.97±1.10 3.25±0.51 0.057 Dax/×10-3 m2/s 2.01±0.50 1.52±0.28 0.020 Dmean/×10-3 m2/s 1.76±0.47 1.31±0.23 0.030 Drad/×10-3 m2/s 1.64±0.47 1.20±0.21 0.030 FA 0.15±0.03 0.17±0.15 0.030 Kax 0.55±0.17 0.79±0.24 0.020 KFA 0.24±0.76 0.32±0.04 0.010 Kmean 0.55±0.15 0.79±0.12 0.000 Krad 0.53±0.14 0.76±0.10 0.000 Mkt 0.57±0.15 0.83±0.12 0.000
2.2 选取差异有统计学意义的参数做ROC曲线
选取KFA、Kmean、Krad和Mkt做ROC曲线分析,各参数预测鼻咽癌放疗反应的情况见表3。Krad在预测放疗反应方面较其他参数更好(图1)。
2.3 二分类Logistic回归分析的结果
二分类Logistic回归分析,以肿瘤残留与否为因变量,结果显示,除性别外,年龄、T分期和DKI的各个参数均是鼻咽癌放疗反应的独立预测因素。T分期晚会增加肿瘤残留的风险,KFA、Kmean、Krad和Mkt降低会减少肿瘤残留的风险。
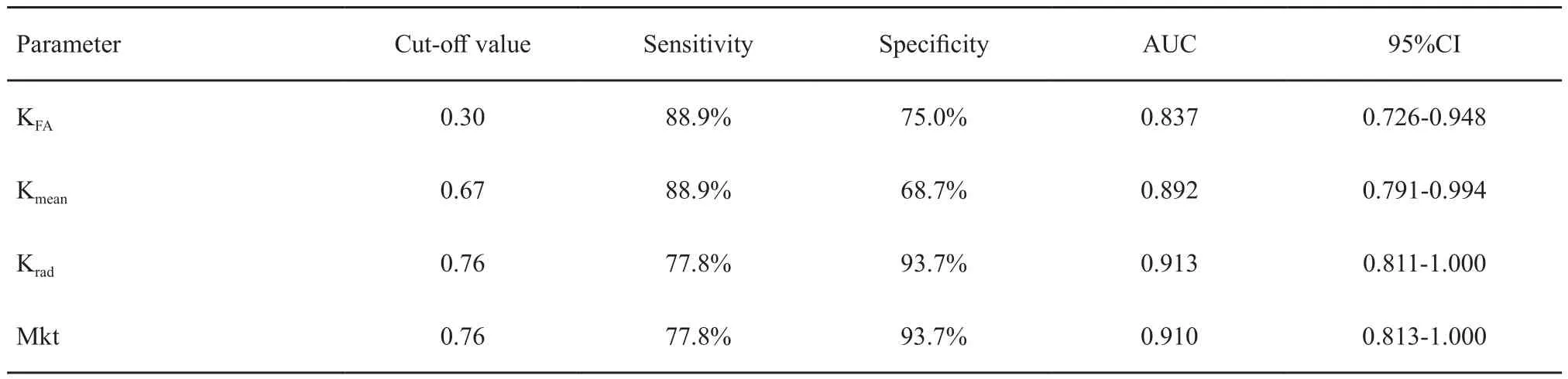
表3 峰度参数预测放疗敏感性的比较Tab.3 Comparison of kurtosis parameters to predict radiotherapy response
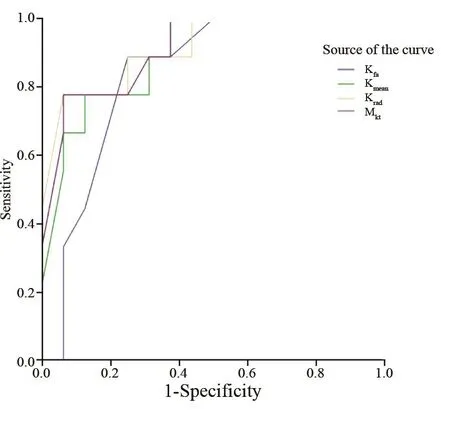
图1 ROC曲线Fig.1 ROC Curve
3 讨 论
MRI功能成像越来越多地应用于临床实践当中。扩散加权成像(diffusion-weighted imaging,DWI)首先假设体内的水分子符合高斯(即正态)分布[3]。弥散受限时DWI信号增强,表观扩散系数(apparent diffusion coefficient,ADC)信号减弱。
用治疗前ADC值是否可以预测鼻咽癌放疗敏感性存在一定争议[4-5]。多项研究发现,放疗前鼻咽癌病灶的ADC值与治疗效果之间存在明显的相关性[5-6],然而另外一些研究得到了阴性的结果[7]。Zhang等[6]的研究表明,治疗前的ADC值是肿瘤局控率和无病生存期的独立预测因素。治疗前ADC值预测局部治疗失败的灵敏度为65.2%,特异度为69.5%,比本研究报道的相关数据低。此外,Chen等[7]将Ⅲ~Ⅳ期鼻咽癌按新辅助化疗疗效分组,治疗前的ADC值在两组间差异无统计学意义。
然而,在人体内,由于细胞间隔的存在,水分子的弥散运动比高斯分布要复杂得多[8]。此外,MRI功能成像在颅底区肿瘤的临床工作中并未得到广泛应用,受到诸多限制:头颈部解剖结构复杂,受副鼻窦气体、骨等交界面影响,局部磁场极不均匀,易产生磁敏感伪影,吞咽、呼吸及大血管搏动等自主生理活动也常会导致显著的运动伪影[9]。DTI技术是在DWI基础上发展起来的成像技术,可以在三维空间内分析组织内水分子的弥散特性,通过各向同性Dmean和FA来反映[10]。近年来研究发现,非高斯运动模型DTI和DKI参数可以更好地预测头颈部肿瘤局部疗效[11]。但是尚未见利用DKI参数预测鼻咽癌患者放疗近期疗效的研究报道。
为分析生物组织中复杂的非高斯扩散运动行为并获得组织的特性信息,研究者设计了不同的扩散模型来分析[12-13]。DKI技术是DTI技术的延伸,用于探查水分子的非高斯扩散特性,可以提供比DWI(高斯扩散模型)更准确的生理学信息。DKI模型可以同时获得组织的特性和扩散数据,可以提供更多的微观结构信息。DKI比单指数和双指数模型具有更好的可靠性和可重复性[12]。然而,DKI参数与局控率之间的关系十分复杂[11,14]。我们通过多个b值详细分析非线性拟合模型后推测,DKI值有反映组织复杂微观结构的潜力(如肿瘤细胞密度、肿瘤组织的基质体积和复杂的膜结构)。因此,DKI参数可以在微观结构水平反应肿瘤组织的改变,从而使早期预测治疗效果成为可能。Yuan等[15]使用了和本研究相同的b值(0、500、1 000和1 500 s/mm2)进行研究,结果显示,非高斯扩散模型包括DKI与单指数模型相比,区分鼻咽癌病灶与周围组织能力更强。本研究发现,RG的鼻咽癌患者Dmean、Drad和Dax值较高,FA、Kax、Kmean和Krad值较低,说明DKI扫描具有预测鼻咽癌放疗近期疗效的价值。
二分类Logistic回归分析表明,年龄、T分期和DKI参数是鼻咽癌近期疗效的独立预测因素。χ2检验显示,年龄和T分期间差异有统计学意义。年龄小、T分期晚的患者,肿瘤恶性程度较高,此外T分期晚的患者,治疗剂量较高,放疗范围较大,所以治疗耐受性差,这与很多实体肿瘤类似。在DKI的诸多参数预测放疗反应方面,峰度参数比扩散参数更好,这些结果与既往研究相似[2,16]。峰度参数反映了组织的扩散峰度,代表了微观组织结构的复杂性[17]。因此,峰度参数可能会对病理变化更敏感。虽然鼻咽癌中肉眼可见的坏死或囊性变十分少见,但不同的患者,具有不同程度的肿瘤微坏死灶和组织异质性[18]。这种组织异质性多由乏氧引起,放疗敏感性差。因此,峰度参数预测放疗反应比扩散参数更好。
到目前为止,还没有用峰度参数来预测治疗效果的研究。Quentin等[2]的研究发现,Kmean和Kax可以鉴别前列腺癌和炎性反应,Krad却不可以。但是在本研究中,所有峰度参数值在RG和NRG间差异均有统计学意义,并且Krad是最敏感的鉴别放疗反应的参数。分析原因如下:在轴位(即横断位)上,鼻咽黏膜向前为鼻咽腔,向后为头长肌及颅底斜坡,有筋膜、骨膜及骨皮质等阻隔,浸润过程较复杂。鼻咽黏膜在人体解剖学形态上接近纵向分布,而鼻咽癌的肿瘤细胞趋向于沿黏膜浸润播散。而Krad反映的是纵向峰度参数,因此更能反应肿瘤的播散行为。当鼻咽癌的肿瘤细胞向周围组织播散时,T分期晚的异质性更明显。FA和KFA在RG和NRG间差异显著,因此,FA和KFA可能在一定程度上可以反映肿瘤组织的异质性。Li等[19]的研究表明,FA和ADC值可以发现早期鼻咽癌患者三叉神经受侵情况。Mkt和KFA无需弥散张量信息即可反应峰度张量的各向异性[20-21]。这些参数为脑深部结构提供了更多的生物学信息,特别是在复杂的组织结构中评估扩散信息有特殊优势[22]。在本研究中,Mkt和KFA在两组间差异有统计学意义。在以后的研究中,需进一步探讨这些参数在头颈部肿瘤诊断及治疗中的意义。
本研究发现,NRG的扩散参数比RG低,与既往一些头颈部肿瘤ADC的研究结果相反[23],但是也有1篇ADC的研究[24]及1篇关于鼻腔鼻窦鳞状细胞癌的DKI研究[11]与本研究结果相似。分析原因如下:① 扩散参数会受峰度参数影响,且呈负相关;② 由于坏死及乏氧的原因,扩散系数可能比ADC值更能反映异质性[25],但是本研究设计并未加入乏氧的监测;③ 扩散系数可能与T分期有关。T分期越高,扩散系数值越低。T分期晚和扩散系数值低,均表现为放疗敏感性差[24]。我们会在下一步的研究中,结合病理学检查进行探讨。
本研究有两个方面的不足:① 放疗效果依据治疗结束3个月以后的复查来界定。因此,DKI参数与长期放疗疗效如生存期、复发及转移的关系,未能纳入研究。我们选择3个月这个时间点来判断局控率参照了Hong等[26]的研究。本研究项目还在进行中,无病生存期、总生存期、局控率、复发率及转移率等相关数据均在进一步的随访当中。② 本研究样本量有限,且为单中心研究。因此,亟待多中心临床试验及大样本病例总结来进一步验证本研究的结果。
[1] ZONG J, LIN S, LIN J, et al. Impact of intensity-modulated radiotherapy on nasopharyngeal carcinoma: validation of the 7thedition AJCC staging system[J]. Oral Oncol, 2015, 51(3):254-259.
[2] QUENTIN M, PENTANG G, SCHIMMÖLLER L, et al.Feasibility of diffusional kurtosis tensor imaging in prostate MRI for the assessment of prostate cancer: preliminary results[J].Magn Reson Imaging, 2014, 32(7): 880-885.
[3] KING A D, CHOW K K, YU K H, et al. Head and neck squamous cell carcinoma: diagnostic performance of diffusionweighted MR imaging for the prediction of treatment response[J]. Radiology, 2013, 266(2): 531-538.
[4] WONG K H, PANEK R, BHIDE S A, et al. The emerging potential of magnetic resonance imaging in personalizing radiotherapy for head and neck cancer: an oncologist’s perspective[J]. Br J Radiol, 2017, 90(1071): 20160768.
[5] LOMBARDI M, CASCONE T, GUENZI E, et al. Predictive value of pre-treatment apparent diffusion coefficient (ADC)in radio-chemiotherapy treated head and neck squamous cell carcinoma[J]. Radiol Med, 2017, 122(5): 345-352.
[6] ZHANG Y, LIU X, ZHANG Y, et al. Prognostic value of the primary lesion apparent diffusion coefficient (ADC) in nasopharyngeal carcinoma: a retrospective study of 541 cases[J]. Sci Rep, 2015, 5(1): 12242.
[7] CHEN Y, LIU X, ZHENG D, et al. Diffusion-weighted magnetic resonance imaging for early response assessment of chemoradiotherapy in patients with nasopharyngeal carcinoma[J]. Magn Reson Imaging, 2014, 32(6): 630-637.
[8] ROSENKRANTZ A B, SIGMUND E E, WINNICK A, et al. Assessment of hepatocellular carcinoma using apparent diffusion coefficient and diffusion kurtosis indices: preliminary experience in fresh liver explants[J]. Magn Reson Imaging,2012, 30(10): 1534-1540.
[9] LEE S K, KIM J, KIM H D, et al. Initial experiences with proton MR spectroscopy in treatment monitoring of mitochondrial encephalopathy[J]. Yonsei Med J, 2010, 51(5): 672-675.
[10] 刘 侃, 欧阳汉, 周纯武, 等. 3.0 T磁共振扩散加权成像在鼻咽癌中的初步应用[J]. 中国医学科学院学报, 2010, 32(2):200-204.
[11] FUJIMA N, YOSHIDA D, SAKASHITA T, et al. Prediction of the treatment outcome using intravoxel incoherent motion and diffusional kurtosis imaging in nasal or sinonasal squamous cell carcinoma patients[J]. Eur Radiol, 2017, 27(3): 956-965.
[12] JANSEN J F, STAMBUK H E, KOUTCHER J A, et al. Nongaussian analysis of diffusion-weighted MR imaging in head and neck squamous cell carcinoma: a feasibility study[J]. AJNR Am J Neuroradiol, 2010, 31(4): 741-748.
[13] SAKAMOTO J, IMAIZUMI A, SASAKI Y, et al. Comparison of accuracy of intravoxel incoherent motion and apparent diffusion coefficient techniques for predicting malignancy of head and neck tumors using half-Fourier single-shot turbo spin-echo diffusion-weighted imaging[J]. Magn Reson Imaging, 2014,32(7): 860-866.
[14] SUN K, CHEN X, CHAI W, et al. Breast cancer: diffusion kurtosis MR imaging-diagnostic accuracy and correlation with clinical-pathologic factors[J]. Radiology, 2015, 277(1): 46-55.
[15] YUAN J, YEUNG D K, MOK G S, et al. Non-gaussian analysis of diffusion weighted imaging in head and neck at 3T: a pilot study in patients with nasopharyngeal carcinoma[J]. PLoS One, 2014, 9(1): e87024.
[16] SUO S, CHEN X, WU L, et al. Non-Gaussian water diffusion kurtosis imaging of prostate cancer[J]. Magn Reson Imaging,2014, 32(5): 421-427.
[17] JENSEN J H, HELPERN J A, RAMANI A, et al. Diffusional kurtosis imaging: the quantification of non- gaussian water diffusion by means of magnetic resonance imaging[J]. Magn Reson Med, 2005, 53(6): 1432-1440.
[18] ZHANG W, ZHANG Y, KE S, et al. Multi-modality imaging to determine the cellular heterogeneity of nasopharyngeal carcinoma components[J]. Oncotarget, 2014, 5(8): 2221-2229.
[19] LI T, SHENG L, CHUNYAN C, et al. The significance of diffusion tensor magnetic resonance imaging for patients with nasopharyngeal carcinoma and trigeminal nerve invasion[J].Medicine (Baltimore), 2017, 96(6): e6072.
[20] HANSEN B, SHEMESH N, JESPERSEN S N. Fast imaging of mean, axial and radial diffusion kurtosis[J]. Neuroimage,2016, 142: 381-393.
[21] GLENN G R, HELPERN J A, TABESH A, et al. Quantitative assessment of diffusional kurtosis anisotropy[J]. NMR Biomed, 2015, 28(4): 448-459.
[22] VAN CAUTER S, VERAART J, SIJBERS J, et al . Gliomas:diffusion kurtosis MR imaging in grading[J]. Radiology,2012, 263(2): 492-501.
[23] ZHANG G Y, WANG Y J, LIU J P, et al. Pretreatment diffusion-weighted MRI can predict the response to neoadjuvant chemotherapy in patients with nasopharyngeal carcinoma[J].Biomed Res Int, 2015, 2015(3): 307943.
[24] 李 伟, 汤日杰, 卢斌贵, 等. 鼻咽癌MR表观扩散系数预测近期放疗敏感性的相关分析[J]. 中国CT和MRI杂志,2016, 14(9): 5-8.
[25] JANSEN J F, SCHÖDER H, LEE N Y, et al. Noninvasive assessment of tumor microenvironment using dynamic contrast enhanced MRI and18F-fluoromisonidazole PET imaging in neck nodal metastases[J]. Int J Radiat Oncol Biol Phys, 2010,77(5): 1403-1410.
[26] HONG J, YAO Y, ZHANG Y, et al. Value of magnetic resonance diffusion-weighted imaging for the prediction of radiosensitivity in nasopharyngeal carcinoma[J]. Otolaryngol Head Neck Surg, 2013, 149(5): 707-713.
