无溶剂体系中毕赤酵母表面展示CALB全细胞催化合成肉桂醇酯
2018-06-11徐晓敏黄奎韩双艳
徐晓敏,黄奎,韩双艳
(华南理工大学生物科学与工程学院,广东省发酵与酶工程重点实验室,广东广州 510006)
肉桂醇具有类似风信子的令人愉快的香气,其脂肪酸酯也是非常重要的芳香类化合物,广泛应用于食品,日化以及医药行业[1]。目前,市面上的肉桂醇酯绝大部分是由化学方法合成[2~4]。化学方法在生产香精香料的过程中,常伴随着多种副产物的生成,大大影响了产物的品质,并且具有反应环境苛刻,对设备要求高,产物分离困难等缺点[5~7]。
国际立法规定,“天然”风味物质只能通过物理过程(从天然产物提取)、酶促或微生物处理来制备[8]。酶法合成香料以其反应条件温和,产物纯度高,立体选择性好以及环境友好等特点,越来越受到人们的关注。为酶促合成香料反应找到适宜的生物催化剂,使该方法能大规模使用[9~13]具有广泛的经济效益。
用于催化反应的脂肪酶主要有游离和固定化两种形式[14~18],在实际应用的过程中,游离酶存在分离困难,难以回收重复利用等问题,目前应用于肉桂醇酯合成的酶制剂主要为商业化的固定化脂肪酶,Novozyme435[19,20]。但其成本较高,因此发展廉价易得的新酶源显得迫在眉睫。
南极假丝酵母脂肪酶 B(Candida antarcticalipaseB,CALB)是用途最为广泛的脂肪酶之一,具有很高的催化活性,以表面展示南极假丝酵母脂肪酶B的毕赤酵母为全细胞催化剂(Pp-CALB),不但具有固定化酶的优点,而且生产工艺简单[21,22],能够有效降低生产成本。Han等[23]利用Flo1p絮凝素将米黑根毛霉脂肪酶(Rhizomucor mieheilipase,RML)展示在毕赤酵母表面,Huang等[24]用其催化大豆油的醇解反应制备生物柴油,72 h甲酯产率达到83%。Su等[25]利用凝集素将CALB展示在毕赤酵母表面,发现其水解活力要比酿酒酵母展示的CALB高10倍,接近商品酶Novozyme 435,在有机相合成丙酸乙酯和乙酸乙酯,反应9 h底物摩尔转化率达到95%以上。由于毕赤酵母能进行高密度发酵,与酿酒酵母相比,毕赤酵母展示CALB能够有效降低全细胞催化剂的生产成本。目前尚未有用毕赤酵母表面展示CALB全细胞催化剂催化合成肉桂醇酯的相关报道。本研究基于毕赤酵母表面展示技术,用表面展示CALB毕赤酵母全细胞为催化剂在无溶剂体系中催化合成肉桂醇酯,初步探讨了Pp-CALB合成乙酸肉桂酯的最适反应条件及操作稳定性。
1 材料与方法
1.1 实验材料
1.1.1 菌株
毕赤酵母重组菌株 GS115-pPIC9K-CALB-GCW(12+51+61),为本实验室构建及保存[26,27]。其结构示意图如图1所示。

图1 毕赤酵母表面展示脂肪酶CALB结构示意图Fig.1 Structure schematic illustration of Pp-CALB whole-cell biocatalyst
Pp-CALB,指利用毕赤酵母(Pichia pastoris)壁蛋白GCW21,GCW51和GCW61作为锚定蛋白,将南极假丝酵母脂肪酶 B (Candida antarcticalipase B,CALB)展示在毕赤酵母细胞表面的一种全细胞生物催化剂。
1.1.2 培养基
无氨基酸酵母氮源YNB(Yeast nitrogen base)、蛋白胨(PEP)均购自 Difco公司;酵母抽提物(YE)购自Oxford公司;YPD(Yeast extract peptone dextrose medium)、BMGY(Buffered glycerol-complex medium)、BMMY(Buffered methanol-complex medium)等培养基均按Invitrogen公司毕赤酵母表达操作手册配方配制。
1.1.3 试剂
肉桂醇、甲酸、乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸、乙酸酐、乙酸甲酯、乙酸乙酯、乙酸乙烯酯、乙酸异丙烯酯、乙酸丁酯均为分析纯,无水乙醇(HPLC级),以上有机溶剂经分子筛脱水处理。
1.2 实验方法
1.2.1 全细胞催化剂的制备
将毕赤酵母重组菌株 GS115-pPIC9K-CALBGCW(12+51+61)培养于YPD琼脂固体平板上,24 h后接种至YPD液体培养基中,30 ℃、250 r/min培养24 h,以1%的接种量转接到新鲜BMGY培养基中,30 ℃、250 r/min培养24 h,然后在4 ℃、8000 r/min离心10 min得到菌体,转入BMMY培养基中,30 ℃、250 r/min培养5 d,每隔24 h加入1%(V/V)甲醇诱导。然后收集发酵菌体,离心,用pH 8.0的Tris-Hcl缓冲液洗2次,最后用pH 8.0的Tris-Hcl缓冲液重悬,通过真空冷冻干燥得到催化剂干粉。
1.2.2 全细胞脂肪酶水解活力的测定
采用吸光度测定脂肪酶活力[28]。检测全细胞催化剂干粉的酶活:用50 mmol/L磷酸缓冲液(pH 7.5)配置浓度为2 mmol/L的pNPB作为酶反应底物,其中添加0.5%的Triton-X100。然后向0.5 mL的菌体重悬液中加入0.5 mL浓度为2 mmol/L的底物溶液,45 ℃下反应一定时间,测定OD405值。每个样品均测定3个平行样,用未携带 CALB基因的重组毕赤酵母菌体GS115-pPIC9K-GCW(12+51+61)作空白对照。一个酶活力单位为每分钟水解底物生成 1 μmol对硝基苯酚所需的酶量[29],测得冻干粉水解酶活为 4032 U/(g·dry cell)。
1.2.3 全细胞催化剂合成肉桂醇酯
10 mL具塞锥形瓶中加入 12 mmol脂肪酸与 6 mmol肉桂醇,加入适量4Å分子筛以去除反应生成的水,放入恒温摇床中预热30 min。加入一定量的全细胞催化剂,于恒温摇床中反应3 h。在不同的反应条件(摇床转速、温度、底物比例和酶加量等)下进行实验。反应结束后离心取反应液上清,-20 ℃保存待测。
1.2.4 反应过程气相色谱分析
采用Agilent7820A气相色谱仪进行反应底物和产物定量分析,取反应液10 μL,用无水乙醇稀释至测定范围,经有机微孔滤膜过滤后进行分析,色谱条件如下:载气为氮气;FID检测器,检测器温度300 ℃,色谱柱HP-5,分流比40:1,柱箱温度160 ℃,维持1 min,以30 ℃/min升温至270 ℃,维持5 min。
1.2.5 酯化率的测定
利用外标法计算肉桂醇含量,反应酯化率由底物肉桂醇的消耗量来衡量。酯化率计算公式:
酯化率=[1-(W2/W1)]×100%
式中,W1,W2分别为酯化反应前后体系中肉桂醇的含量(mmol)。
2 结果与讨论
2.1 酰基供体对Pp-CALB催化合成肉桂醇酯的影响
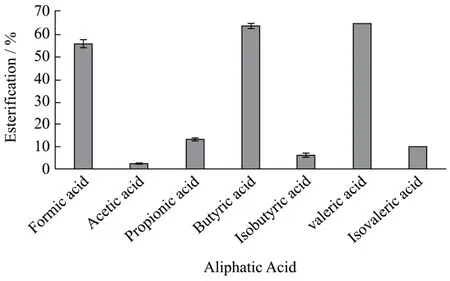
图2 不同脂肪酸对Pp-CALB催化肉桂醇酯化反应的影响Fig.2 Effect of different aliphatic acids on the esterification of cinnamic alcohol catalyzed by Pp-CALB
向10 mL反应瓶中加入6 mmol肉桂醇和12 mmol脂肪酸,以及0.05 gPp-CALB,在无溶剂体系中进行肉桂醇酯的合成反应,采用的脂肪酸分别为甲酸、乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸。考察Pp-CALB对脂肪酸的选择性,探讨建立无溶剂反应体系的可行性,在温度50 ℃,摇床转速200 r/min下反应3 h,结果如图2所示。
由图可看出,Pp-CALB对于含有支链的脂肪酸催化活性较低,这可能与CALB的催化结构域大小有关[17]。乙酸和丙酸在无溶剂体系中的酯化率均很低,甲酸、丁酸、戊酸在无溶剂体系中的酯化率分别可达55.42%,63.50%,64.22%,可能是乙酸,丙酸极性较大,易形成亲水性界面,夺取脂肪酶表面的必需水,破坏了蛋白质的三维结构,使部分酶失活[30]。
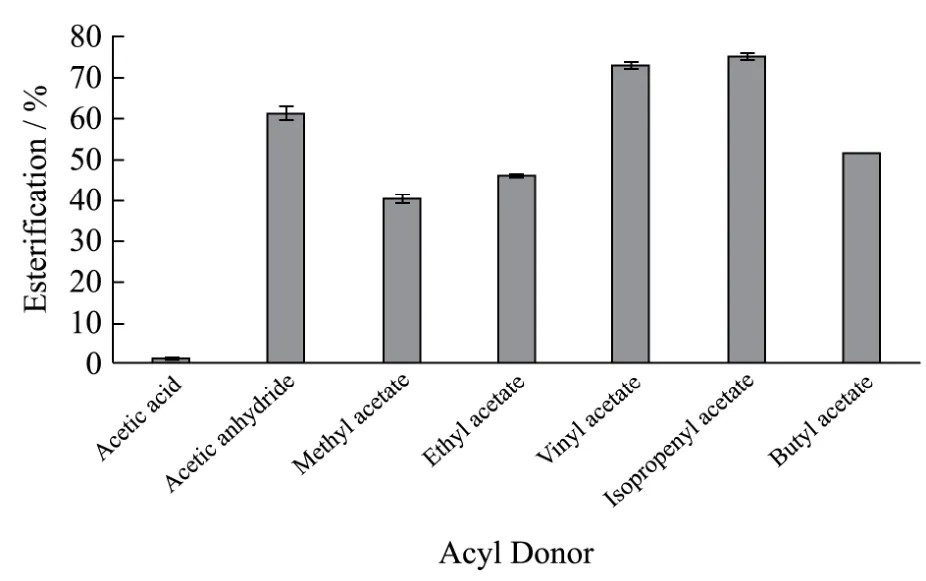
图3 不同酰基供体对Pp-CALB催化肉桂醇酯化反应的影响Fig.3 Effect of different acyl donors on the esterification of cinnamic alcohol catalyzed by Pp-CALB
乙酸肉桂酯是一种在工业生产中有较大需求的酯类香料,以乙酸肉桂酯合成为例,比较乙酸、乙酸酐、乙酸甲酯、乙酸乙酯、乙酸乙烯酯、乙酸异丙烯酯、乙酸丁酯几类常用酰基供体的作用效果,结果如图 3所示。由图可看出,以乙酸乙烯酯和乙酸异丙烯酯作为酰基供体时获得的酯化率较高,由于乙酸异丙烯酯成本较高,故以下研究中选择乙酸乙烯酯作为酰基供体。
2.2 摇床转速对Pp-CALB催化肉桂醇转酯反应的影响

图4 摇床转速对Pp-CALB催化肉桂醇酯化反应的影响Fig.4 Effect of agitation speed on the esterification of cinnamic alcohol catalyzed by Pp-CALB
摇床转速影响着酶催化反应的传质,传热以及底物同酶的接触几率。控制适合的转速既能保证良好的传质传热,又可节约能耗。在无溶剂体系中考察了摇床转速对反应的影响,结果如图4所示。由图可看出,随着摇床转速从40 r/min增加到120 r/min,酯化率逐渐提高,因为无溶剂体系粘度较高,具有一定的传质阻力,提高转速能够有效增加底物与酶接触的概率。当摇床转速再升高时,酯化率无明显提升。故 120 r/min的转速己经可以满足体系反应要求。
2.3 温度对Pp-CALB催化肉桂醇转酯反应的影响

图5 温度对Pp-CALB催化肉桂醇酯化反应的影响Fig.5 Effect of temperature on the esterification of cinnamic alcohol catalyzed by Pp-CALB
从热力学角度来说,温度的升高有利于提高转酯反应的速率,酶促反应温度的高低对脂肪酶的分子构象也有一定的影响,进而影响酶的催化活性。反应温度对全细胞催化剂 Pp-CALB催化合成乙酸肉桂酯的影响见图5,由图可看出,当温度为50 ℃时,该体系具有较高的酯化率,这是因为在较低的温度条件下,随着温度的升高,分子扩散加速,当温度达到50 ℃的时候,达到最高酯化率,继续升高反应温度酯化率下降,表明了 Pp-CALB在高温下有一定的失活,因为高温是蛋白质变性和失活的最常见的原因[31]。因此,50 ℃是Pp-CALB催化合成乙酸肉桂酯的最适温度。
2.4 底物摩尔比对Pp-CALB催化肉桂醇转酯反应的影响

图6 底物摩尔比对Pp-CALB催化肉桂醇酯化反应的影响Fig.6 Effect of molar ratio of substrate on the esterification of cinnamic alcohol catalyzed by Pp-CALB
反应底物摩尔比对酶促反应进程影响较大,当某一底物的浓度固定,反应受底物摩尔比的影响十分显著[25],实验考察了不同底物摩尔比对肉桂醇酯化率的影响,结果如图6所示。由图可知,随着底物摩尔比(乙酸乙烯酯:肉桂醇)的增加,酯化率也在增加,当底物摩尔比为2:1时,反应酯化率达到74.11%,继续增大底物摩尔比,酯化率逐渐降低,主要原因可能在于添加的乙酸乙烯酯过量,产生底物抑制效应,以使得 Pp-CALB催化性能降低。同时过多的底物加入进反应体系,不利于反应后期分离纯化,并且造成多余的浪费,故选择底物摩尔比2:1较合适。
2.5 全细胞催化剂添加量对肉桂醇转酯反应的影响

图7 不同Pp-CALB添加量对肉桂醇酯化反应的影响Fig.7 Effect of the amount of lipase on the esterification of cinnamic alcohol catalyzed by Pp-CALB
Pp-CALB的添加量对反应速率和经济成本有着很大的影响,由图7可知,随着酶量增加,肉桂醇的酯化率提高,当酶量由0.01 g增加到0.05 g时,酯化率稳定提升;但酶量由0.05 g增加到0.08 g时,酯化率提升不明显。原因可能是在底物浓度一定的条件下,当酶量超过0.05 g后,由于底物浓度的限制,尽管酶量增加但酯化率不会显著提高。此外在高酶浓度的催化体系中,催化剂很难维持均匀悬浮状态,存在传质阻力[32],而且,过量的酶加入反应体系,会大大增加反应成本,故在此反应中0.05 g是比较合适的添加量。
2.6 初始水活度对全细胞催化剂合成肉桂醇酯的影响
非水相酶促反应中, 脂肪酶需要一定量的结合水来维持其活性构象的稳定,只有达到最佳水含量的要求时,蛋白质结构的动力学刚性和热力学稳定性之间才能达到最佳平衡点[33]。本研究用饱和盐预平衡的方法控制全细胞催化剂 Pp-CALB的初始水活度。在室温下,将酶和底物在密闭容器中与饱和盐溶液平衡 3 d,得到具有一定初始水活度的Pp-CALB和底物,所用的饱和盐溶液包括:LiBr (aw=0.06),LiCl (aw=0.11),MgCl2(aw=0.33),Mg (NO3)2(aw=0.53),NaCl (aw=0.75),K2SO4(aw=0.97)[34]。

图8 不同水活度对Pp-CALB催化肉桂醇酯化反应的影响Fig.8 Effect of different initial water activities on the esterification of cinnamic alcohol catalyzed by Pp-CALB
由图8可知,使用Mg(NO3)2饱和溶液aw=0.53处理后的 Pp-CALB和底物,肉桂醇酯化率最高达81.34%。因此,Pp-CALB催化该反应的最适水活度为0.53。
2.7 有机溶剂及无溶剂体系中肉桂醇酯合成结果比较

图9 不同溶剂环境中的合成肉桂醇酯结果Fig.9 Effect of different reaction system on the esterification of cinnamic alcohol catalyzed by Pp-CALB
选择乙酸乙烯酯为酰基供体,分别在有机溶剂及无溶剂体系中进行乙酸肉桂酯的合成。底物摩尔比(乙酸乙烯酯:肉桂醇)为2,加入3 mL有机溶剂(正己烷、正庚烷、异辛烷),0.05 g全细胞催化剂,120 r/min,50 ℃反应3 h,肉桂醇酯化效果如图9所示。由图可看出,在无溶剂体系中,肉桂醇的酯化率最高,故对于 Pp-CALB催化合成乙酸肉桂酯而言,无溶剂体系的酯化效果明显优于有机溶剂,这可能与无溶剂体系增大了底物的浓度有关,而且无溶剂体系比有机溶剂体系更具优势,可简化后续分离提纯过程。
2.8 全细胞催化剂在肉桂醇转酯反应中的操作稳定性

图10 全细胞催化剂Pp-CALB操作稳定性Fig.10 Operational stability of the Pp-CALB
为达到降低生产成本的目的,本文研究了Pp-CALB的多次重复利用,每次反应完成后,过滤Pp-CALB,然后用丙酮连续洗涤3~4次。最后将其放入干燥剂中,在室温(30±2 ℃)中保存整夜,完全干燥后再次用于下一反应[2]。由图10可知,使用全细胞催化剂Pp-CALB连续反应10个批次,第8批次反应时,肉桂醇的酯化率仍能保持在70.00%以上,因此全细胞催化剂 Pp-CALB在本实验中表现出了良好的可重复使用性。
2.9 肉桂醇酯化反应的进程曲线

图11 脂肪酶催化合成乙酸肉桂酯反应进程曲线Fig.11 Time course of esterification catalyzed by Pp-CALB and Novozyme 435
综合以上各单因素优化的结果,在无溶剂反应体系中,酶加量0.05 g(其中添加的Pp-CALB初始水活度为0.53),肉桂醇6 mmol,乙酸乙烯酯12 mmol,反应温度50 ℃,摇床转速120 r/min,反应3 h,在此条件下比较本实验室自制全细胞催化剂 Pp-CALB与Novozyme435对乙酸肉桂酯的催化效率。由图11可知,Pp-CALB与Novozyme435合成乙酸肉桂酯有一定的差距,可能的原因是全细胞催化剂比酶活小,单位重量酵母细胞表面展示的CALB蛋白较少,而且单因素之间的交互作用没有进一步优化,Pp-CALB合成乙酸肉桂酯的催化效率有进一步提高的空间。
3 结论
3.1 本研究以毕赤酵母表面展示 CALB为全细胞催化剂,构建了无溶剂体系中肉桂醇酯的绿色合成工艺。在底物摩尔比(乙酸乙烯酯:肉桂醇)为2:1,添加0.05 g初始水活度为 0.53的全细胞催化剂 Pp-CALB,50 ℃,120 r/min的条件下反应3 h,肉桂醇酯化率可达81.34%。且该全细胞催化剂重复利用性好,连续反应8次后,肉桂醇仍能达到较高的酯化率。
3.2 全细胞催化剂Pp-CALB不但具备固定化酶的特性,而且制作过程简单,有效节省了设备投资和运行费用。且构建的无溶剂体系具有条件温和,无溶剂挥发和产物更易提取等优势,是一条环境友好的酶法合成工艺路线,为优质香料的高效制备与应用奠定了基础。
[1]Waghmare G V, Chatterji A, Rathod V K. Kinetics of enzymatic synthesis of cinnamyl butyrate by immobilized lipase [J]. Applied Biochemistry & Biotechnology, 2017,183(4): 1-15
[2]Tomke P D, Rathod V K. Ultrasound assisted lipase catalyzed synthesis of cinnamyl acetate via transesterification reaction in a solvent free medium [J]. Ultrasonics Sonochemistry,2015, 27: 241-246
[3]Mantashlob F. p-Toluenesulfonyl chloride (p-TsCl) as a new and effective catalyst for acetylation and formylation of hydroxyl compounds under mild conditions [J]. Journal of Applied Chemistry, 2009, 21(12): 1430-1434
[4]Qiu R, Zhu Y, Xu X, et al. Zirconocene bis(perfluorooctanesulfonate)s-catalyzed acylation of alcohols,phenols, thiols, and amines under solvent-free conditions [J].Catalysis Communications, 2009, 10(14): 1889-1892
[5]Devulapelli V G, Weng H S. Synthesis of cinnamyl acetate by solid-liquid phase transfer catalysis: Kinetic study with a batch reactor [J]. Catalysis Communications, 2009, 10(13):1638-1642
[6]Moyo M. Catalytic oxidation of cinnamyl alcohol tocinnamaldehyde using hydrogenperoxide [J]. Carbon, 2012,2: 2250-3498
[7]Bokade V V, Yadav G D. Transesterification of edible and nonedible vegetable oils with alcohols over heteropolyacids supported on acid-treated clay [J]. Industrial & Engineering Chemistry Research, 2009, 48(21): 9408-9415
[8]Suslick K S, Casadonte D J, Doktycz S J. Ultrasonic irradiation of copper powder [J]. Chemistry of Materials,1989, 1(1): 6-8
[9]Lee J, Snyder J K. ChemInform abstract:Ultrasound-promoted diels-alder reactions: syntheses of tanshinone IIA, nortanshinone, and (+-)-Tanshindiol B [J].Journal of the American Chemical Society, 1989, 111(4):1522-1524
[10]Pizzuti L, Piovesan LA, Flores AF, et al. Environmentally friendly sonocatalysis promoted preparation of 1-thiocarbamoyl-3,5-diaryl-4,5-dihydro-1H-pyrazoles [J]. Ultrasonics Sonochemistry, 2009, 16(6): 728-731
[11]Pizzuti L, Martins P L, Ribeiro B A, et al. Efficient sonochemical synthesis of novel 3,5-diaryl-4,5-dihydro-1H-pyrazole-1-Carboximidamides [J].Ultrasonics Sonochemistry, 2010, 17(1): 34-37
[12]Gogate P R, Kabadi A M. A review of applications of cavitation in biochemical engineering/biotechnology [J].Biochemical Engineering Journal, 2009, 44(1): 60-72
[13]Rokhina, Ekaterina V, Piet, et al. Low-frequency ultrasound in biotechnology: state of the art [J]. Trends in Biotechnology,2009, 27(5): 298-306
[14]Lopresto C G, Calabrò V, Woodley J M, et al. Kinetic study on the enzymatic esterification of octanoic acid and hexanol by immobilized candida antarctica lipase B [J]. Journal of Molecular Catalysis B Enzymatic, 2014, 110(110): 64-71
[15]Wang Y, Zhang D H, Zhang J Y, et al. High-yield synthesis of bioactive ethyl cinnamate by enzymatic esterification of cinnamic acid [J]. Food Chemistry, 2016, 190: 629-633
[16]Larios A, García H S, Oliart R M, et al. Synthesis of flavor and fragrance esters using Candida antarctica lipase [J].Applied Microbiology & Biotechnology, 2004, 65(4): 373-376
[17]Anderson E M, Larsson K M, Kirk O. One biocatalyst-many applications: The use of candida antarctica B-lipase in organic synthesis [J]. Biocatalysis & Biotransformation, 1998,16(3): 181-204
[18]Welsh F W, Williams R E, Dawson K H. Lipase mediated synthesis of low molecular weight flavor esters [J]. Journal of Food Science, 1990, 55(6): 1679-1682
[19]Yadav GD, Trivedi AH. Kinetic modeling of immobilized-lipase catalyzed transesterification of n-octanol with vinyl acetate in non-aqueous media [J]. Enzyme & Microbial Technology, 2003, 32(7): 783-789
[20]Yadav G D, Devendran S. Lipase catalyzed synthesis of cinnamyl acetate via transesterification in non-aqueous medium [J]. Process Biochemistry, 2012, 47(3): 496-502
[21]Kondo A, Ueda M. Yeast cell-surface display-applications of molecular display [J]. Applied Microbiology &Biotechnology, 2004, 64(1): 28-40
[22]Fukuda H, Kondo A, Noda H. Biodiesel fuel production by transesterification of oils [J]. Journal of Bioscience &Bioengineering, 2001, 92(5): 405
[23]Han Z, Han S, Zheng S, et al. Enhancing thermostability of a Rhizomucor miehei lipase byengineering a disulfide bond and displaying on the yeast cell surface [J]. Appl. Microbiol.Biotechnol., 2009, 85(1): 117-126
[24]Huang D, Han S, Han Z, et al. Biodiesel production catalyzed by Rhizomucor miehei, lipase-displaying Pichia pastoris,whole cells in an isooctane system [J]. Biochemical Engineering Journal, 2012, 63(3): 10-14
[25]Su G D, Huang D F, Han S Y, et al. Display of Candida antarctica lipase B on Pichia pastoris and its application to flavor ester synthesis [J]. Applied Microbiology &Biotechnology, 2010, 86(5): 1493
[26]Pan Wang, Li Zhang, Ying Lin, et al. Accurate analysis of fusion expression of Pichia pastoris glycosylphosphatidylinositol-modified cell wall proteins [J]. Society for Industrial Microbiology and Biotechnology, 2017, 44(9): 1355-1365
[27]Zhang L, Liang S, Zhou X, et al. Screening for glycosylphosphatidylinositol-modified cell wall proteins in Pichia pastoris and their recombinant expression on the cell surface [J]. Applied and Environmental Microbiology, 2013,79(18): 5519
[28]Kordel M, Hofmann B, Schomburg D, et al. Extracellular lipase of pseudomonas sp. strain ATCC 21808: purification,characterization, crystallization, and preliminary X-ray diffraction data [J]. Journal of Bacteriology, 1991, 173(15):4836
[29]Pan Z, Han S, Lin Y, et al. Expression of candida antarctica lipase B on yeast surface and synthesis of ethyl hexanoate catalyzed by CALB [J]. Chinese Journal of Biotechnology,2008, 24(4): 673-678
[30]金子.毕赤酵母细胞展示的CALB脂肪酶的表征及非水相催化特性研究[D].广州:华南理工大学,2013 JIN Zi. Representation of the Candida antarctica lipase B-displaying Pichia pastoris and it’s catalytic characteristics in non-aqueous phase [D]. Guangzhou: South China University of Technology, 2013
[31]Gokalp N, Ulker C, Guvenilir YA. Synthesis of polycaprolactone via ring opening polymerization catalyzed bycandida antarcticalipase B immobilized onto an amorphous silica support [J]. Journal of Polymer Materials,2016, 33(1): 87-100
[32]郑穗平,任昌琼.表面展示南极假丝酵母脂肪酶B的毕赤酵母全细胞催化合成糖酯[J].生物工程学报,2009, 25(12):1933-1939 ZHENG Sui-ping, REN Chang-qiong. Synthesis of glucose laurate monoester catalyzed by Candida antarctica lipase B-displaying Pichia pastoris whole-cells [J]. Chinese Journal of Biotechnology, 2009, 25(12): 1933-1939
[33]Duan Y, Du Z, Yao Y, et al. Effect of molecular sieves on lipase-catalyzed esterification of rutin with stearic acid [J].Journal of Agricultural & Food Chemistry, 2006, 54(17):6219-6225
[34]Ma L, Persson M, Adlercreutz P. Water activity dependence of lipase catalysis in organic media explains successful transesterification reactions [J]. Enzyme & Microbial Technology, 2002, 31(7): 1024-1029
