苦瓜水提物和醇提物对HepG2细胞胰岛素抵抗的调节作用
2018-06-11祝莹罗远平白娟张易肖香董英
祝莹,罗远平,白娟,张易,肖香,董英
(江苏大学食品与生物工程学院,江苏镇江 212013)
随着人类生活方式的改变,以肥胖为核心的代谢综合征已成为影响人类健康最主要的非传染性慢性疾病之一。而肥胖可诱导机体胰岛素抵抗(Insulin resistance,IR)的发生,继而产生葡萄糖耐受不良、血脂紊乱等症状[1]。胰岛素抵抗是指组织(肝脏、骨骼肌和脂肪等)对胰岛素敏感性下降,机体代偿性的分泌过多胰岛素产生高胰岛素血症,以维持血糖的稳定。因此,长期胰岛素抵抗引起的糖脂代谢紊乱最终会导致2型糖尿病、非酒精性脂肪肝等疾病的发生[2]。
肝脏是胰岛素作用的靶组织,是胰岛素抵抗产生的主要部位。HepG2细胞是一种表型与肝细胞极为相似的肝胚胎瘤细胞株,经诱导剂的刺激可使表面胰岛素受体数目下降,从而使细胞呈现胰岛素抵抗状态[3]。已有研究表明胰岛素抵抗与过量摄入高脂饮食密切相关。血液中过量的游离脂肪酸会对肝脏产生脂毒性,削弱胰岛素受体的信号转导,从而降低胰岛素敏感性[4]。棕榈酸是饮食和血清中最常见的饱和脂肪酸,因此,通过棕榈酸诱导建立 HepG2胰岛素抵抗细胞模型,是体外研究功能活性成分改善胰岛素抵抗作用途径的良好试验模型[5]。
苦瓜(Momordica charantia L.)富含多糖、皂苷、多酚和多肽等多种活性成分,长期以来被用于预防和改善肥胖、糖尿病,本课题组前期通过动物试验证实苦瓜具有改善胰岛素抵抗、调节糖脂代谢的作用[6,7]。目前研究发现苦瓜中活性成分调脂降糖途径主要有通过修复胰岛β细胞来调节胰岛素释放;或是通过改善葡萄糖代谢促进葡萄糖转化,刺激糖原的贮存;或是发挥胰岛素类似物的作用,促进外周组织的葡萄糖摄取[8],但仍存争议。苦瓜作为天然食品,其复杂的成分必然导致其作用的多样性,对于其不同组分对胰岛素抵抗作用的异同点还有待进一步研究。
本文通过棕榈酸诱导建立了 HepG2胰岛素抵抗(HepG2-IR)细胞模型,从糖脂代谢途径研究苦瓜水提物和醇提物对胰岛素抵抗调节作用的异同点,为揭示苦瓜改善胰岛素抵抗的机制提供试验依据。
1 材料与方法
1.1 试验材料与仪器设备
1.1.1 试验材料与试剂
HepG2细胞购自中国科学院上海生命科学院生物化学与细胞生物研究所;苦瓜购自扬中绿健苦瓜种植基地。
DMEM(Dulbecco's Modified Eagle Medium)高糖培养液、胎牛血清,美国Gibco公司;葡萄糖测定试剂盒、糖原测定试剂盒、甘油三酯(TG)测定试剂盒、BCA(Bicinchoninic Acid)法蛋白浓度测定试剂盒、ATP测定试剂盒,南京建成生物工程研究所;四甲基偶氮唑盐(MTT)、棕榈酸、牛血清白蛋白、二甲双胍,美国Sigma公司;荧光定量PCR引物,上海生工生物工程技术服务有限公司;荧光定量PCR相关试剂,Takara公司;其他生化试剂均为分析纯,购自国药集团上海化学试剂有限公司。
1.1.2 仪器与设备
UV-9600紫外可见分光光度计,北京瑞丽分析仪器公司;CO2恒温培养箱,芬兰Thermo公司;Leica DM2500倒置荧光显微镜,德国莱卡有限公司;荧光定量PCR,美国Bio-Rad公司;B040234全自动酶标仪,美国Thermo公司;96孔板、25 cm2培养瓶,美国Corning公司。
1.2 试验方法
1.2.1 苦瓜水提物和醇提物的制备
鲜苦瓜去籽切片冻干后,在江苏大学食品与生物工程学院中心实验室制备苦瓜粉。称取100 g苦瓜粉,加入1000 mL水室温浸提12 h,过滤后上清液冻干即为苦瓜水提物(BMWE)。称取 100 g苦瓜粉,加入500 mL石油醚回流脱脂,过滤后将残渣40 ℃烘干,加入1000 mL的乙醇,室温搅拌12 h后离心,上清液旋蒸挥掉乙醇后冻干得到苦瓜醇提物(BMEE)。
1.2.2 苦瓜水提物和醇提物的成分测定
苦瓜提取物中多糖含量的测定采用苯酚-硫酸法;苦瓜提取物中皂苷含量的测定采用徐斌等[9]采用的方法;苦瓜提取物中多酚含量的测定采用FoLin-CiocaLteu法;苦瓜提取物中蛋白含量的测定采用考马斯亮蓝法。
1.2.3 细胞培养
HepG2细胞用含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM高糖培养液于37 ℃、5% CO2培养箱培养。
1.2.4 胰岛素抵抗HepG2细胞模型的建立
将HepG2细胞接种于96板中,37 ℃培养24 h后,弃去上清液,换成不含血清的DMEM 高糖培养液饥饿12 h,弃去上清液,用PBS洗2次,再加入含有棕榈酸的无血清培养液(棕榈酸终浓度为0.25 mM)[10]诱导12 h后,即为HepG2-IR细胞模型。
1.2.5 细胞存活率的测定
以2×104个/mL的接种密度将HepG2细胞接种于96孔板,分为正常组、阴性组和苦瓜提取物组,每组6个平行。细胞饥饿12 h后,正常组加入无血清DMEM培养液,阴性组和苦瓜提取物组采用1.2.4的方法建立胰岛素抵抗HepG2细胞模型,其中苦瓜提取物组的棕榈酸诱导液同时分别加入50、100、250、500、750、1000、2000 μg/mL的BMWE和BMEE(浓度为培养液中的终浓度),12 h后,弃去上清,用PBS洗2次,加入无酚红培养液继续培养12 h。最后每孔加入20 μL MTT(终浓度为0.5 mg/mL)培养4 h,弃去上清液,每孔加200 μL DMSO溶解结晶颗粒(另设6个空白孔),于570 nm波长处测定OD值。细胞存活率(%)=(试验组 OD 值-空白 OD 值)/(正常组 OD 值-空白 OD值)×100%。
1.2.6 葡萄糖消耗量的测定
HepG2细胞接种于96孔板,试验分为空白组(不含细胞)、正常组、阴性组、苦瓜提取物组和二甲双胍组(Met),除空白组、正常组外,其他各组按照1.2.4的方法建立HepG2-IR细胞模型。二甲双胍组和苦瓜提取物组在模型建立期间分别加入含有2 mM二甲双胍(前期试验已经证明其对细胞存活率无影响)和不同浓度的苦瓜提取物(选取1.2.5试验筛选出的浓度)的培养液,作用12 h后继续采用无酚红培养液培养12 h。采用葡萄糖测定试剂盒检测培养液中的葡萄糖含量,同时采用 MTT法测定细胞存活率,葡萄糖消耗量相对含量(%)=[(空白组葡萄糖含量-试验组葡萄糖含量)/试验组MTT值]/[(空白组葡萄糖含量-正常组葡萄糖含量)/正常组MTT值]×100%。
1.2.7 胞内糖原、甘油三酯及ATP含量的测定
取HepG2细胞以2.5×105个/孔接种于6孔板,试验分为正常组、阴性组和苦瓜提取物组(选取 1.2.6试验筛选出的浓度),在模型建立过程中加药物培养12 h。
糖原和蛋白含量采用试剂盒测定。糖原相对含量(%)=(试验组糖原含量/试验组蛋白浓度)/(正常组糖原含量/正常组蛋白浓度)×100%。
甘油三酯(TG)和蛋白浓度采用试剂盒测定。TG相对含量(%)=(试验组 TG 含量/试验组蛋白浓度)/(正常组TG含量/正常组蛋白浓度)×100%。
ATP和蛋白含量采用试剂盒测定。ATP相对含量(%)=(试验组ATP含量/试验组蛋白浓度)/(正常组ATP含量/正常组蛋白浓度)×100%。
1.2.8 胰岛素抵抗信号通路相关基因转录水平的测定
HepG2细胞接种于6孔板,试验分为正常组、阴性组、BMWE500组(选取上述试验筛选出的最佳浓度500 μg/mL)和BMEE250组(选取上述试验筛选出的最佳浓度250 μg/mL)。
采用RNA提取试剂盒提取总RNA,反转录试剂盒制备cDNA,用Real-time PCR法检测IRS1(胰岛素受体1)、PI3K(磷脂酰肌醇-3-激酶)、AKT(蛋白激酶B)、AMPK(腺苷酸活化蛋白激酶)、ACC2(乙酰辅酶A羟化酶2)、CPT1(肉毒碱棕榈酰转移酶1)的基因表达水平,并选取GAPDH(甘油醛-3-磷酸脱氢酶)为内参基因,采用Primer Express 3.0软件设计引物,并由上海生工生物工程技术服务有限公司合成。引物序列如表1所示。扩增条件为:95 ℃预变性5 min,95 ℃变性 30 s、60 ℃退火 30 s、72 ℃延伸 1 min,共进行35个循环,72 ℃延伸10 min。扩增反应完成后测定吸光值,采用2-ΔΔCt方法计算mRNA相对表达量。

表1 引物列表Table 1 Primer sequence
1.2.9 统计处理
各组数据以±SD 表示,采用 SPSS 18.0中ANOVA模块对试验数据进行方差分析。
2 结果与讨论
2.1 BMEE和BMWE中成分分析
由表2可以看出,BMEE和BMWE中主要活性成分多糖和皂苷的含量具有较大差异。BMWE中多糖含量显著高于BMEE(p<0.05),说明苦瓜中多糖主要为水溶性;而BMEE中皂苷的含量显著高于BMWE(19.24% vs. 4.84%),这是由于皂苷属于醇溶性物质,因此BMEE中皂苷显著高于BMWE。
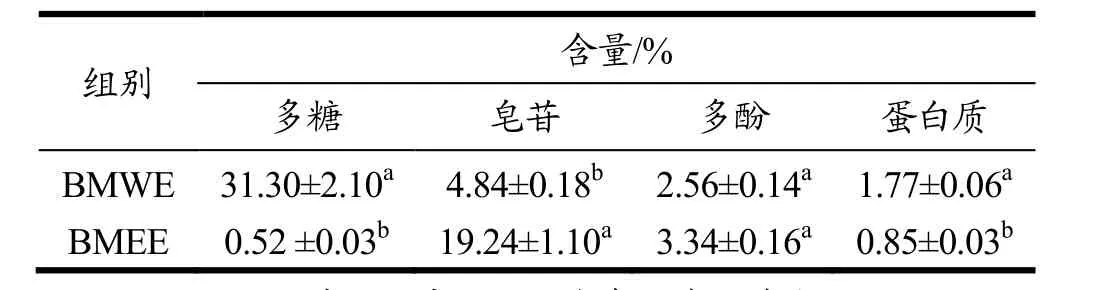
表2 BMWE和BMEE中多糖、皂苷、多酚和蛋白质含量Table 2 The content of polysaccharide, sapnins, phenolics and protein in BMWE and BMEE
此外,BMEE和BMWE的多酚含量分别为3.34%和 2.56%,无显著差异;蛋白含量分别为 0.85%和1.77%,具有显著差异,说明蛋白水溶性比醇溶性多。
2.2 BMWE和BMEE对HepG2-IR细胞活性的影响
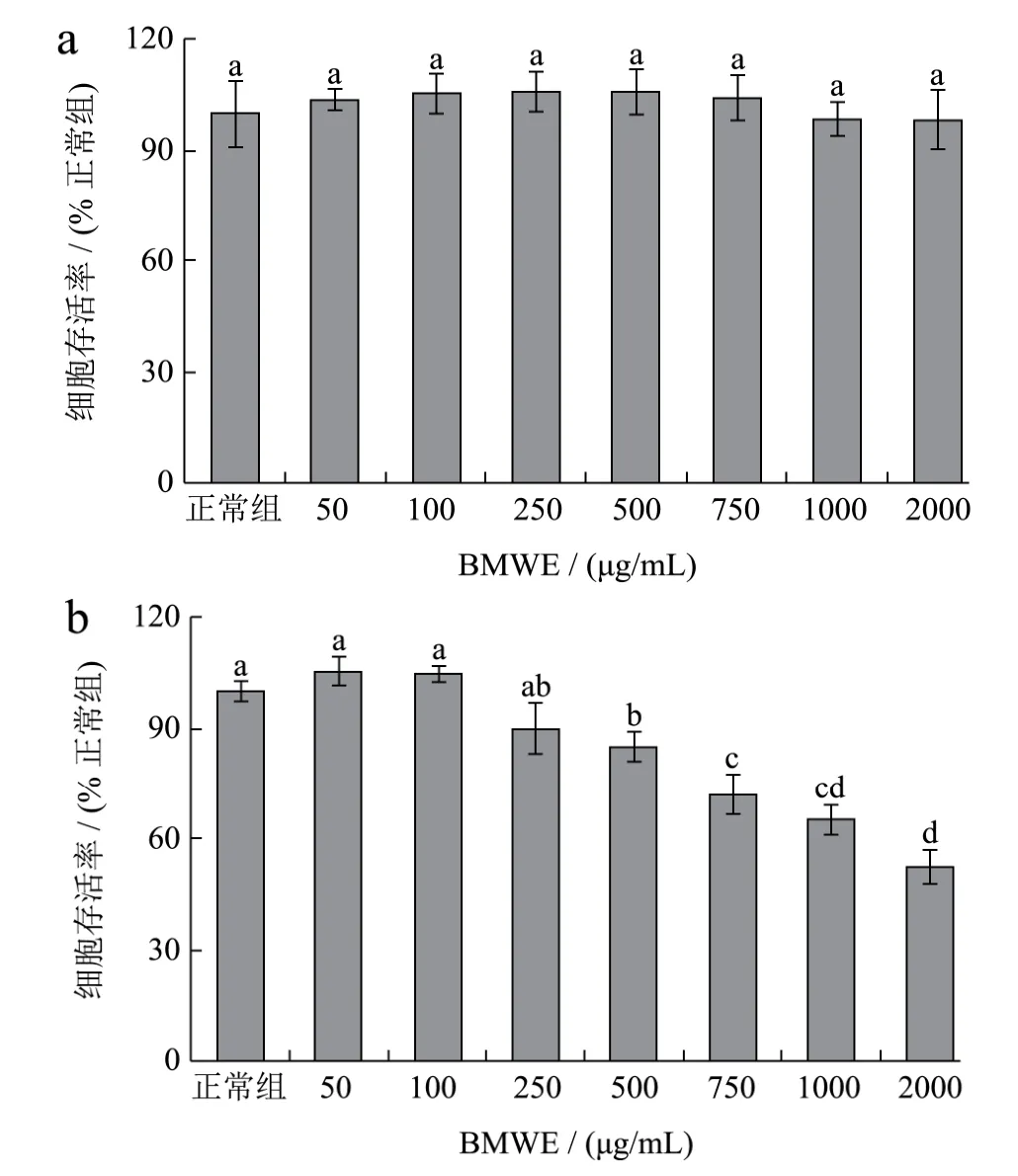
图1 不同浓度BMWE和BMEE对HepG2细胞存活率的影响Fig.1 Effects of different concentrations of BMWE and BMEE on the survival rate of HepG2 cells
图1显示了不同浓度BMWE和BMEE作用12 h对HepG2细胞存活率的影响。
从图1a可以看出,采用BMWE作用HepG2细胞12 h,50~2000 μg/mL BMWE对细胞活力皆无显著影响,试验组细胞与正常组细胞存活率相当(p>0.05)。因此,确定50~2000 μg/mL为试验中BMWE浓度。从图1b可以看出,当BMEE的浓度由50增加至250 μg/mL时,对细胞活力无显著影响(p>0.05),而当作用浓度为500、750、1000、2000 μg/mL时,细胞存活率随着浓度的增加显著减小,分别为84.67%、71.69%、65.12%和 55.00%,与正常组(100%)具有显著差异(p<0.05),表明BMEE浓度大于500 μg/mL时会对细胞生长产生明显的抑制作用。因此,BMEE的浓度范围确定为 50~250 μg/mL。
2.3 BMWE和BMEE对HepG2-IR细胞葡萄糖消耗量的影响

图2 不同浓度BMWE和BMEE对HepG2细胞葡萄糖消耗量的影响Fig.2 Effects of different concentrations of BMWE and BMEE on the glucose consumption of HepG2 cells
不同浓度BMWE和BMEE对HepG2细胞葡萄糖消耗量的影响如图2所示。从图2a和图2b中均可以看出,经棕榈酸诱导后,阴性组细胞葡萄糖消耗量显著低于正常组(78.58%、78.51% vs. 100.00%)(p<0.05),说明 HepG2-IR细胞模型建模成功。从图2a还可发现,50、100、2000 μg/mL BMWE组细胞的葡萄糖消耗量与阴性组无显著性差异(p>0.05),而250、500、750、1000 μg/mL BMWE能显著增加HepG2胰岛素抵抗细胞的葡萄糖消耗量(分别为84.65%、94.90%、89.59%和90.01%)(p<0.05),其中 500 μg/mL BMWE效果最优。如图 2b所示,BMEE作用浓度为100和250 μg/mL时均能显著增加HepG2胰岛素抵抗细胞葡萄糖消耗量(分别为86.99%和91.38%)(p<0.05),且BMEE浓度越高其细胞的葡萄糖消耗量越高,呈现一定的量效关系。二甲双胍也可增加IR细胞的葡萄糖消耗量(分别为96.03%和96.13%),主要是由于二甲双胍可促进细胞的葡萄糖转运。
BMWE和BMEE均对IR细胞葡萄糖消耗量有一定的作用效果,但作用浓度有一定的差异,这可能是由于BMWE和BMEE中含有的活性成分的种类与数量均不同导致的。Roffey等[11]发现苦瓜水提物能增加3T3-L1脂肪细胞的葡萄糖消耗量,这可能与细胞中脂联素的分泌量增加有关。BMEE中皂苷含量较高,而前人的研究表明[12]苦瓜皂苷能刺激 GLUT4(葡萄糖转运蛋白 4)转移到细胞膜上,从而促进葡萄糖进入细胞。因此BMWE和BMEE均能有效改善HepG2模型细胞的胰岛素抵抗,增加葡萄糖消耗量。
2.4 BMWE和BMEE对HepG2-IR细胞糖原含量的影响

图3 BMWE和BMEE对胰岛素抵抗HepG2细胞糖原和TG含量的影响Fig.3 Effects of BMWE and BMEE on the glycogen and TG content of HepG2-IR cells
肝脏是机体调节血糖的主要部位,肝脏可通过糖异生和肝糖原的合成与分解来调节血糖浓度。如图3a所示,经棕榈酸诱导12 h后,与正常组相比,HepG2-IR细胞中糖原的含量显著降低(70.47% vs. 100.00%)(p<0.05),说明肝细胞的糖代谢发生紊乱;而 500 μg/mL的BMWE和250 μg/mL的BMEE可显著增加IR细胞的糖原含量(88.15%、86.09%),与阴性组具有显著差异(p<0.05)。说明BMWE和BMEE均可以通过抑制糖异生、促进肝糖原的合成来调节HepG2-IR细胞的糖代谢。
2.5 BMWE和BMEE对HepG2-IR细胞甘油三酯含量的影响
糖脂代谢紊乱会导致输送至肝细胞的游离脂肪酸量增加,并在胞内积累生成甘油三酯,使肝细胞出现小泡性脂变,进一步降低肝细胞对胰岛素的敏感性。由图3b数据可知,经棕榈酸诱导后,肝细胞内TG过度积累,与正常组相比,HepG2-IR细胞中TG含量可达132.97%;而BMWE和BMEE均能降低HepG2-IR细胞中TG含量,但仅BMEE250组与阴性组具有显著差异(112.08% vs. 132.97%)(p<0.05),说明BMEE对IR细胞TG含量的影响优于BMWE。苦瓜醇提物中主要含有的活性成分有三萜皂苷类,Popovich等研究发现苦瓜三萜皂苷可显著减少前脂肪细胞分化为脂肪细胞过程中的脂质积累,同时降低胞内甘油三酯含量,因此BMEE能显著降低HepG2-IR细胞的TG含量[13]。
2.6 BMWE和BMEE对HepG2-IR细胞ATP含量的影响

图4 BMWE和BMEE对胰岛素抵抗HepG2细胞ATP含量的影响Fig.4 Effects of BMWE and BMEE on the ATP content of HepG2-IR cells
ATP是一种高能磷酸化合物,在细胞中,它与ADP的相互转化实现贮能和放能,从而保证细胞各项生命活动的能量供应。ATP含量反映了细胞能量代谢水平,棕榈酸会导致细胞线粒体呼吸链的解偶联,降低细胞内ATP含量,使氧化磷酸化进入空转状态,造成肝细胞能量代谢紊乱[14]。图4显示的是BMWE和BMEE对胰岛素抵抗HepG2细胞ATP含量的影响。经棕榈酸诱导后,与正常组相比,阴性组细胞中ATP含量显著降低(48.44% vs. 100.00%)(p<0.05);100和250 μg/mL的BMEE可显著增加细胞中ATP含量(分别为66.46%和80.62%),与阴性组具有显著差异(p<0.05),而BMWE500和BMWE750未能显著增加 IR 细胞内 ATP含量(p>0.05)。BMEE能提高IR-HepG2细胞中ATP水平可能是由于BMEE能抑制线粒体呼吸链的解偶联,从而促进ATP的正常产生,具体机制还需进一步研究。而BMWE对HepG2-IR细胞中ATP水平无显著作用,说明BMEE和BMWE对IR细胞ATP含量的作用具有显著差异。
2.7 BMWE和BMEE对HepG2-IR细胞IRS1、PI3K、AKT、AMPK、ACC2和CPT1 mRNA表达水平的影响

图5 BMEE对胰岛素抵抗HepG2细胞IRS1、PI3K、AKT、AMPK、ACC2、CPT1 mRNA表达水平的影响Fig.5 Effects of BMEE on the IRS1, PI3K, AKT, AMPK, ACC2 and CPT1 mRNA levels of HepG2-IR cells
IRS1-PI3K-AKT信号通路的阻断是胰岛素抵抗的重要特征[15]。胰岛素经β细胞分泌后作用于细胞表面的胰岛素受体,胰岛素受体激活后磷酸化 IRS1,进而激活PI3K,PI3K可活化AKT,活化的AKT可通过促进葡萄糖的代谢。由图5数据可知,与正常组相比,阴性组细胞中IRS1 mRNA表达水平显著降低(0.87 vs. 1.0)(p<0.05),而经BMWE和BMEE作用模型细胞12 h后,BMEE可将HepG2-IR细胞的IRS1 mRNA表达水平上调到与正常组无显著性差异(p>0.05),而BMWE则更能显著提高IRS1 mRNA表达水平(1.25 vs. 0.87)。阴性组细胞中PI3K mRNA表达水平显著低于正常组(0.81 vs. 1.0)(p<0.05),而BMWE500、BMEE250组细胞中PI3K mRNA表达水平均显著增加(分别为1.31和1.15),且BMWE500组的效果更优。阴性组细胞的AKT mRNA表达水平显著低于正常组(0.83 vs. 1.0),BMWE能显著增加细胞中 AKT mRNA表达水平(1.27 vs. 0.83)(p<0.05),而BMEE虽也能增加AKT mRNA的表达水平(0.87),但与阴性组无显著差异(p>0.05)。因此,BMWE可通过调节IRS1-PI3K-AKT通路增加葡萄糖消耗量和糖原含量,抑制糖异生;BMEE也能部分调节 IRS1-PI3K-AKT通路的表达水平,但其效果弱于BMWE。
AMPK-ACC2-CPT1通路是葡萄糖摄取和脂肪酸氧化的关键途径。AMPK是影响脂肪酸代谢平衡的重要靶点,可减少糖异生、促进葡萄糖转运及脂肪酸脂解和氧化;ACC2是丙二酰辅酶A合成的限速酶,而丙二酰辅酶A可促进脂肪酸合成[16];CPT1为线粒体脂肪酸β氧化的主要酶,ACC2能抑制CPT1的表达。AMPK能够磷酸化ACC2使其失活,进而促进了CPT1调节的脂肪酸β氧化,并减少脂质在外周组织的沉积[17]。BMWE和 BMEE对 HepG2-IR细胞AMPK、ACC2、CPT1 mRNA表达水平的影响如图5所示。阴性组细胞的AMPK mRNA表达水平显著低于正常组(0.87 vs. 1.0)(p<0.05),BMWE和BMEE均能显著增加AMPK mRNA表达量(分别为1.10和1.48),且BMEE效果更好。与正常组相比,阴性组ACC2 mRNA表达水平显著增加(1.86 vs. 1.0)(p<0.05),BMWE和 BMEE能显著降低 ACC2 mRNA表达水平(分别为1.20和0.99)。阴性组细胞CPT1 mRNA表达水平显著低于正常组(0.68 vs. 1.0)(p<0.05),BMWE500和 BMEE250均能显著增加CPT1 mRNA表达水平(分别为0.82和1.40)。结果表明,BMWE和BMEE均能调节AMPK-ACC2-CPT1通路,从而增加线粒体中脂肪酸氧化,减少脂质积累,改善 IR细胞的糖脂代谢,且 BMEE的效果更优。
3 结论
苦瓜水提物和醇提物均能显著增加HepG2-IR细胞的葡萄糖消耗量及糖原含量,并提高IRS1、PI3K、AMPK和 CPT1 mRNA的表达水平,降低 ACC2 mRNA的表达水平;同时苦瓜水提物可增加胞内AKT mRNA的表达水平,苦瓜醇提物能降低HepG2-IR细胞TG含量,增加ATP水平。因此BMWE主要通过激活胰岛素抵抗细胞的 IRS1-PI3K-AKT信号通路促进细胞摄取葡萄糖及抑制糖异生,从而改善细胞胰岛素抵抗状态;而 BMEE则主要通过调节AMPK-ACC2-CPT1信号通路促进线粒体的脂肪酸氧化、减少TG积累,改善胰岛素抵抗细胞的糖脂代谢,二者的作用途径有所不同。
[1]Eckel R H, Grundy S M, Zimmet P Z. The metabolic syndrome [J].The Lancet, 2005, 365(9468): 1415-1428
[2]Perry R J, Camporez J-P G., Kursawe R, et al. Hepatic acetyl CoA links adipose tissue inflammation to hepatic insulin resistance and type 2 diabetes [J].Cell, 2015, 160(4):745-758
[3]Zang M, Zuccollo A, Hou X, et al. AMP-activated protein kinase is required for the lipid-lowering effect of metformin in insulin-resistant human HepG2 cells [J].Journal of Biological Chemistry, 2004, 279(46): 47898-47905
[4]Kovacs P, Stumvoll M. Fatty acids and insulin resistance in muscle and liver [J].Best Practice & Research Clinical Endocrinology & Metabolism, 2005, 19(4): 625-635
[5]Jung T W, Lee K T, Lee M W, et al. SIRT1 attenuates palmitate-induced endoplasmic reticulum stress and insulin resistance in HepG2 cells via induction of oxygen-regulated protein 150 [J].Biochemical and Biophysical Research Communications, 2012, 422(2): 229-232
[6]祝莹,董英,钱希文,等.苦瓜冻干超微粉调节肥胖大鼠胰岛素抵抗及其作用机制研究[J].中国食品学报,2014, 14(7):5-13 ZHU Ying, DONG Ying, QIAN Xi-wen, et al. Mechanism research of bitter melon lyophilized superfine grinding powder on insulin resistance in nutritional obese rats [J].Journal of Chinese Institute of Food Science and Technology,2014, 14(7): 5-13
[7]Bai J, Zhu Y, Dong Y. Response of gut microbiota and inflammatory status to bitter melon (Momordica charantiaL.)in high fat diet induced obese rats [J].Journal of Ethnopharmacology, 2016, 194: 717-726
[8]Grover J, Yadav S. Pharmacological actions and potential uses ofMomordica charantia: A review [J].Journal of Ethnopharmacology, 2004, 93(1): 123-132
[9]徐斌,董英.分光光度法测定苦瓜总皂甙含量[J].食品科学,2006,26(10):165-169 XU Bin, DONG Ying. Determination on total saponins ofMomordica CharantiaL. by spectrophotometry [J]. Food Science, 2005, 26(10): 165-169
[10]张易,董英,祝莹,等.苦瓜碱提多糖调节HepG2细胞胰岛素抵抗的途径[J].中国食品学报,2016,16(12):10-16 ZHANG, Yi, DONG Ying, ZHU Ying, et al. Regulation pathway of polysaccharides fromMomordica CharantiaL. to the insulin resistant of HepG2 Cell [J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(12):10-16
[11]Roffey B W, Atwal A S, Johns T, et al. Water extracts fromMomordica charantiaincrease glucose uptake and adiponectin secretion in 3T3-L1 adipose cells [J].Journal of Ethnopharmacology, 2007, 112(1): 77-84
[12]Tan M J, Ye J M, Turner N, et al. Antidiabetic activities of triterpenoids isolated from bitter melon associated with activation of the AMPK pathway [J].Chemistry & Biology,2008, 15(3): 263-273
[13]Popovich D G, Li L, Zhang W. Bitter melon (Momordica charantia) triterpenoid extract reduces preadipocyte viability,lipid accumulation and adiponectin expression in 3T3-L1 cells [J].Food and Chemical Toxicology, 2010, 48(6):1619-1626
[14]Cho J, Zhang Y, Park S Y, et al. Mitochondrial ATP transporter depletion protects mice against liver steatosis and insulin resistance [J].Nature Communications, 2017, 8:14477
[15]Wu W, Gan W, Tong M, et al. Over-expression of NYGGF4(PID1) inhibits glucose transport in skeletal myotubes by blocking the IRS1/PI3K/AKT insulin pathway [J].Molecular Genetics and Metabolism, 2011, 102(3): 374-377
[16]O’Neill H M, Lally J S, Galic S, et al. AMPK phosphorylation of ACC2 is required for skeletal muscle fatty acid oxidation and insulin sensitivity in mice [J].Diabetologia, 2014, 57(8): 1693-1702
[17]Schreurs M, Kuipers F, Van Der Leij F. Regulatory enzymes of mitochondrialβ-oxidation as targets for treatment of the metabolic syndrome [J].Obesity Reviews, 2010, 11(5): 380-388
