PLAC1特异性TCR基因修饰T细胞对乳腺癌的抗肿瘤作用
2018-06-11李琼书成先义胡源陈洁莹巩秀肖东胡祥刘未斌
李琼书 成先义 胡源 陈洁莹 巩秀 肖东 胡祥 刘未斌
乳腺癌是女性最常见的肿瘤之一,全世界每年约50万人病死于乳腺癌。国内主要城市10年来乳腺癌发病率上升了37﹪,高于世界平均增长水平[1-2]。目前,乳腺癌的治疗方法主要是采取手术为主,辅以化疗、放疗及内分泌治疗等综合治疗方式[3-4]。但乳腺癌患者五年生存率仍低于20﹪[5]。另外,对于三阴性(雌激素受体ER、黄体酮受体PR和表皮生长因子受体HER2表达阴性)乳腺癌的治疗缺乏有效的靶向治疗手段[6]。因此寻找和建立有效的乳腺癌辅助治疗手段是亟待解决的科学问题。随着分子生物学、基因工程技术及免疫学的飞速发展,以免疫治疗为基础的生物治疗已成为乳腺癌治疗的第五大模式,并显示出良好的应用前景。目前,肿瘤抗原特异性T细胞受体 (T-cell receptors,TCR)基因被相继分离出来,使通过转导TCR基因产生抗原特异性T细胞成为可能,也为得到有治疗价值的T细胞提供了有利的手段。研究已证实,靶向癌症睾丸抗原(cancer-testis antigen,CT)如NYESO-1,MAGE-A3,CEA 和 gp100 的 TCR 基因修饰T细胞在治疗滑膜肉瘤、多发性骨髓瘤以及黑色素瘤等肿瘤中已取得了较好的临床疗效[7-10],证明肿瘤抗原特异性TCR基因修饰T细胞具有较强的抗肿瘤效果,是比较有前景的抗肿瘤免疫治疗手段。
胎盘特异性基因1(placenta-specific 1,PLAC1)是CT抗原中的新一员。CT抗原家族最典型的特征是在正常组织的表达仅限于生殖细胞,或(和)胎盘滋养层组织,但在肿瘤组织的表达呈广泛性。研究已证实,PLAC1在多种肿瘤尤其在乳腺癌中异常活化和高表达[11-13]。在临床样本分析检测中表明,PLAC1在82﹪的乳腺癌患者中高表达;在乳腺癌细胞MCF-7和BT-549中通过siRNA干扰了PLAC1的表达后抑制了细胞增殖、迁移和侵袭[11]。这些结果提示,PLAC1在乳腺癌发生发展中扮演了重要作用,是乳腺癌的重要癌基因,可作为乳腺癌抗肿瘤免疫治疗的新靶点。但是,目前为止,还没有PLAC1抗原特异性的TCR基因修饰T细胞被研究开发用于抗肿瘤免疫治疗。
本研究通过基因工程的方法,将PLAC1特异性的人类白细胞抗原分型为A2(HLA-A2)限制性的TCR基因导入T细胞,研究PLAC1特异性TCR基因修饰T细胞对乳腺癌细胞的体内、外抗肿瘤作用,为乳腺癌患者的个体化治疗、表达PLAC1抗原的肿瘤治疗开辟新思路。
材料与方法
一、实验材料
乳腺癌细胞系MCF-7 和 MDA-MB-231,以及病毒包装细胞系HEK293T购自美国模式菌种收集中心(ATCC);RPMI 1640 培养液和胎牛血清购自美国Gibco公司;青霉素和链霉素购自碧云天生物技术有限公司;CD8+T 细胞分选试剂盒和T细胞活化、扩增试剂盒购自德国美天旎公司;人AB血清、聚凝胺和雌二醇购自美国Sigma公司;白细胞介素2(IL-2)购自美国Peprotech公司;重组慢病毒 载 体PLAC1-TCR-pCDH-EF1-MCS-T2A-Puro、慢病毒空载体pCDH-EF1-MCS-T2A-Puro、 pLP1、pLP2和 pLP-VSVG为深圳市北科生物科技有限公司研发中心保存;Lipofectamine 2000购自美国Invitrogen公司;FITC-CD8抗体、PerCP-Cy5.5-CD3抗体、PE-HLA-A2抗体和Matrigel 基质胶购自美国BD公司;兔抗人PLAC1抗体购自英国Abcam公司;兔IgG购自碧云天生物技术有限公司,PE-羊抗兔IgG购自北京全式金生物公司;PE标记的 HLA-A2/PLAC1(28-36)-multimer购自英国Proimmune公司;IFN-γ ELISA检测试剂盒购自美国R&D Systems公司;WST-1 购自德国Roche公司;4 ~ 6周龄的雌性BALB/c 裸鼠购自广东省医学实验动物中心;IX71倒置荧光显微镜购自日本Olympus公司;酶标仪购自美国BioTek公司;流式细胞仪FACS Calibur购自美国BD公司。
二、实验方法
1.细胞培养:乳腺癌细胞系MCF-7和 MDAMB-231以及慢病毒包装细胞系HEK293T用含10﹪胎牛血清的RPMI 1640培养基培养,添加100 U/ml青霉素和100 U/ml链霉素。置于37 ℃CO2体积分数为5﹪的培养箱中培养。对CD8+T细胞的分离培养,取基因分型为HLA-A2健康志愿者外周抗凝血(肝素钠)100 ml(实验经健康志愿者知情同意并经过北京大学深圳医院医学伦理委员会审批),通过淋巴细胞分离液离心提取PBMC,计数PBMC总量为(1 ~ 2)×108个。用CD8+T细胞分选试剂盒根据说明书分选CD8+T细胞为(1 ~ 2)×107个,采用T细胞活化、扩增试剂盒以及含有10﹪ AB血清和400 U/ml IL-2的RPMI 1640培养液进行扩增。通过流式检测CD8+T细胞的免疫表型。
2.PLAC1特异性TCR重组慢病毒载体的构建:为了产生PLAC1特异性T细胞克隆,前期采用了与Sommermeyer等[14]类似的方法:采用HLA-A2 志愿者的DC细胞负载PLAC1抗原肽之后递呈自身CD8+T细胞,使表达抗原特异性TCR的T细胞大量扩增,分选和克隆PLAC1抗原特异性TCR的α/β链序列。采用连接肽T2A连接TCR的α和β链,产生PLAC1特异性TCR基因序列(TCRα-T2A-TCRβ)。将 PLAC1特异性 TCR 基因序列通过EcoR I和BamH I酶切位点整合入慢病毒表达载体pCDH-EF1-MCS-T2A-PURO(图1b),从而产生重组慢病毒载体PLAC1-TCR-pCDH-EF1-MCS-T2A-Puro。
3.PLAC1特异性TCR基因修饰T细胞:培养HEK293T细胞,当细胞生长至对数生长期,0.25﹪胰酶消化,将细胞铺于100 mm的小皿,每个皿1 × 106个细胞。24 h后,细胞密度达到80﹪融合,采用Lipofectamine 2000按照说明书操作将3.0 μg PLAC1-TCR-pCDH-EF1-MCS-T2A-Puro 重组质粒(或3.0μg pCDH-EF1-MCS-T2A-Puro空载体)、3.0 μg包装质粒pLP1、3.0 μg pLP2和3.0μg pLP-VSVG转染细胞,4 h后吸弃含有质粒-脂质体复合物的培养基,换成正常完全培养基进行培养。48 h后,收取含有病毒的培养上清液,通过超滤浓缩,0.22 μm的滤膜过滤除菌。将收取的含有TCR基因的慢病毒侵染CD8+T细胞,添加聚凝胺(终浓度5 μg/ml)增强感染效率,得到TCR转基因T细胞,称为TCR-T细胞,以对照病毒侵染的CD8+T细胞作为对照细胞,称为NC-T细胞。采用PE标记的HLA-A2/PLAC1(28-36)-multimer通过流式细胞仪FACS Calibur检测TCR在CD8+T细胞中的正确表达率。
4.免疫荧光检测乳腺癌细胞系PLAC1的表达:采用生长至对数生长期的MCF-7和 MDA-MB-231细胞,胰酶消化后铺96孔板,每孔接种2×104个细胞,次日,弃培养板上清液,采用PBS洗孔板3次,向每孔中加入100 μl 4﹪多聚甲醛室温固定20 min,PBS洗 3次,2﹪ BSA 封闭 30 min,将兔抗人PLAC1抗体以及兔IgG进行1 : 300稀释,每孔加50 μl,4 ℃冰箱中孵育过夜。次日,吸弃上清液,PBS洗3次,加入 PE 标记的山羊抗兔二抗,室温下孵育 1 h,PBS 洗 3 次,每孔加 100 μl PBS,于Olympus倒置荧光显微镜下观察结果并进行图像采集。
5.流式检测细胞表型及PLAC1特异性TCR表达:通过细胞计数收集细胞(1 × 106),FACS 液(含有0.1﹪ NaN3和2﹪ FBS的PBS缓冲液)洗2 次,用 FACS 溶液冰上封闭 30 min,600×g,4 ℃离心5 min,弃上清液;用FACS液将 FITC-CD8抗体、PerCP-Cy5.5-CD3抗体和PE-HLA-A2抗体进行100倍稀释;将PE-HLA-A2/PLAC1 (28-36)-multimer进行10倍稀释,以每管100 μl的体积加入细胞样本,置于冰上孵育30 min。FACS 液洗2次,通过流式细胞仪检测CD8+T细胞中CD3+CD8+的表达比例,PLAC1特异性TCR表达效率以及乳腺癌细胞HLA-A2的表达。
6.WST-1法检测TCR-T细胞对乳腺癌细胞的细胞毒作用:根据文献[15-16]报道,采用WST-1法检测TCR-T细胞对乳腺癌细胞的杀伤效应。收集培养至第14天的TCR-T细胞以及NC-T细胞作为效应细胞,分别以对数生长期的MCF-7和MDAMB-231细胞为靶细胞。调整靶细胞密度为1×105个/ml,加入96孔平底细胞培养板中,100 μl/孔;次日,细胞贴壁后按效靶比5 : 1、10 : 1和20 : 1加入不同浓度的TCR-T细胞或NC-T细胞100 μl,以单独靶细胞及单独的不同浓度的效应细胞作为对照组,每组设3个重复孔。共培养3 h后,加入WST-1溶液 20 μl/孔,继续培养 4 h,轻轻振荡 1 min,酶标仪检测450 nm波长处各孔的吸光度(A值)。按下列公式计算细胞的增殖抑制率= [1-(实验组A值-效应细胞A值)/靶细胞A值 ] × 100﹪。
7.ELISA检测TCR-T细胞与乳腺癌细胞共培养后细胞因子的释放:按照上述方法将效应细胞TCR-T细胞或NC-T细胞分别与靶细胞MCF-7和MDA-MB-231共培养3 h后,收集共培养上清液,采用IFN-γ ELISA检测试剂盒根据说明书要求检测IFN-γ的释放量。酶标仪检测450 nm吸光度值。
8.PLAC1特异性TCR基因修饰T细胞体内抗肿瘤研究:实验经北京大学深圳医院医学伦理委员会审批。取4 ~ 6周龄雌性裸鼠15只,每只裸鼠按照3 mg/kg体重的量皮下注射雌二醇。2周后,在每只小鼠右腋下皮下注射混有50 μl Matrigel 的5× 106个乳腺癌细胞MCF-7建立裸鼠皮下移植瘤模型,成模后,小鼠随机分成3组:生理盐水对照组,NC-T细胞组和TCR-T细胞组。以NC-T细胞和TCR-T细胞作为效应细胞,尾静脉注射1×107个/次,注射总体积为200 μl,共治疗2次,每周进行1次。生理盐水组以注射相同体积的生理盐水代替。每周用游标卡尺监测肿瘤长径和短径2 ~ 3次,计算肿瘤体积,长度为a mm,宽度为b mm,肿瘤体积计算公式 =(π/6)ab2。
三、统计学分析方法
采用SPSS11.0进行统计学分析,T细胞表型,HLA-A2表达水平,细胞增殖抑制率,IFN-γ的释放水平以及小鼠肿瘤体积均采用± s表示,多组间比较采用F检验,两组间比较采用独立t检验。以P< 0.05为差异具有统计学意义。
结 果
一、PLAC1特异性TCR基因修饰CD8+ T细胞的构建
磁珠分选HLA-A2志愿者外周血PBMC中的CD8+T细胞,流式检测CD8+T细胞的表型,分选出的CD8+T细胞的CD3+CD8+比例达到(98.89±0.30)﹪(图1a)。通过慢病毒载体构建(慢病毒载体图谱见图1b)、包装,将可识别乳腺癌肿瘤抗原PLAC1的HLA-A2限制性的TCR基因导入经磁珠分选培养的CD8+T细胞,得到TCR-T细胞,以慢病毒空载体包装、感染的CD8+T细胞作为对照细胞(NC-T细胞),采用PE-HLA-A2/PLAC1(28-36)-multimer染色,通过流式检测结果表明TCR-T细胞中PLAC1特异性TCR表达率为(24.58±0.82)﹪,NC-T细胞中不表达PLAC1特异性 TCR(图 1c、d)。
二、PLAC1和 HLA-A2 阳性表达的乳腺癌细胞的鉴定
通过免疫荧光染色检测乳腺癌细胞中PLAC1的表达情况,结果如图2所示,在MCF-7和 MDA-MB-231细胞中可见代表PLAC1表达的红色荧光分布于整个细胞膜,PLAC1表达呈强阳性。以对照抗体(兔IgG)进行染色则未见荧光分布。流式检测结果显示,MCF-7和 MDA-MB-231(三阴性乳腺癌)细胞中HLA-A2的表达效率分别为(93.04±1.36)﹪ 和(98.72±0.12)﹪(图 3)。 因此,MCF-7和 MDA-MB-231细 胞 为 HLA-A2和PLAC1 双阳性细胞(HLA-A2+,PLAC1+),可作为PLAC1特异性TCR-T细胞的靶细胞用于后续抗肿瘤实验研究。
三、PLAC1-TCR基因修饰CD8+ T细胞在体外对乳腺癌细胞具有杀伤用
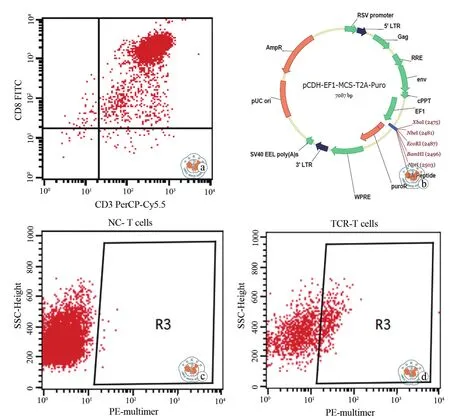
图1 流式鉴定CD8+ T细胞的免疫表型以及PLAC1特异性TCR的过表达效率
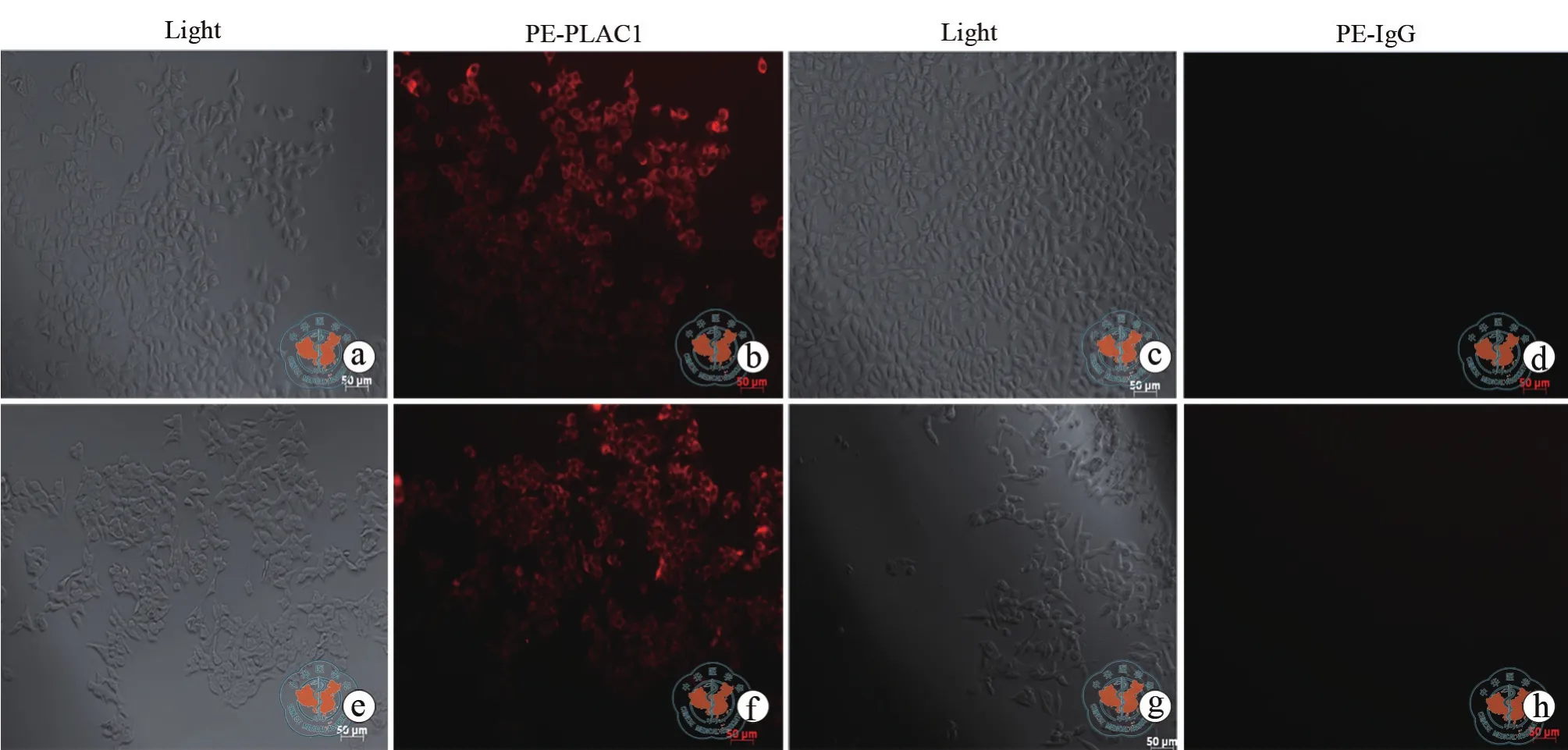
图2 免疫荧光检测乳腺癌细胞系MCF-7和MDA-MB-231中PLAC1的表达(×100)

图3 流式检测乳腺癌细胞系MCF-7和MDA-MB-231中HLA-A2血清型的表达
WST-1法检测结果显示(表 1、2),与 NC-T 细胞相比,在同等效靶比下TCR-T细胞对MCF-7(HLA-A2+,PLAC1+)和 MDA-MB-231(HLA-A2+,PLAC1+)细胞的增殖抑制率增强(P< 0.01),且随着效靶比的增加抑制率升高。ELISA结果显示(表3、4),与 MCF-7 和 MDA-MB-231 共培养后,TCR-T细胞的IFN-γ的释放水平在同等效靶比下高于NC-T细胞(P< 0.01),且随着效靶比的增加释放量升高。
表1 WST-1法检测NC-T细胞和TCR-T细胞与乳腺癌细胞MCF-7共培养后对乳腺癌细胞的抑制率(n =3,﹪, ± s)
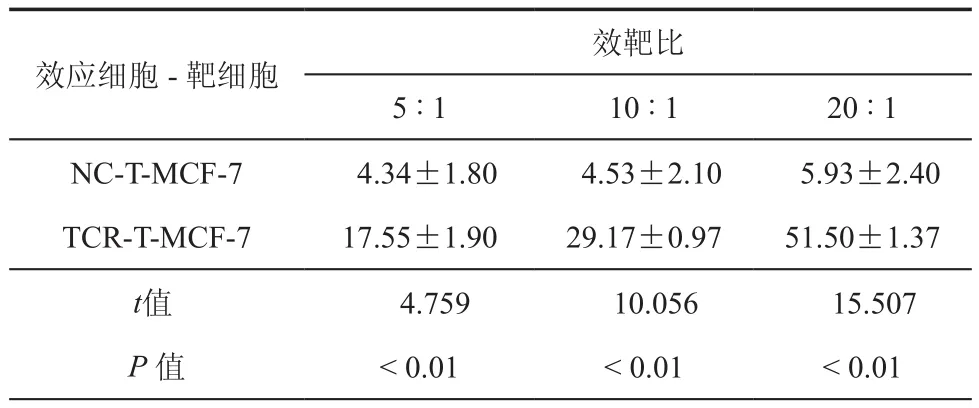
表1 WST-1法检测NC-T细胞和TCR-T细胞与乳腺癌细胞MCF-7共培养后对乳腺癌细胞的抑制率(n =3,﹪, ± s)
效应细胞-靶细胞效靶比5 : 1 10 : 1 20 : 1 NC-T-MCF-7 4.34±1.80 4.53±2.10 5.93±2.40 TCR-T-MCF-7 17.55±1.90 29.17±0.97 51.50±1.37 t值 4.759 10.056 15.507 P 值 < 0.01 < 0.01 < 0.01
表2 WST-1法检测NC-T细胞和TCR-T细胞与乳腺癌细胞MDAMB-231共培养后对乳腺癌细胞的抑制率(n =3,﹪± s)
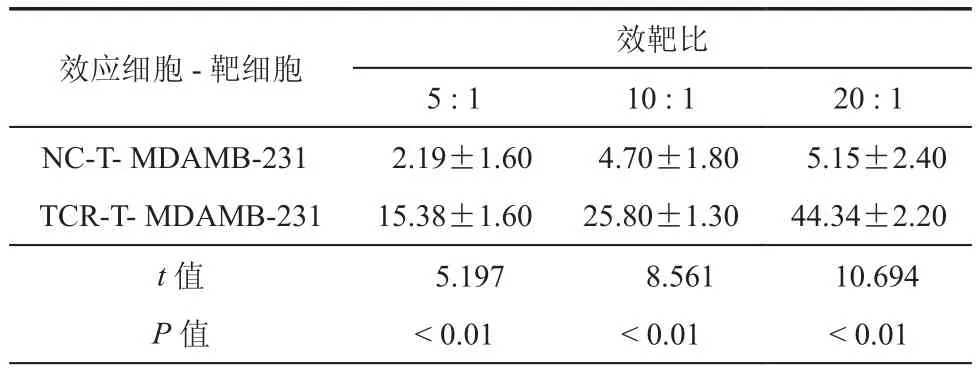
表2 WST-1法检测NC-T细胞和TCR-T细胞与乳腺癌细胞MDAMB-231共培养后对乳腺癌细胞的抑制率(n =3,﹪± s)
效应细胞-靶细胞 效靶比5 : 1 10 : 1 20 : 1 NC-T- MDAMB-231 2.19±1.60 4.70±1.80 5.15±2.40 TCR-T- MDAMB-231 15.38±1.60 25.80±1.30 44.34±2.20 t值 5.197 8.561 10.694 P值 < 0.01 < 0.01 < 0.01
表3 ELISA检测NC-T细胞和TCR-T细胞与乳腺癌细胞MCF-7共培养后T细胞IFN-γ的释放水平(n =3,pg/ml± s)

表3 ELISA检测NC-T细胞和TCR-T细胞与乳腺癌细胞MCF-7共培养后T细胞IFN-γ的释放水平(n =3,pg/ml± s)
效应细胞-靶细胞效靶比5 : 1 10 : 1 20 : 1 NC-T-MCF-7 9.06±7.40 15.64±6.58 18.14±6.22 TCR-T-MCF-7 108.98±6.34 207.64±9.16 347.49±4.10 t值 -17.627 -29.476 -76.638 P值 < 0.01 < 0.01 < 0.01
表4 ELISA检测NC-T细胞和TCR-T细胞与乳腺癌细胞MDAMB-231共培养后T细胞IFN-γ的释放水平(n =3,pg/ml,± s)

表4 ELISA检测NC-T细胞和TCR-T细胞与乳腺癌细胞MDAMB-231共培养后T细胞IFN-γ的释放水平(n =3,pg/ml,± s)
效靶比5 : 1 10 : 1 20 : 1 NC-T- MDAMB-231 7.34±6.11 10.00±6.41 14.70±6.38 TCR-T- MDAMB-231 65.44±4.51 108.51±6.60 255.25±6.85 t值 -13.25 -18.540 -44.526 P 值 < 0.01 < 0.01 < 0.01效应细胞-靶细胞
四、PLAC1-TCR基因修饰CD8+ T细胞在体内抑制裸鼠皮下人乳腺癌移植瘤生长
在裸鼠皮下人乳腺癌移植瘤实验中,生理盐水组和NC-T细胞移植组小鼠的肿瘤生长迅速,TCR-T细胞治疗组小鼠肿瘤生长相对缓慢。在移植后第35天,生理盐水组、NC-T细胞组和TCR-T细胞组小鼠肿瘤的平均体积分别 为(5 636.96±2 879.55) mm3、(5 522.12±3 391.48) mm3和(1 403.85± 1 394.31) mm3,TCR-T细胞治疗组小鼠肿瘤平均体积小于生理盐水 组(F= 0.1813,P< 0.05)和 NC-T 细 胞 组(F=0.1307,P< 0.05)。TCR基因修饰T细胞在体内有抑制乳腺癌进展的作用。
讨 论
由于大多数肿瘤抗原在一些正常组织中表达,导致以TCR为基础的过继性免疫疗法难免对正常组织产生细胞毒作用[17]。因此,目前过继性免疫细胞治疗研究的热点是使T细胞靶向正常组织中不表达的肿瘤特异性抗原。由于CT抗原在多种肿瘤类型中过度表达而在正常组织中的表达仅限于生殖细胞,而生殖细胞由于缺乏MHC分子的表达而不能递呈抗原,不能被TCR基因修饰的T细胞识别,因此CT抗原已成为肿瘤免疫靶向治疗的理想靶点。PLAC1作为CT抗原的新成员,在乳腺癌中高度表达,并且在乳腺癌细胞的增殖、迁移和侵袭调控中扮演重要作用[18],提示PLAC1是乳腺癌的重要癌基因,可作为乳腺癌抗肿瘤免疫治疗的新靶点。另外,HLA-A2血清型是中国人群中最广泛表达的HLA-I类分子[19],提示HLA-A2限制性和PLAC1特异性TCR基因修饰T细胞是较有前景的抗肿瘤免疫治疗手段。但是,目前为止,还没有PLAC1抗原特异性的TCR基因修饰T细胞被研究开发用于抗肿瘤免疫治疗。
为了产生PLAC1特异性T细胞克隆,本研究前期采用了与Sommermeyer等[14]类似的方法:采用HLA-A2 志愿者的DC细胞负载PLAC1抗原肽之后递呈自身CD8+T细胞,使表达抗原特异性TCR的T细胞大量扩增并进行分选,再用5'-RACEPCR方法克隆PLAC1抗原特异性TCR的α/β链序列。之后利用基因工程的方法,通过慢病毒载体将可识别PLAC1的TCR基因导入CD8+T细胞,产生TCR-T细胞以及对照细胞NC-T细胞。通过MHCPLAC1五聚体检测TCR-T细胞中PLAC1特异性TCR的正确表达率为(24.58±0.82)﹪,NC-T细胞中不表达PLAC1特异性TCR,成功将PLAC1特异性TCR基因导入T细胞。
由于通过以上方法产生的PLAC1特异性TCR是HLA-A2限制性的,因此,为了研究TCR基因修饰T细胞的体外抗肿瘤活性,首先通过免疫荧光和流式检测非侵袭性乳腺癌细胞MCF-7和三阴性乳腺癌细胞MDA-MB-231中PLAC1和HLA-A2的表达情况,结果表明MCF-7 和MDA-MB-231细胞为HLA-A2和PLAC1双阳性细胞,与Liu 等结果一致[13,18]。之后以TCR-T细胞或对照细胞NC-T细胞作为效应细胞,分别以MCF-7和MDA-MB-231细胞作为靶细胞进行细胞杀伤实验。WST-1结果证实,在同等效靶比下,TCR-T细胞对MCF-7和MDA-MB-231细胞的增殖抑制率高于NC-T细胞(P< 0.05),且随着效靶比的增加抑制率升高。ELISA结果显示与MCF-7和MDA-MB-231共培养后,TCR-T细胞IFN-γ的分泌水平高于NC-T细胞(P< 0.05)。这些结果表明,PLAC1特异性 TCR基因修饰T细胞对乳腺癌细胞具有高效的杀伤作用。由于PLAC1广泛高表达于乳腺癌细胞中,本研究中未能找到PLAC1弱表达或者不表达的乳腺癌细胞系作为对照,这是本研究的不足之处,在以后的研究中将会继续研究PLAC1特异性TCR基因修饰T细胞抗肿瘤的特异性。
在裸鼠皮下人乳腺癌移植瘤实验中,与生理盐水组和NC-T细胞组相比,TCR-T细胞移植后抑制了乳腺癌模型小鼠肿瘤的生长,证实了TCR-T细胞在体内具有抗肿瘤作用。由于研究已报导,T细胞可以渗透到黑素瘤移植瘤小鼠的肿瘤中[20]发挥作用,并且本研究的结果也表明TCR基因修饰T细胞与乳腺癌细胞共培养后能特异性释放IFN-γ,因此,推测PLAC1特异性TCR 基因修饰T细胞也可能浸润到了乳腺癌移植瘤的肿瘤部位从而杀死肿瘤细胞,并且通过释放IFN-γ调节肿瘤微环境从而抑制肿瘤生长。
综上所述,本研究的体内、外实验结果表明PLAC1特异性的TCR基因修饰T细胞对乳腺癌具有较强的抗肿瘤作用;PLAC1可作为乳腺癌治疗的潜在靶标;PLAC1特异性TCR基因修饰T细胞治疗是PLAC1表达阳性乳腺癌治疗的新策略。
1 郑莹, 吴春晓, 张敏璐.乳腺癌在中国的流行状况和疾病特征[J].中国癌症杂志, 2013, 23(8):561-569.
2 Siegel RL, Miller KD, Jemal A.Cancer statistics, 2015[J].CA Cancer J Clin, 2015, 65(1):5-29.
3 Mondal D, Sharma DN.External beam radiation techniques for breast cancer in the new millennium: New challenging perspectives[J].J Egypt Natl Canc Inst, 2016, 28(4):211-218.
4 Bernal-Estévez D, Sánchez R, Tejada RE, et al.Chemotherapy and radiation therapy elicits tumor specific T cell responses in a breast cancer patient[J].BMC Cancer, 2016, 16:591.
5 Nakai K, Hung MC, Yamaguchi H.A perspective on anti-EGFR therapies targeting triple-negative breast cancer[J].Am J Cancer Res,2016, 6(8):1609-1623.
6 Foulkes WD, Smith IE, Reis-Filho JS.Triple-negative breast cancer[J].N Engl J Med, 2010, 363(20):1938-1948.
7 Rapoport AP, Stadtmauer EA, Binder-Scholl GK, et al.NY-ESO-1-specific TCR-engineered T cells mediate sustained antigen-specific antitumor effects in myeloma[J].Nat Med, 2015, 21(8):914-921.
8 Chinnasamy N, Wargo JA, Yu Z, et al.A TCR targeting the HLAA*0201-restricted epitope of MAGE-A3 recognizes multiple epitopes of the MAGE-A antigen superfamily in several types of cancer[J].J Immunol, 2011, 186(2):685-696.
9 Chodon T, Comin-Anduix B, Chmielowski B, et al.Adoptive transfer of MART-1 T-cell receptor transgenic lymphocytes and dendritic cell vaccination in patients with metastatic melanoma[J].Clin Cancer Res,2014, 20(9):2457-2465.
10 Parkhurst MR, Joo J, Riley JP, et al.Characterization of genetically modif i ed T-cell receptors that recognize the CEA:691-699 peptide in the context of HLA-A2.1 on human colorectal cancer cells[J].Clin Cancer Res, 2009, 15(1):169-180.
11 Koslowski M, Sahin U, Mitnacht-Kraus R, et al.A placenta-specific gene ectopically activated in many human cancers is essentially involved in malignant cell processes[J].Cancer Res, 2007, 67(19):9528-9534.
12 Devor EJ, Leslie KK.The oncoplacental gene placenta-specif i c protein 1 is highly expressed in endometrial tumors and cell lines[J].Obstet Gynecol Int, 2013, 2013:807849.
13 Koslowski M, Tureci O, Biesterfeld S, et al.Selective activation of trophoblast-specific PLAC1 in breast cancer by CCAAT/enhancerbinding protein beta (C/EBPbeta) isoform 2[J].J Biol Chem, 2009,284(42):28607-28615.
14 Sommermeyer D, Conrad H, Kroenig H, et al.NY-ESO-1 antigenreactive T cell receptors exhibit diverse therapeutic capability[J].Int J Cancer, 2013, 132(6):1360-1367.
15 Fortmüller K, Alt K, Gierschner D, et al.Effective targeting of prostate cancer by lymphocytes redirected by a PSMA x CD3 bispecif i c singlechain diabody[J].Prostate, 2011, 71(6):588-596.
16 徐梅, 李丹, 蒋敬庭,等.CIK细胞联合紫杉醇对卵巢癌SKOV-3细胞的体外杀伤效应 [J].肿瘤, 2014, 34(7):591-595.
17 Adamina M.When gene therapy meets adoptive cell therapy: better days ahead for cancer immunotherapy?[J].Expert Rev Vaccines, 2010,9(4):359-363.
18 Cocchia M, Huber R, Pantano S, et al.PLAC1, an Xq26 gene with placenta-specif i c expression[J].Genomics, 2000, 68(3):305-312.
19 Liu W, Zhai M, Wu Z, et al.Identification of a novel HLA-A2-restricted cytotoxic T lymphocyte epitope from cancer-testis antigen PLAC1 in breast cancer[J].Amino Acids, 2012, 42(6):2257-2265.
20 Gammaitoni L, Giraudo L, Leuci V, et al.Effective activity of cytokine-Induced killer cells against autologous metastatic melanoma including cells with stemness features[J].Clin Cancer Res, 2013, 19(16):4347-4358.
